Manejo perioperatorio de la cirugía de citorreducción con quimioterapia intraperitoneal hipertérmica
Carlos Videla,* Sabrina Di Stéfano
Unidad de Terapia Intensiva de Adultos del Hospital Italiano de Buenos Aires, CABA, Argentina
* Correspondencia: cgvidela@hotmail.com
Los
autores no declaran conflictos de intereses.
Resumen
Se define a la carcinomatosis peritoneal como la diseminación tumoral dentro de la cavidad abdominal secundaria al crecimiento de los tumores de la superficie peritoneal o de órganos viscerales. Esta condición, independientemente del origen del tumor primario, suele estar asociada con la progresión de la enfermedad oncológica de base y lleva aparejado un peor pronóstico a corto plazo. En los últimos años, la mejor comprensión de las vías de diseminación tumoral asociada con la función protectora de la barrera del peritoneo contra la diseminación cancerígena, ha hecho que la carcinomatosis peritoneal sea considerada una enfermedad locorregional. En consecuencia, han surgido nuevas estrategias terapéuticas que combinan la cirugía de citorreducción con la quimioterapia intraperitoneal hipertérmica en pacientes que sufren carcinomatosis peritoneal secundaria a tumores de origen apendicular, gastrointestinal, ginecológico y a mesotelioma peritoneal, con resultados prometedores en cuanto a la prolongación de la supervivencia.
El objetivo de esta monografía es hacer una revisión bibliográfica del manejo perioperatorio de los pacientes que se someten a una cirugía de citorreducción asociada a quimioterapia intraperitoneal hipertérmica y explicar los fundamentos fisiológicos con las posibles complicaciones de este procedimiento asociadas a los cambios hemodinámicos, respiratorios y metabólicos.
Palabras clave: Quimioterapia intraperitoneal hipertérmica; citorreducción; carcinomatosis peritoneal; monitoreo hemodinámico.
Abstract
Peritoneal carcinomatosis is defined
as the tumor spread within the abdominal cavity secondary to the growth of
peritoneal surface or visceral organ tumors. Regardless of the primary tumor
origin, this condition is usually associated with progression of the underlying
oncologic disease and carries a worse prognosis in the short term. In recent
years, the understanding of tumor dissemination pathways associated with the
protective function of the peritoneal barrier against cancer spread, has led to
consider peritoneal carcinomatosis as a locoregional disease. This has prompted
the emergence of new therapeutic strategies that combine cytoreductive surgery
with hyperthermic intraperitoneal chemotherapy in patients suffering from
peritoneal carcinomatosis secondary to tumors of appendicular,
gastrointestinal, gynecological origin, and peritoneal mesothelioma with promising
results in terms of increased survival rate. The objective of this article is
to review literature on the perioperative management of patients undergoing
cytoreduction surgery associated with hyperthermic intraperitoneal
chemotherapy, explaining the physiological basis with its possible
complications associated with hemodynamic, respiratory, and metabolic changes.
Key words: Hyperthermic intraperitoneal
chemotherapy; HIPEC; cytoreduction; peritoneal carcinomatosis; hemodynamic
monitoring.
Cirugía de citorreducción y quimioterapia intraperitoneal hipertérmica
La carcinomatosis peritoneal (CP) es una manifestación común de los tumores digestivos y ginecológicos.1 Hasta hace no muchos años, esta entidad era considerada una etapa final de la enfermedad oncológica, y la supervivencia era de aproximadamente seis meses. En los últimos tiempos, varios autores, entre ellos Sugarbaker,2 han desarrollado una técnica multimodal que incluye la citorreducción y la quimioterapia intraperitoneal hipertérmica (hyperthermic intraperitoneal chemotherapy, HIPEC) con resultados prometedores. En un estudio multicéntrico retrospectivo, Elias et al observaron que, en pacientes con carcinoma colorrectal y CP tratados con esta técnica combinada, la supervivencia al año, a los 3 y a los 5 años era del 81%, 41% y 27%, respectivamente, con una media de 30.1 meses.3 A su vez, en revisiones sistemáticas llevadas a cabo por Yan y por Sugarbaker, se llega a la conclusión de que, si bien el nivel de evidencia es bajo por la heterogeneidad de los estudios, el tratamiento combinado de cirugía de citorreducción más HIPEC aumenta la supervivencia en pacientes con CP secundaria a cáncer gastrointestinal.4,5 Se han llevado a cabo revisiones sistemáticas similares en pacientes con CP secundaria a cáncer de ovario,6 seudomixoma peritoneal7 y mesotelioma peritoneal,8 tratados con cirugía de citorreducción e HIPEC. Se observó una prolongación de la supervivencia y de los meses sin enfermedad al comparar con quimioterapia sistémica y cirugía paliativa. Por lo tanto, en la actualidad, la combinación de cirugía de citorreducción e HIPEC en pacientes con CP secundaria a cáncer colorrectal, gástrico, de ovario y a mesotelioma peritoneal forma parte del tratamiento estándar, siempre que se efectúe en centros especializados con una unidad de terapia intensiva que cuente con profesionales experimentados en el manejo de estos pacientes.
Es fundamental el trabajo
multidisciplinario de oncólogos, cirujanos, anestesiólogos e intensivistas, ya
que la morbilidad por dicha cirugía es alta (25-41%) y se puede dividir en dos
grandes etapas: la relacionada con el acto quirúrgico (alteraciones
hemodinámicas y respiratorias que predominan en la fase de la quimioterapia
hipertérmica, sangrados, fístulas intestinales, íleo, etc.) y la relacionada
con los agentes quimioterapéuticos en sí (citopenias, toxicidad renal o
hepática, entre otros).9
La correcta selección de los pacientes es uno de los eslabones fundamentales de esta técnica. El diagnóstico prequirúrgico debe aportar información sobre el origen del tumor y la extensión de la enfermedad. Si bien la tomografía computarizada abdomino-pelviana suele ser uno de los estudios que se solicita con más frecuencia, el método más confiable para la estadificación del tumor sigue siendo la clasificación intraquirúrgica mediante el índice de CP (Peritoneal Carcinomatosis Index, PCI). Este puntaje, creado por el propio Sugarbaker, divide a la cavidad abdominal en nueve compartimentos y al intestino delgado en cuatro regiones. A su vez, según el tamaño de las lesiones tumorales, se le otorga un puntaje de 0 a 3, por lo que el PCI mínimo y máximo es de 0 y 39, respectivamente (Figura 1). Varios análisis comprueban que los pacientes con un PCI <20 sobre 39 obtienen mejores resultados en cuanto a la supervivencia; el valor del índice es un factor pronóstico independiente.3,8,10 De hecho, se sugiere que si el PCI es >20, asociado con otro factor de mal pronóstico, como un mal estado general o la progresión de la enfermedad durante la quimioterapia sistémica, estaría contraindicado seguir con la HIPEC, porque la tasa de supervivencia a los 5 años es inferior al 10%.
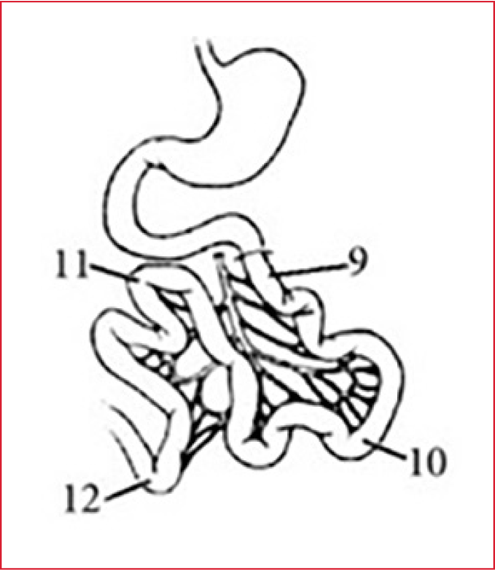
Figura 1. Regiones: 0: Centro / 1: Hipocondrio derecho / 2: Epigastrio / 3: Hipocondrio izquierdo / 4: Flanco izquierdo / 5: Zona inferior izquierda / 6: Pelvis / 7: Zona inferior derecha / 8: Flanco derecho / 9: Yeyuno alto / 10: yeyuno bajo / 11: Íleon alto / 12: Íleon bajo.
Score de lesión: LS S0: sin lesión / LS S1: Tumor hasta 0.5 cm / LS S2: Tumor hasta 5 cm / LS S3: Tumor mayor a 5 cm o confluente.
Imagen tomada de: Macrí A, Saladino E, Adamo V, et al. The treatment of peritoneal carcinomatosis in elderly patients. Geriatrics 2010; 10(Suppl 1): A11.
Otro eslabón importante es la cirugía de citorreducción en sí. Esta operación consiste en realizar una peritonectomía (tanto visceral como parietal) de las áreas afectadas por el tumor, omentectomía y resecciones viscerales según la infiltración tumoral. El objetivo es la completa citorreducción intentando lograr un puntaje de 0 o 1 (CCR0: sin tumor visible/CCR1: residuo tumoral <2,5 mm), ya que estos pacientes tienen un mejor pronóstico que aquellos que persisten con un puntaje más alto (Figura 2).
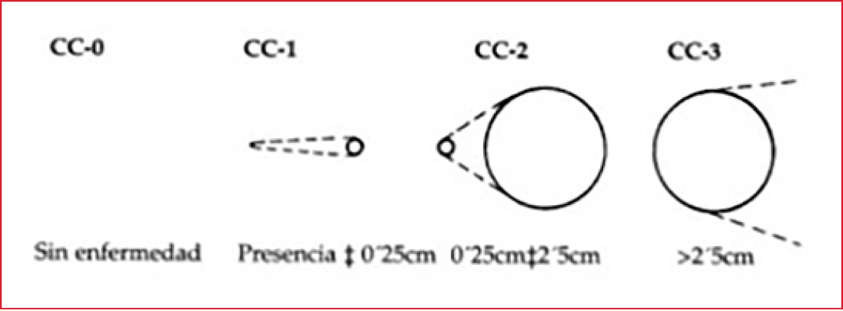
Figura 2. Puntaje Citorreductivo. CC 0: sin lesión. CC-1: lesión <0,25 cm.
CC-2: lesión de entre 0,25 cm y 2,5 cm. CC-3: lesión >2,5 cm.
Imagen tomada de: Macrí A, Saladino E, Adamo V, et al. The treatment of peritoneal carcinomatosis in elderly patients. Geriatrics 2010; 10(Suppl 1):A11.
A continuación, se realiza la fase de
HIPEC que consiste en la introducción de una droga quimioterapéutica en la
cavidad abdominal a una temperatura que oscila entre 41° y 43° C. Existen dos
grandes técnicas para la aplicación: la primera se denomina abierta o en
“coliseo”, y consiste en suturar un plástico en un separador de Thompson sobre
la piel de la incisión abdominal, haciéndole un corte en el medio del plástico
para la correcta manipulación del cirujano. Aunque esta técnica permite
distribuir la droga manualmente y lograr una distribución homogénea por toda la
cavidad abdominal, su desventaja es la mayor disipación de calor por la
superficie abierta y el riesgo de exposición del equipo médico a agentes
tóxicos. La segunda técnica se denomina cerrada; luego de la cirugía de
citorreducción, se cierra la pared abdominal y, mediante drenajes abdominales, se
infunde el agente quimioterapéutico. Se requiere la agitación externa manual
del abdomen para lograr una distribución homogénea. Su principal ventaja es la
capacidad de arribar a la temperatura deseada con el mínimo contacto del
personal con el agente quimioterapéutico, asociado a un aumento de la presión
abdominal con mayor penetración de la droga en las células diana (Figura 3).11

Figura 3. a) Técnica abierta o en coliseo, b) Técnica cerrada.
Imagen tomada de: “Cáncer colorectal polimetastásico: abordaje multidisciplnario. Abordaje de la carcinomatosis de cáncer de colon vs cáncer de recto”. VI Reunión GECOP. IV Reunión SEOQ, Madrid, 2015.
Cualquiera sea la técnica elegida, primero, la cavidad abdominal se llena con una solución (líquido de diálisis o Ringer) que se calienta en una bomba hasta 41-43°C. Una vez alcanzado este punto, se vierte la droga quimioterapéutica y, luego de 30 a 120 min, se drena la solución y se lava la cavidad abdominal con solución fisiológica o Ringer.
El fundamento fisiológico de la HIPEC se
basa en las grandes concentraciones locorregionales de la droga
quimioterapéutica obtenidas al introducirla directamente en la cavidad
abdominal, utilizando el peritoneo como barrera para la absorción sistémica. Los
agentes más utilizados son aquellos que poseen una farmacocinética favorable,
es decir, un alto peso molecular que limita la difusión a través del peritoneo
y que no requieren activación hepática. A su vez, como el drenaje del peritoneo
es al sistema portal, el primer paso hepático disminuye la exposición sistémica
al metabolizarlas en metabolitos no tóxicos, disminuyendo sus efectos adversos
sistémicos.12 Los agentes quimioterapéuticos
usados dependen del tumor de origen de la CP, y los más frecuentes son:
cisplatino, oxaliplatino, mitomicina C y doxorrubicina, y sus concentraciones
dependientes del área de superficie corporal.11-13
Además del efecto farmacocinético, se adiciona el efecto sinérgico de la hipertermia; las temperaturas cercanas a 41° C producen un efecto antitumoral directo al generar una inhibición del metabolismo oxidativo disminuyendo el pH en el microambiente tumoral y aumentando la actividad lisosomal. A su vez, varios estudios han demostrado que las altas temperaturas potencian el efecto citotóxico de las drogas quimioterapéuticas al aumentar la permeabilidad de la células asociado con una inhibición de los mecanismos de reparación.11
En resumen, los beneficios de la HIPEC
se basan en las mayores concentraciones de drogas quimioterapéuticas en la
cavidad abdominal con menor toxicidad sistémica y un efecto citotóxico
incrementado por la hipertermia con una distribución homogénea en el sitio de
acción.14
Es de vital importancia conocer las drogas quimioterapéuticas que se utilizan, ya que, si bien la toxicidad sistémica es baja, se pueden producir ciertos efectos adversos tanto en la cirugía como en el posoperatorio. Algunos ejemplos son los desequilibrios electrolíticos y la hiperglucemia generada por el oxaliplatino, porque es necesario aplicar esta droga disuelta en una solución hipotónica (dextrosa al 5%) para que presente mayor toxicidad en las células tumorales.
Monitoreo hemodinámico
La combinación de cirugía de
citorreducción e HIPEC es un procedimiento complejo que genera un desafío para
el equipo de anestesia y terapia intensiva, ya que no solo se trata del manejo
de una cirugía abdominal mayor, sino que también hay que considerar los cambios
producidos por la HIPEC en la hemodinamia del paciente.15
Es fundamental evaluar la función cardíaca antes de la intervención, porque las drogas quimioterapéuticas asociadas a la hipertermia no solo incrementan la demanda de oxígeno cardíaco, sino que también generan un estado de vasodilatación e hiperdinamia que, en pacientes con antecedentes cardiovasculares o una función ventricular izquierda disminuida, puede generar colapso y descompensación hemodinámica durante la cirugía. Esquivel et al midieron el gasto cardíaco por ecodoppler esofágico y demostraron los cambios hemodinámicos producidos en la fase de HIPEC con la técnica de abdomen en “coliseo”.16 Dichos cambios consisten en un estado circulatorio hiperdinámico con aumento del índice cardíaco a expensas de una mayor frecuencia cardíaca, asociado al descenso de resistencias vasculares sistémicas. Estos cambios se relacionaban con el aumento de la temperatura corporal y eran más importantes a los 70-80 min de comenzar la fase de HIPEC. Entre otros autores, Schulermann et al,12-17 midiendo la presión intrabdominal, el gasto cardíaco y el índice de resistencias vasculares sistémicas, han demostrado cambios similares en la hemodinamia de los pacientes sometidos a la técnica de HIPEC cerrada. Este estado hiperdinámico en la fase de la quimioterapia se debe a la hipertermia sistémica alcanzada (media 37,7° C, puede llegar a 40,5° C). En consecuencia, aumenta la demanda de oxígeno y se produce una elevación del índice cardíaco, de los valores de CO2 espirada y acidosis metabólica con hiperlactacidemia hacia el fin de la fase hipertérmica, lo que convierte en fundamental la acción del anestesiólogo para restaurar la normotermia mediante soluciones frías.
Otro aspecto importante del manejo
perioperatorio de estos pacientes es la reanimación con fluidos, porque es
frecuente que se pierda más líquido que en otras cirugías abdominales, puede
alcanzar hasta 4 litros por día. Esto se debe no solo a la mayor pérdida que
ocurre en los pacientes con ascitis, sino también al estado hipermetabólico
producido por la infusión de soluciones a altas temperaturas en el abdomen,
asociado a la gran cantidad de drenajes en el lecho quirúrgico. Es por esto que
se suele superar ampliamente la reposición de fluidos de 6-8 ml/kg/h por la
pérdida de líquidos estipulados para las cirugías abdominales, y puede llegar
hasta 12 ml/kg/h, según el grado de citorreducción realizado.18
A su vez, durante la fase de la HIPEC, el aumento de la presión intrabdominal, sobre todo en la técnica cerrada, genera una disminución del retorno venoso con un aumento de la resistencia del lecho esplácnico, jugando un rol fundamental en la hemodinamia de estos pacientes. Asimismo, el trauma térmico ocasionado por las drogas quimioterapéuticas a altas temperaturas altera la permeabilidad vascular favoreciendo el filtrado capilar. Teniendo en cuenta esto, la administración amplia de fluidos expone al paciente al riesgo de sobrecarga hídrica, edema tisular y complicaciones abdominales por edema intestinal con compromiso de las anastomosis. Sin embargo, se ha demostrado que una terapia restrictiva de fluidos no disminuye la tasa de complicaciones, puede aumentar la incidencia de insuficiencia renal en el posoperatorio.17 Por este motivo, es necesario implementar una apropiada reposición de fluidos que permita una adecuada perfusión tisular y una reducción del riesgo de insuficiencia renal posoperatoria secundaria a las drogas quimioterapéuticas e hipertensión abdominal.
El monitoreo hemodinámico funcional (dispositivos de análisis de la onda de pulso, técnicas de termodilución transpulmonar, etc.) permite realizar esta reanimación guiada por objetivos, obteniendo información adicional acerca de la hemodinamia. Las variables dinámicas obtenidas de estos métodos (variación del volumen sistólico, variación de la presión de pulso) son las más utilizadas en diferentes estudios para evaluar la respuesta de estos pacientes a los fluidos.15,17,18 Junto con estos métodos de monitoreo, el uso de algún sistema que emplee la técnica de termodilución transpulmonar para medir el gasto cardíaco, permite brindar información sobre el agua extravascular pulmonar y el índice de permeabilidad vascular pulmonar, para alertar sobre la presencia de edema pulmonar de origen no cardiogénico asociado al filtrado capilar generado por el trauma térmico, sobre todo en pacientes con hipoalbuminemia marcada.18,19
La reposición de fluidos tanto en la
cirugía como en la unidad de terapia intensiva durante el posoperatorio debe
ser tanto con cristaloides como coloides,20 ya
que el drenaje de ascitis asociado a la extensa cirugía de citorreducción suele
estar asociado a grandes pérdidas de proteínas. Se estima que la pérdida
proteica diaria es de 700 g, por lo que es frecuente la reposición con albúmina
o plasma fresco congelado. La gran mayoría de los autores prefiere la
reposición con albúmina cuando los niveles plasmáticos son <15 mg/dl,
restringiendo la transfusión de plasma fresco y congelado a aquellos con
manifestaciones hemorrágicas.18-21 A su vez, la hipoalbuminemia en el perioperatorio
de cirugías programadas de causa oncológica es un factor independiente de
complicaciones a los 30 días, por lo que ciertos autores sugieren la reposición
de albúmina asociada a la reanimación con cristaloides.22
Por lo tanto, la reanimación con fluidos
guiada por sistemas de monitoreo hemodinámico funcional parece estar asociada a
mejores resultados posoperatorios.23
Termorregulación
El mantenimiento de la normotermia durante todo el procedimiento quirúrgico debe ser otra meta para mejorar los resultados posoperatorios. En la fase de cirugía de citorreducción, debido a la extensa resección efectuada y a la superficie expuesta, se debe controlar la temperatura mediante medios físicos o infusiones calientes, ya que la hipotermia favorece la coagulopatía por alteración de la función plaquetaria y aumenta la incidencia de infecciones de la herida quirúrgica por vasoconstricción periférica con reducción de la oferta de oxígeno tisular.
Por el contrario, durante la segunda
fase de la cirugía, la HIPEC, la temperatura en el espacio intrabdominal se
eleva hasta 41-43° C con el riesgo de hipertermia sistémica. La elevación de la
temperatura corporal no solo aumenta la tasa metabólica con un incremento de la
demanda de oxígeno y los cambios en la hemodinamia ya mencionada, sino que
también ciertos estudios demuestran el desarrollo de edema pulmonar de origen
no cardiogénico y mayor tendencia a la lesión asociada a la ventilación
mecánica en estas circunstancias.22
Por lo tanto, durante todo el acto quirúrgico, es fundamental implementar medidas para evitar la hipotermia y la hipertermia, y disminuir la tasa de complicaciones asociada a dichos cambios de temperatura.
Monitoreo respiratorio
El llenado de la cavidad abdominal con
solución salina y solución quimioterapéutica hipertérmica genera un aumento en
la presión intrabdominal con protrusión del diafragma hacia cefálico, lo que
ocasiona una reducción del volumen pulmonar con disminución de la capacidad
residual funcional, de la distensibilidad pulmonar y aumento en la resistencia
de la vía aérea, esto da como resultado un desequilibrio ventilación-perfusión.
Estos efectos son análogos a los que se producen en los pacientes con
neumoperitoneo en las cirugías laparoscópicas. Estos cambios en la mecánica
respiratoria generan un descenso en los parámetros de oxigenación (el que se
usa con más frecuencia es la PAFI) asociado a un aumento de la presión pico de
la vía aérea comparativamente significativo con respecto a la fase de
citorreducción. Paralelamente, durante la fase de HIPEC, en la capnometría, se
observa un aumento de la medición del volumen de CO2 al final de la
espiración producto del aumento del metabolismo ocasionado por el incremento de
la temperatura corporal.24
En el posoperatorio de la cirugía de citorreducción-HIPEC, las complicaciones respiratorias son una de las causas más importante de morbimortalidad. Es frecuente que, durante el acto quirúrgico, se resequen implantes peritoneales ubicados en el hemidiafragma derecho e izquierdo. La manipulación del diafragma genera una lesión mecánica que, asociada a las lesiones química y térmica que se producen durante la infusión del agente quimioterapéutico, favorece el acceso de líquido abdominal hacia la cavidad pleural durante esta fase. Por lo tanto, la incidencia de derrame pleural en estas cirugías es elevada, llega al 30%, según ciertos autores.24,25 Por este motivo y como rutina, a los pacientes sometidos a cirugía de citorreducción con resección de implantes peritoneales del diafragma y posterior HIPEC se les coloca un tubo de avenamiento pleural durante el acto quirúrgico.
Otro factor de riesgo para el desarrollo de complicaciones respiratorias es la necesidad de infundir gran cantidad de fluidos como parte de la reanimación requerida para mantener las demandas hemodinámicas del procedimiento. El exceso de fluidos asociado a la disfunción diafragmática y la disminución en la capacidad vital pulmonar que se genera en el posoperatorio de las cirugías abdominales favorece las atelectasias, la retención de secreciones y la hipoxemia con la posterior falla respiratoria. La reintubación por falla respiratoria en el posoperatorio de cirugías abdominales está asociada a mayor mortalidad y estancia más prolongada en la unidad de cuidados intensivos y hospitalaria con aumento de las complicaciones asociadas a la ventilación mecánica. Según ciertos autores, la incidencia de dichas complicaciones es de alrededor del 15%, e incluyen neumonía, requerimiento de ventilación prolongada (>48 h) y derrame pleural persistente.26 En diversos ensayos clínicos, se ha demostrado que el uso de presión positiva continua en la vía aérea (CPAP) durante el posoperatorio inmediato de grandes cirugías abdominales disminuye las complicaciones respiratorias al evitar el colapso de la vía aérea y alveolar.26 La CPAP o presión de soporte mediante la ventilación mecánica no invasiva disminuye el trabajo respiratorio, aumentando la capacidad residual funcional, mejorando la ventilación alveolar, incrementando el intercambio gaseoso, previniendo la debilidad diafragmática y aumentando el gasto cardíaco al disminuir la poscarga del ventrículo izquierdo. El estudio de Arakelian et al10 apoya el uso de CPAP luego de la extubación de una cirugía de citorreducción más HIPEC, ya que el uso de l ventilación no invasiva estuvo relacionado con una mejoría en la recuperación posoperatoria al reclutar zonas de atelectasia basales y abrir zonas colapsadas durante la cirugía y durante el aumento de la presión intrabdominal por la HIPEC.
Analgesia
Desde fines de la década de 1990, el manejo perioperatorio de los pacientes de cirugía programada, sobre todo abdominal, está en proceso de cambio. Esto se debe a la implementación del protocolo ERAS (Enhance Recovery After Surgery) desarrollado por Ljungqvist et al,27 que consiste en un programa de rehabilitación multimodal cuyos objetivos son atenuar la pérdida de la capacidad funcional y mejorar la recuperación temprana en el período perioperatorio. Este protocolo incluye una combinación de estrategias tanto pre, intra y posoperatorias basadas en la evidencia científica que mejoran la recuperación y la funcionalidad de los pacientes luego de la cirugía, reduciendo, al mínimo, la respuesta al estrés producido por esta, favoreciendo la movilización y la alimentación tempranas logrando una disminución de la estancia hospitalaria y de los costos en salud.
Uno de los principios en que se basa
dicho protocolo es el adecuado manejo analgésico de todo paciente sometido a
una cirugía mayor, mediante un catéter peridural con infusión de opioides y
anestésicos. Se ha demostrado que la analgesia, en esta región, atenúa la
respuesta de estrés posoperatorio, favoreciendo la extubación temprana y
mejorando la capacidad respiratoria al evitar la restricción durante la
respiración por dolor con menor desarrollo de atelectasias. A su vez, favorece
el retorno de la función intestinal al bloquear la actividad simpática y,
sumado a la disminución de infusión de opioides intravenosos, reduce el íleo
posoperatorio favoreciendo el inicio de alimentación enteral. Junto con un
catéter peridural para el manejo analgésico, es importante implementar un
programa de rehabilitación kinésica precoz que consista en la movilización
fuera de la cama con ejercicios respiratorios con un espirómetro incentivo, sobre
todo en aquellos pacientes que han tenido una resección diafragmática. Estas
dos intervenciones favorecen la recuperación posoperatoria y reducen la
estancia en la unidad de terapia intensiva.28
Si bien la trombocitopenia y las alteraciones en la coagulación secundarias a los efectos sistémicos de la HIPEC son bastante frecuentes en estos pacientes, estudios prospectivos recientes demuestran que el uso del catéter peridural para el manejo de la analgesia es una opción segura. Teniendo en cuenta que la principal causa de hematoma espinal se produce durante la inserción del catéter en un procedimiento traumático, una correcta anamnesis sobre antecedentes de sangrado antes de la cirugía y la colocación por parte de personal experimentado antes de comenzar la cirugía es esencial para prevenir el hematoma espinal.
Nutrición
Los pacientes que sufren enfermedades oncológicas son particularmente proclives a la desnutrición, debido a los efectos combinados de la enfermedad de base y el tratamiento quimioterapéutico. La cirugía de citorreducción seguida de HIPEC es un procedimiento mayor que puede acentuar el riesgo de depleción nutricional en pacientes con CP. Hay suficiente evidencia científica que documenta la asociación entre la mala nutrición y la prolongación de la estancia hospitalaria, el aumento de las complicaciones posoperatorias, el incremento de los costos hospitalarios, peor calidad de vida y supervivencia.29 Si bien no hay datos disponibles sobre la prevalencia de desnutrición en pacientes con CP, el 67% y el 80% de los pacientes con cáncer de ovario y de colón avanzado, respectivamente, (dos de los tumores que más se asocian con CP) tienen algún grado de desnutrición.29
Por lo tanto, es fundamental realizar una pesquisa nutricional en los pacientes candidatos a la cirugía de citorreducción e HIPEC para una correcta intervención tanto antes de la cirugía como después de ella. La valoración global subjetiva (VGS) es una escala que está validada en diferentes poblaciones, entre las que se encuentran los pacientes oncológicos y, a su vez, se correlaciona con la morbilidad y la mortalidad. Dicha valoración se basa en un cuestionario que combina datos subjetivos y objetivos acerca de los antecedentes médicos (cambios recientes en el peso, cambios en la ingesta, presencia de síntomas gastrointestinales y cambios en la capacidad funcional) asociada a un examen físico (pérdida de grasa subcutánea, masa muscular, edema sacro y ascitis). Luego de la evaluación, se clasifica a los pacientes en diferentes estados nutricionales: bien nutrido (VGS A), desnutrición moderada (VGS B) y desnutrición severa (VGS C). Una vez que se ha clasificado al paciente, se debe comenzar con la alimentación según corresponda, ya que existe una asociación entre el estado nutricional antes de la cirugía de citorreducción e HIPEC y la estancia hospitalaria, los pacientes severamente desnutridos (VSG C) tienen una estancia significativamente más prolongada.
De acuerdo con las guías ESPEN,30 la mejor vía de elección para la nutrición es la
enteral, porque permite mantener la integridad del tubo digestivo y evitar la
translocación bacteriana. El comienzo temprano de la nutrición enteral es uno
de los componentes del ya mencionado protocolo ERAS27
y se ha demostrado que es seguro, acorta la estancia hospitalaria y reduce los
costos en los pacientes sometidos a cirugía abdominal, incluso en aquellos con
peritonectomías e HIPEC. Sin embargo, muchas veces, la nutrición enteral
temprana no se puede instaurar debido a íleo posoperatorio, sepsis,
complicaciones intrabdominales, como fístulas, obstrucción o dehiscencia de las
anastomosis. En estos casos, como esta población suele tener riesgo de
desnutrición o desnutrición marcada, se debe considerar la alimentación
parenteral suplementaria, tomando las precauciones necesarias para prevenir el
síndrome de realimentación.31
Conclusiones
La cirugía de citorreducción asociada a la HIPEC es una técnica desarrollada para el tratamiento de la CP secundaria a cáncer de origen gastrointestinal, ginecológico, apendicular y a mesotelioma maligno, con buenos resultados en la supervivencia de los pacientes. Se lo considera un procedimiento de alto riesgo quirúrgico que no está exento de complicaciones mayores perioperatorias, debido a que plantea no solo las dificultades de una cirugía mayor abdominal, sino también las modificaciones producidas por la HIPEC. Por lo tanto, es fundamental que dicha estrategia terapéutica se realice en un centro médico de alta complejidad que cuente con un equipo multidisciplinario (oncólogos, cirujanos, anestesiólogos, médicos intensivistas y kinesiólogos) experto en el manejo de estos pacientes para lograr resultados prometedores.
Bibliografía
1.
Coccolini
F, Gheza F, Lotti M, et al. Peritoneal carcinomatosis. World J Gastroenterol
2013; 19(41): 6979-6994. https://doi.org/10.3748/wjg.v19.i41.6979
2.
Sugarbaker
PH. Peritonectomy procedures. Ann Surg 1995; 221(1): 29-42. https://doi.org/10.1097/00000658-199501000-00004
3.
Elias D,
Gilly F, Boutitie F, et al. Peritoneal colorectal carcinomatosis treated with
surgery and perioperative intraperitoneal chemotherapy: retrospective analysis
of 523 patients from a multicentric french study. J Clin Oncol 2010; 28(1):
63-68. https://doi.org/10.1200/JCO.2009.23.9285
4.
Yan T,
Black D, Savady R, Sugarbaker P. Systematic review on the efficacy of
cytoreductive surgery combined with perioperative intraperitoneal chemotherapy
for peritoneal carcinomatosis from colorectal carcinoma. J Clin Oncol 2006; 24:
4011-4019. https://doi.org/10.1200/JCO.2006.07.1142
5.
Sugarbaker
P. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in the
management of gastrointestinal cancers with peritoneal metastases: Progress
toward a new standard of care. Cancer Treat Rev 2016; 48: 42-49. https://doi.org/10.1016/j.ctrv.2016.06.007
6.
Wright A,
Cronin A, Milne D, et al. Use and effectiveness of intraperitoneal chemotherapy
for treatment of ovarian cancer. J Clin Oncol 2015; 33(26): 2841-2847. https://doi.org/10.1200/JCO.2015.61.4776
7.
Yan T,
Black D, Savady R, Sugarbaker P. A systematic review on the efficacy of
cytoreductive surgery and perioperative intraperitoneal chemotherapy for
pseudomyxoma peritonei. Ann Surg Oncol 2007; 14(2): 484-492. https://doi.org/10.1245/s10434-006-9182-x
8.
Yan T,
Welch L, Black D, Sugarbaker P. A systematic review on the efficacy of
cytoreductive surgery combined with perioperative intraperitoneal chemotherapy
for diffuse malignancy peritoneal mesothelioma. Ann Oncol 2007; 18: 827-834. https://doi.org/10.1093/annonc/mdl428
9.
Königsrainer I, Beckert S. Cytoreductive surgery and
hyperthermic intraperitoneal chemotherapy: where are we? World J Gastroenterol
2012; 18(38): 5317-5320. https://doi.org/10.3748/wjg.v18.i38.5317
10.
Arakelian
E, Gunningberg L, Larsson J, Norlén K,
Mahteme H. Factors influencing early postoperative recovery after cytoreductive
surgery and hyperthermic intraperitoneal chemotherapy. Eur J Surg Oncol 2011;
37(10): 897-903. https://doi.org/10.1016/j.ejso.2011.06.003
11.
Bree E.
Optimal drugs for HIPEC in different tumors. J BUON 2015; 20(Suppl 1): S40-S46.
PMID: 26051331
12.
Schulermann
C, Hoeppner J, Benk C, Schmidt R, Loop T, Kalbhenn J. Intra-abdominal pressure,
cardiac index and vascular resistance during hyperthermic intraperitoneal
chemotherapy: a prospective observational study. Minerva Anestesiologica 2016;
82(2): 160-169. PMID: 25971283
13.
Lemoine
L, Sugarbaker P, Van der Speeten K. Drugs, doses, and durations of
intraperitoneal chemotherapy: standardizing HIPEC and EPIC for colorectal,
appendiceal, gastric, ovarian peritoneal surface malignancies and peritoneal
mesothelioma. Int J Hyperthermia 2017; 33(5): 1-34. https://doi.org/10.1080/02656736.2017.1291999
14.
Brücher B, Piso P, Verwaal V, et al. Peritoneal
carcinomatosis: cytoreductive surgery and HIPEC - Overview and basics. Cancer
Invest 2012; 30: 209-224. https://doi.org/10.3109/07357907.2012.654871
15.
Rothfield
KP, Crowley K. Anesthesia considerations during cytoreductive surgery and
hyperthermic intraperitoneal chemotherapy. Surg Oncol Clin North Am 2012;
21(4): 533-541. https://doi.org/10.1016/j.soc.2012.07.003
16.
Esquivel
J, Angulo F, Bland R, Stephens A, Sugarbaker P. Hemodynamic and cardiac
function parameters during heated intraoperative intraperitoneal chemotherapy
using the open “Coliseum technique”. Ann
Surg Oncol 2000; 7(4): 296-300. https://doi.org/10.1007/s10434-000-0296-2
17.
Colantonio
L, Claroni C, Fabrizi L, et al. A
randomized trial of goal directed vs standard fluid therapy in cytoreductive
surgery with hyperthermic intraperitoneal chemotherapy. J Gastrointest Surg
2015; 19: 722-729. https://doi.org/10.1007/s11605-015-2743-1
18.
Raspé C, Pisob P, Wiesenackc C, et al. Anesthetic
management in patients undergoing hyperthermic chemotherapy. Curr Opin
Anesthesiol 2012; 25: 348-355. https://doi.org/10.1097/ACO.0b013e32835347b2
19.
Redondo
F, Padilla D, Villarejo P, et al. The
global end-diastolic volume (GEDV) could be more appropriate to fluid
management than central venous pressure (CVP) during closed hyperthermic
intra-abdominal chemotherapy with CO2 circulation. J Invest Surg 2018; 31(4):
321-327. https://doi.org/10.1080/08941939.2017.1325543
20.
Chappell
D, Jacob M, Hofmann-Kiefer K, et al. A rational approach to perioperative fluid
management. Anesthesiology 2008; 109: 723-740. https://doi.org/10.1097/ALN.0b013e3181863117
21.
Padmakumar
A. Intensive care management of patient after cytoreductive surgery and HIPEC -
A concise review. Indian J Surg Oncol 2016; 7(2): 244-248. https://doi.org/10.1007/s13193-016-0511-7
22.
Raspé C, Flother L, Schneider R, Bucher M, Piso P. Best
practice for perioperative management of patients with cytoreductive surgery
and HIPEC. Eur
J Surg Oncol 2017; (43): 1013- 1027. https://doi.org/10.1016/j.ejso.2016.09.008
23.
Bezu
L, Raineau M, Deloménie M, et al. Haemodynamic management during hyperthermic
intraperitoneal chemotherapy: A systematic review. Anaesth Crit Care Pain Med
2020; 39(4): 531-542. https://doi.org/10.1016/j.accpm.2020.03.019
24.
Pret VI,
Chang D, Sugarbaker P. Pulmonary complications following cytoreductive surgery
and perioperative chemotherapy in 147 consecutive patients. Gastroenterol
Res Pract 2012; 2012:635314. https://doi.org/10.1155/2012/635314
25.
Jafari
MD, Halabi WJ, Stamos MJ, et al. Surgical
outcomes of hyperthermic intraperitoneal chemotherapy: analysis of the American
College of Surgeons National Surgical Quality Improvement Program. JAMA Surg
2014; 149(2): 170-175. https://doi.org/10.1001/jamasurg.2013.3640
26.
Ferreyra
G, Baussano I, Squadrone V, et al. Continuous positive airway pressure for
treatment of respiratory complications after abdominal surgery: a systematic
review and meta-analysis. Ann Surg 2008; 247: 617-626. https://doi.org/10.1097/SLA.0b013e3181675829
27.
Ljungqvist
O, Scott M, Fearon K. Enhanced recovery after surgery. A review.
JAMA Surg 2017; 152(3): 292-298. https://doi.org/10.1001/jamasurg.2016.4952
28.
Osseis
M, Weyrech J, Gayat E, et al. Epidural
analgesia combined with a comprehensive physiotherapy program after
cytoreductive surgery and HIPEC is associated with enhanced post-operative
recovery and reduces intensive care unit stay: A retrospective study of 124
patients. Eur J Surg Oncol 2016; (42): 1938-1942. https://doi.org/10.1016/j.ejso.2016.06.390
29.
Vashi P,
Gupta D, Lammersfeld C, et al. The relationship between baseline nutritional
status with subsequent parenteral nutrition and clinical outcomes in cancer
patients undergoing hyperthermic intraperitoneal chemotherapy. Nutr J 2013; 12:
118. https://doi.org/10.1186/1475-2891-12-118
30.
Singer P,
Blaser A, Berger M, et al. ESPEN guideline on clinical nutrition in the
intensive care unit. Clin
Nutr 2019; 38(1): 48-79. https://doi.org/10.1016/j.clnu.2018.08.037
31.
Glehen
O, Cotte E, Kusumara S, et al. Hyperthermic
intraperitoneal chemotherapy: nomenclature and modalities of perfusion. J Surg
Oncol 2008; 98: 242-246. https://doi.org/10.1002/jso.21061