Infección por influenza A y aspergilosis pulmonar invasiva en el paciente inmunocompetente
[Influenza A infection and invasive pulmonary aspergillosis in an
immunocompetent patient]
Marina S. Cherchi, Marisol Holanda, Daisy Eliana Andia, Elsa Ots, Tomás Obeso
Hospital Universitario Marqués de Valdecilla, Santander, España
* Correspondencia: marina.cherchi@scsalud.es
Los
autores no declaran conflictos de intereses.
Resumen
En la actualidad, se conocen más de 250 especies del género Aspergillus, las que tienen mayor potencial de infección invasiva son A. fumigatus, A. flavus, A. terreus y A. niger. Tradicionalmente se han considerado factores de riesgo de infección micótica invasiva aquellos cuadros que suponen un estado de inmunosupresión en el huésped. Sin embargo, los casos de infección micótica invasiva se describen en el paciente inmunocompetente cada vez con más frecuencia. Teniendo esto en cuenta, se han descrito factores que aumentan el riesgo de infección y de muerte en el huésped inmunocompetente, como la diabetes o la infección vírica concomitante. Dado que los métodos de diagnóstico rápido pueden arrojar resultados falsos negativos, la sospecha clínica y los estudios por imágenes pueden ser suficientes para iniciar una terapia antimicótica precoz en estos pacientes. Presentamos a un paciente internado en la Unidad de Cuidados Intensivos por infección grave por influenza A (H1N1 variante 2009) y aspergilosis pulmonar invasiva concomitante, que padecía diabetes como única comorbilidad.
Palabras clave: Aspergilosis pulmonar invasiva; virus influenza; paciente inmunocompetente.
Abstract
At present, there are more than 250 species of Aspergillus
and A. fumigatus, A. flavus, A. terreus and A. niger
are the species with more risk of invasive infection. Traditionally, several
conditions related to immunocompromised hosts have been considered risk factors
of fungal invasive infection. However, invasive fungal infections are
increasingly detected in immunocompetent patients. Factors increasing the risk
of viral infection and death, such as diabetes and concomitant viral infection,
have been described. As diagnostic tests may have false negative results,
clinical and radiological findings could be enough to start antifungal therapy.
We present a patient admitted to the Intensive Care Unit with severe Influenza
A infection (H1N1 2009 variant) and concomitant invasive pulmonary
aspergillosis.
Key words: Invasive pulmonary aspergillosis;
influenza A; immunocompetent host.
Introducción
El género Aspergillus fue reconocido, por primera vez, en 1729, por Micheli, en Florencia.1 En la actualidad, gracias al avance de las técnicas de caracterización molecular, se conocen más de 250 especies de Aspergillus, y las de mayor potencial de infección invasiva son A. fumigatus, A. flavus, A. terreus y A. niger.1 Tradicionalmente se han considerado factores de riesgo de infección micótica invasiva todos aquellos cuadros que suponen un estado de inmunosupresión en el huésped, como neutropenia prolongada, trasplante, inmunodeficiencia congénita, tratamiento inmunosupresor o con corticoides, tumores hematológicos y enfermedad injerto contra huésped.2,3 Sin embargo, cada vez con más frecuencia, se describen casos de infección micótica invasiva en pacientes inmunocompetentes.4-8 Presentamos el caso de un paciente con diabetes como única comorbilidad, que ingresa en la Unidad de Cuidados Intensivos, a causa de una infección grave por influenza A (H1N1 variante 2009) y aspergilosis pulmonar invasiva (API) concomitante.
Caso clínico
Varón de 53 años, con diabetes tipo 2 en tratamiento con insulina y mal controlada (HbA1c 11%). Acudió al Departamento de Urgencia por un cuadro catarral de cuatro días de evolución. A su llegada tenía insuficiencia respiratoria e hipotensión, la radiografía no mostraba infiltrados parenquimatosos (Figura 1). La reacción en cadena de la polimerasa fue positiva para el virus influenza A (subtipo H1N1 variante 2009), por lo que se inició el tratamiento con oseltamivir junto con ceftriaxona y levofloxacina. El antígeno urinario para Streptococcus pneumoniae y Legionella pneumophila tipo 1 fue negativo. Tras 24 h, el estado clínico empeoró y se decidió el ingreso en la Unidad de Cuidados Intensivos. Los análisis de laboratorio revelaron leucocitosis y marcadores inflamatorios elevados. A pesar del soporte respiratorio con oxigenoterapia de alto flujo, el paciente no mejoró y requirió intubación orotraqueal y ventilación mecánica invasiva. En la radiografía posintubación, apareció una condensación incipiente en el lóbulo inferior izquierdo, por lo que se sustituyó ceftriaxona por meropenem. Las siguientes 48 h estuvieron marcadas por un empeoramiento progresivo: insuficiencia respiratoria a pesar de la ventilación protectora, shock con pobre respuesta a fármacos vasoactivos e inotrópicos, coagulopatía e insuficiencia renal aguda, con anuria. Se inició hemodiafiltración venovenosa continua. A las 72 h del ingreso en la Unidad de Cuidados Intensivos, continuó la progresión clínico-radiológica con evidencia de infiltrados bilaterales algodonosos (Figura 1) y aumento de la necesidad de FiO2.
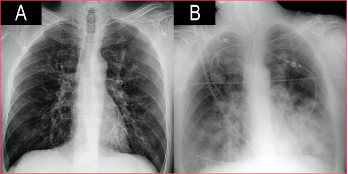
Figura
1. Evolución radiográfica en las primeras 72 horas.
Se amplió la cobertura antimicrobiana añadiendo vancomicina y voriconazol, y se obtuvieron nuevas muestras microbiológicas. La reacción en cadena de la polimerasa del hisopado nasofaríngeo fue positiva para influenza A H1N1 y el resultado de la detección antigénica de galactomanano fue negativo (índice 0,059. Punto de corte ≤0,5). Debido a la inestabilidad hemodinámica, no se pudo realizar una tomografía computarizada (TC) de tórax como parte del estudio etiológico y el paciente falleció ese mismo día, a pesar de las medidas instauradas, por hipotensión sin respuesta y bradicardia extrema. Tras el óbito se aisló Aspergillus fumigatus y Aspergillus niger en el aspirado traqueal. El resto de las pruebas solicitadas (serologías de neumonía atípica, cultivo de aspirado traqueal, urocultivo, hemocultivo, serología de hepatitis víricas y detección de anticuerpos anti-VIH 1 y 2) resultaron negativas.
El estudio anatomopatológico mostró una bronconeumonía necrotizante con micetomas e hifas de hongos tipo Aspergillus, con compromiso traqueal, diseminación intestinal y renal (nefritis y enteritis hemorrágica con presencia de hifas tipo Aspergillus), tromboembolismo pulmonar de vasos de mediano y pequeño calibre con hemorragia y edema agudo pulmonar bilateral (Figura 2). El diagnóstico final fue API.
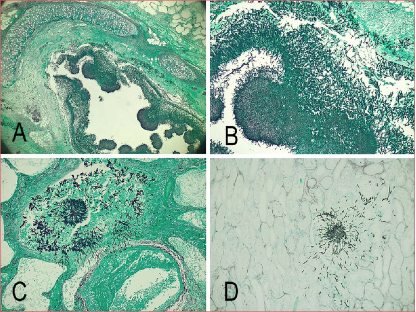
Figura 2. A. Tinción de Giemsa x2,5. Micetoma bronquial tipo Aspergillus. B. Tinción de Giemsa x10. Micetoma bronquial tipo Aspergillus. C. Tinción de Giemsa x10. Pulmón. Hifas tipo Aspergillus con invasión vascular y trombosis. D. Tinción de Giemsa x10. Riñón. Hifas tipo Aspergillus.
Discusión
Según diferentes guías clínicas, uno de los criterios clave para el diagnóstico de API es la inmunosupresión del huésped. De esta forma, se podrá diagnosticar API probable en un paciente con: 1) hallazgos compatibles con infección micótica en la TC, 2) una prueba positiva directa o indirecta para Aspergillus y 3) algún estado de inmunosupresión.2,3 Sin embargo, dado el incremento de casos de infección micótica invasiva en pacientes inmunocompetentes, el proyecto AspICU publicó, en 2012, un algoritmo diagnóstico modificado donde se incluía a este grupo dentro de los criterios de API.9,10 Al igual que en el caso que presentamos, un paciente que cumpla los cuatro criterios del algoritmo podrá ser diagnosticado de supuesta API (los autores reemplazan el término “probable” por el de “supuesta”): 1) aislamiento de Aspergillus en una muestra del tracto respiratorio inferior, 2) signos y síntomas compatibles, 3) hallazgos en estudios por imágenes (radiografía portátil o TC), 4) factores de riesgo en el huésped o estudio semicuantitativo positivo en lavado broncoalveolar o cultivo.
Es importante destacar que, dentro de las alteraciones en los estudios por imágenes, se aceptan no solo los hallazgos típicos en la TC (signo del halo o nódulos pulmonares múltiples rodeados de áreas de vidrio deslustrado),11 sino también las alteraciones visibles en la radiografía portátil. Con esto se pretende incluir dentro del algoritmo a pacientes inestables que no puedan ser trasladados a la sala de radiodiagnóstico, como ocurrió en nuestro caso, donde la rápida progresión radiológica paralela a la mala evolución clínica fueron criterios suficientes para iniciar la terapia antimicótica sin necesidad de una TC.
Existe cierta controversia respecto al
rendimiento de los métodos de detección indirecta. El galactomanano es un
polisacárido de la pared celular que puede ser detectado en sangre periférica,
lavado broncoalveolar, orina, líquido cefalorraquídeo y líquido pleural.12 Su
mayor rendimiento se alcanza en pacientes con neutropenia, tumores
hematológicos o enfermedad injerto contra huésped. Sin embargo, debido a la
disparidad de los resultados, no se recomienda su detección como método de
pesquisa en pacientes que estén recibiendo terapia antimicótica o profilaxis,
que hayan recibido un trasplante de órgano sólido o que sufran enfermedad
granulomatosa crónica.2
A diferencia del paciente neutropénico, en el huésped inmunocompetente, la inmunidad innata evita que existan restos de la pared celular del hongo en el torrente sanguíneo, por lo que el galactomanano en suero tendrá un bajo rendimiento, que es máximo en el lavado broncoalveolar.12 También, es posible obtener un resultado falso negativo en casos de tratamiento antimicótico adecuado, porque reduce el crecimiento del hongo. Por el contrario, podría haber resultados falsos positivos debido a reacciones cruzadas con regiones de otros hongos o bacterias que alcancen el torrente sanguíneo a través de una mucosa intestinal alterada (p. ej., si hay mucositis secundaria a quimioterapia), reacción cruzada con betalactámicos o por la administración de Plasma-Lyte®. En este último caso, el gluconato de sodio de su composición es obtenido mediante fermentación y, en algunos casos, se involucran especies no patógenas de Aspergillus en el proceso de producción.4,10,13 Por tanto, la prueba de galactomanano debe interpretarse con precaución y un resultado negativo, como ocurrió en nuestro caso, no debe ser tomado como razón única para excluir el diagnóstico de API.
La inmunosupresión no engloba únicamente a los síndromes genéticos y las terapias inmunosupresoras. Algunos de los cuadros más frecuentes de la población general, como la diabetes o la enfermedad pulmonar obstructiva crónica, pueden alterar el normal funcionamiento del sistema inmune y llevar al individuo a un estado de inmunosupresión adquirida que lo haga susceptible a infecciones graves. El único antecedente de interés de nuestro paciente era la diabetes mellitus tipo 2, insulinodependiente y mal controlada. Tal y como se describe en la bibliografía, la diabetes provoca disfunción inmune a través de diversos mecanismos que incluyen autoinmunidad asociada con diabetes tipo 1, estado proinflamatorio crónico asociado con diabetes tipo 2, alteración del funcionamiento de la expresión de genes productores de citocinas e inhibición y alteración de la función de los factores del complemento.14,15 De esta forma, el paciente con diabetes tiene un mayor riesgo de sufrir una infección bacteriana y micótica (osteomielitis, sepsis, endocarditis y celulitis, más frecuentemente), y de hospitalización y muerte relacionada con la infección.14,15 En 2018, Carey et al, y Critchley et al14,15 estimaron que hasta el 6,3% de las hospitalizaciones y el 12% de las muertes asociadas a infección podrían atribuirse a la diabetes. Concretamente, en pacientes con diabetes tipo 2, los años de evolución de la enfermedad, el sexo masculino, la edad mayor de 70 años, la obesidad, el tabaquismo y residir en áreas menos desarrolladas fueron factores que incrementaron aún más el riesgo de infección.14,15
Por último y en referencia al caso que
describimos, algunos agentes infecciosos, como el virus influenza, se han
postulado como factores de riesgo independiente para el desarrollo de una
infección micótica invasiva, incluso en el paciente inmunocompetente.4-8,16,17 García-Vidal et al18 comprobaron cómo las épocas con mayor carga ambiental de virus (en
particular, influenza A, virus sincicial respiratorio
y adenovirus) reducían la cantidad de esporas necesarias para provocar API en
el huésped susceptible.18 Se desconocen los mecanismos por los que el
virus podría aumentar el riesgo de adquirir infecciones micóticas. Se ha
sostenido que la infección por influenza provoca un daño directo de la mucosa
traqueobronquial que lleva a una alteración del aclaramiento mucociliar.8,10,16,19 Además, a nivel del sistema inmune, altera la
fagocitosis por parte de los macrófagos alveolares, reduce la funcionalidad de
las células natural killer, provoca un estado de linfopenia mantenida y
un desequilibrio en la respuesta Th1/Th2 con reducción de la respuesta Th1
necesaria para la acción antivírica y antimicótica, y aumento de la respuesta
Th2. De esta forma, se induciría un desequilibrio en la producción de citocinas
necesarias para la eliminación del hongo. Los linfocitos Th1 dejarían de
producir las principales citocinas proinflamatorias protectoras frente a
infecciones micóticas (IFN-, IL-6 e IL-12), mientras que el aumento de
linfocitos Th2 incrementaría la secreción de citocinas IL-4, IL-5 e IL-10,
inductoras de una defensa del huésped alterada frente a una infección micótica
invasiva. La enfermedad injerto contra huésped, el tratamiento con corticoides
y la transfusión repetida de concentrados de hematíes inducen, además del virus
influenza, este desequilibrio Th1/Th2.8,16,17,19
Conclusiones
La API es una entidad con una tasa de mortalidad alta, tradicionalmente atribuida al huésped con algún tipo de inmunodepresión. Sin embargo, dicha infección puede detectarse en individuos considerados, hasta ahora, inmunocompetentes. Factores, como la diabetes o la infección por influenza, pueden aumentar el riesgo de infección por Aspergillus y la tasa de mortalidad. Los métodos de diagnóstico rápido, como la prueba de galactomanano en suero o en lavado broncoalveolar, pueden ser útiles, teniendo en cuenta el porcentaje de falsos negativos. Por tanto, hasta contar con los resultados de los métodos de diagnóstico directo, la sospecha clínica y los estudios por imágenes pueden ser suficientes para iniciar una terapia antimicótica precoz.
Bibliografía
1.
Patterson
TF. Género Aspergillus. En:
Bennett JE, Dolin R, Blaser MJ. Mandell, Douglas y Bennett. Enfermedades
infecciosas. Principios y práctica. 8ª ed. Barcelona: Elsevier; 2016: 3059-3073.
2.
Patterson
TF, Thompson GR, Denning DW, et al. Practice Guidelines for the Diagnosis and
Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of
America. Clin Infect Dis 2016; 63(4): e1-60. https://doi.org/10.1093/cid/ciw326
3.
Donnelly
JP, Chen SC, Kauffman CA, et al. Revision and Update of the Consensus
Definitions of Invasive Fungal Disease From the European Organization for
Research and Treatment of Cancer and the Mycoses Study Group Education and
Research Consortium. Clin Infect Dis 2020; 71(6): 1367-1376. https://doi.org/10.1093/cid/ciz1008
4.
Shah MM,
Hsiao EI, Kirsch CM, et al. Invasive pulmonary aspergillosis and influenza
co-infection in immunocompetent hosts: case reports and review of the
literature. Diagn Microbiol Infect Dis 2018; 91(2): 147-152. https://doi.org/10.1016/j.diagmicrobio.2018.01.014
5.
Saint-Léger P. Aspergillose pulmonaire invasive chez le
patient immunocompétent
grippé. Med Mal Infect 2019; 49(4): 291-292. https://doi.org/10.1016/j.medmal.2019.01.004
6.
Schauwvlieghe
AFAD, Rijnders BJA, Philip N, et al. Invasive aspergillosis in patients
admitted to the intensive care unit with severe influenza: a retrospective
cohort study. Lancet Respir Med 2018; 6(10): 782-792. https://doi.org/10.1016/S2213-2600(18)30274-1
7.
Martin-Loeches
I, Schultz MJ, Vincent JL, et al. Increased incidence of co-infection in
critically ill patients with influenza. Intensive Care Med 2017; 43(1): 48-58. https://doi.org/10.1007/s00134-016-4578-y
8.
Crum-Cianflone
NF. Invasive aspergillosis associated with severe influenza infections. Open
Forum Infect Dis 2016; 3(3): ofw171. https://doi.org/10.1093/ofid/ofw171
9.
Blot
SI, Taccone FS, Van den Abeele AM, et al. A clinical algorithm to diagnose invasive pulmonary aspergillosis in
critically ill patients. Am J Resp Crit Care Med 2012; 186(1): 56-64. https://doi.org/10.1164/rccm.201111-1978OC
10. Bassetti
M, Righi E, De Pascale G, et al. How to
manage aspergillosis in non-neutropenic intensive care unit patients. Crit Care
2014; 18(4): 458-470. https://doi.org/10.1186/s13054-014-0458-4
11. Tunnicliffe G, Schomberg L, Walsh S, et al. Airway and
parenchymal manifestations of pulmonary aspergillosis. Respir Med 2013; 107(8):
1113-1123. https://doi.org/10.1016/j.rmed.2013.03.016
12. Jenks JD, Salzer HJ, Hoenigl M. Improving the rates of
Aspergillus detection: an updated on current diagnostic strategies. Expert Rev
Anti Infect Ther 2019; 17(1): 39-50. https://doi.org/10.1080/14787210.2018.1558054
13. Hage CA,
Carmona EM, Epelbaum O, et al. Microbiological
laboratory testing in the diagnosis of fungal infections in pulmonary and
critical care practice. An Official American Thoracic Society Clinical Practice
Guideline. Am J Respir Crit Care Med 2019; 200(5): 535-550. https://doi.org/10.1164/rccm.201906-1185ST
14. Carey IM, Critchley JA, DeWilde S, et al. Risk of
infection in type 1 and type 2 diabetes compared with the general population: A
matched cohort study. Diabetes Care 2081; 41(3): 513-21. https://doi.org/10.2337/dc17-2131
15. Critchley JA, Carey IM, Harris T, et al. Glycemic
control and risk of infections among people with type 1 or type 2 diabetes in a
large care cohort study. Diabetes Care 2018; 41(10): 2127-2135. https://doi.org/10.2337/dc18-0287
16. García-Vidal C, Barba P, Arman M, et al. Invasive aspergillosis complicating pandemic Influenza
A (H1N1) infection in severely immunocompromised patients. Clin Infect Dis
2011; 53(6): e16. https://doi.org/10.1093/cid/cir485
17. Martin-Loeches I, Lemiale V, Geoghegan P, et al.
Influenza and associated co-infections in critically ill immunosuppressed
patients. Crit Care 2019;23(1): 152-162. https://doi.org/10.1186/s13054-019-2425-6
18. García-Vidal C, Royo-Cebrecos C, Peghin M, et al. Environmental variables associated with
an increased risk of invasive aspergillosis. Clin Microbiol Infect 2014;
20(11): O939-O45. https://doi.org/10.1111/1469-0691.12650
19. García-Vidal C, Viasus D, Carratalà J. Pathogenesis of invasive fungal
infections. Curr Opin Infect Dis 2013; 26(3): 270-276. https://doi.org/10.1097/QCO.0b013e32835fb920