ECMO venoarterial como soporte de la función cardiovascular en el estado post-quirúrgico del niño con corazón izquierdo hipoplásico
Silvio F. Torres,* Rafael A.
Fraire, Alejandro J. Siaba Serrate, Antonela I. Lugrin Bellomo, Josefina Castro
Méndez, Thomas Iolster
Unidad de Cuidados Intensivos
Pediátricos, Hospital Universitario Austral, Pilar, Provincia de Buenos Aires,
Argentina
* Correspondencia: silviot68@gmail.com
Los
autores no declaran conflictos de intereses.
Resumen
El síndrome de corazón izquierdo hipoplásico se define como un defecto congénito grave caracterizado por el subdesarrollo del corazón izquierdo. El síndrome de bajo gasto que no responde al soporte vasoactivo durante el posoperatorio puede requerir oxigenación por membrana extracorpórea (ECMO).
Presentamos a una niña con síndrome de corazón izquierdo hipoplásico que fue tratada con ECMO después de una cirugía de Norwood por síndrome de bajo gasto cardíaco resistente al soporte vasoactivo. Se mantuvo durante 4 días y se logró la recuperación del ventrículo sistémico. Fue extubada a los 22 días de la cirugía y, dos semanas más tarde, dejó la unidad de cuidados intensivos pediátricos.
Conclusión: El momento de la indicación y la duración de la ECMO resultaron esenciales para una óptima evolución.
Palabras clave: Hipoplasia; ventrículo izquierdo; ECMO; neoaorta.
Abstract
Hypoplastic left heart syndrome
(HICHS) is defined as a serious birth defect characterized by underdevelopment
of the left heart. Low cardiac output syndrome that is refractory to vasoactive
drugs during the postoperative period can be an indication of venoarterial
extracorporeal membrane oxygenation (ECMO).
We present a child with hypoplastic
left heart syndrome who was treated with ECMO after a Norwood surgery performed
due to a refractory inotropic support. She remained on ECMO during 4 days
allowing the systemic ventricle to recover. She was extubated on the 22nd
postoperative day and discharged from the PICU 2 weeks later.
Conclusion:
Timing and
duration of ECMO were the key point for a successful outcome.
Key words: Hypoplastic left heart; ECMO; neoaorta.
Introducción
El síndrome del corazón izquierdo hipoplásico (SCIH) se define como un defecto congénito grave caracterizado por el subdesarrollo del corazón izquierdo. Representa entre el 2% y el 3% de todas las cardiopatías congénitas, y tiene una prevalencia de 2-3 casos por cada 10.000 nacidos vivos en los Estados Unidos. En la Argentina, el SCIH representa el 0,5-1% de 7000 nacidos vivos con cardiopatías congénitas por año y es la forma más común de enfermedad cardíaca con ventrículo único funcional.1-4
El objetivo
del tratamiento médico inicial es lograr una mezcla adecuada de la sangre
proveniente de ambos circuitos y optimizar la función del ventrículo. El
conducto arterioso debe mantenerse permeable mediante la infusión de
prostaglandinas con la posibilidad de realizar una septoplastia auricular con
balón transcatéter o quirúrgica para posibilitar la comunicación
interauricular,5 en casos bien definidos.
Durante la primera semana de vida, se lleva a cabo el procedimiento de Norwood (primer estadio quirúrgico), en el cual se crea una neoaorta a partir de la porción proximal de la arteria pulmonar, se amplía el foramen oval y se cierra la arteria pulmonar distal con el establecimiento de una fístula sistémico-pulmonar. En el posoperatorio inmediato, los pacientes presentan síndrome de bajo gasto cardíaco que no responde a la administración de agentes vasoactivos/inotrópicos, y pueden requerir oxigenación por membrana extracorpórea (ECMO). Según los datos de la Extracorporeal Life Support Organization (ELSO), la supervivencia tras la cirugía de Norwood y con ECMO oscila entre el 36% y el 44% (Figura). La muerte se produce por la imposibilidad de lograr un equilibrio entre las circulaciones sistémicas y pulmonares, por problemas anatómicos que persisten luego de la cirugía y por el daño miocárdico adquirido.6-8 La indicación de ECMO a pacientes en quienes ha fracasado el soporte inotrópico posquirúrgico es motivo de discusiones y, en muchos casos, se considera fútil. En nuestro país, no hay casos reportados; por tal motivo, presentar la evolución de esta niña puede aportar evidencia para futuros análisis.
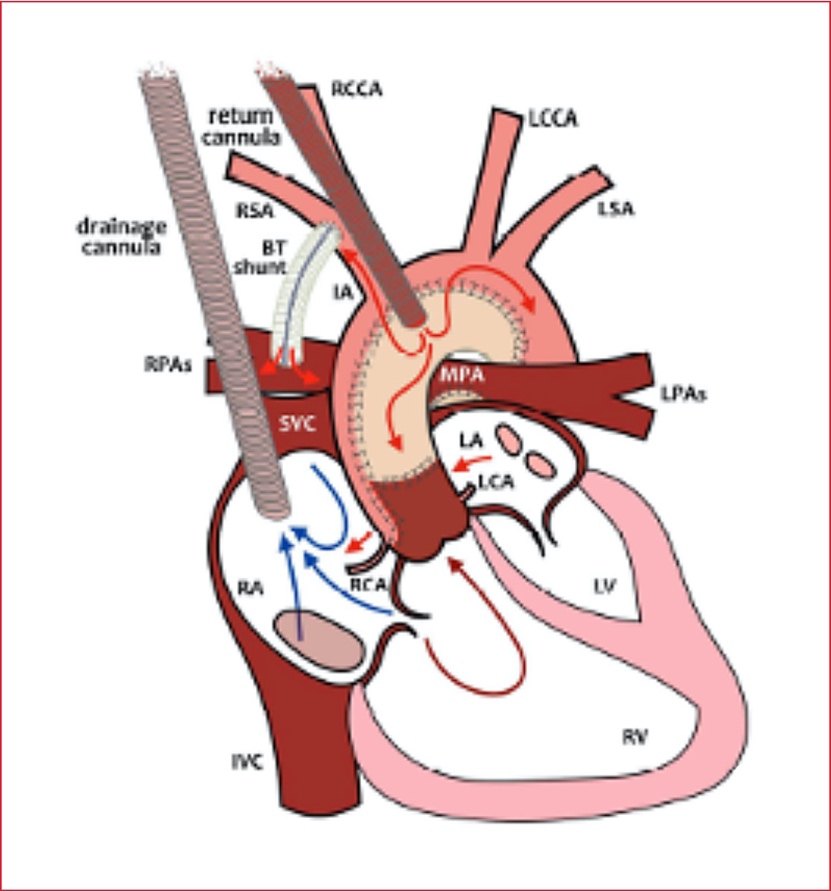
Figura. Canulación
de ECMO en un paciente con síndrome de corazón izquierdo hipoplásico.
Canulación ECMO y
flujos ECMO preferenciales en pacientes de ventrículo único con derivación
Blalock-Taussig. La cánula arterial se coloca en la neoaorta, pero también se
puede colocar a través de la arteria carótida o en la arteria innominada.
RCCA = arteria carótida común derecha, LCCA = arteria carótida común izquierda, LSA = arteria subclavia izquierda, RSA = arteria subclavia derecha, IA = arteria innominada, RPA = arterias pulmonares derechas, LPA = arteria pulmonar izquierda, MPA = arteria pulmonar principal, SVC = vena cava superior, IVC = vena cava inferior, RA = aurícula derecha, LA = aurícula izquierda, RCA = arteria coronaria derecha, LCA = arteria coronaria izquierda, RV = ventrículo derecho, LV = ventrículo izquierdo. Dibujo de Marta Velia Antonini.
Objetivo
Comunicar el caso de una paciente con síndrome de bajo gasto cardíaco que ingresó en ECMO luego de una cirugía por SCIH.
Caso clínico
Recién nacida a término, APGAR 8/9 que ingresó en la Unidad de Cuidados Intensivos Neonatales al nacer. No presentaba síntomas clínicos y las resistencias pulmonares eran elevadas. Se administró una infusión de prostaglandinas a 0,02 gamma/kg/min hasta los 6 días de vida cuando fue sometida a una cirugía de Norwood clásica, con un tiempo de circulación extracorpórea de 120 min, un clampeo aórtico de 50 min y parada cardíaca de 4 min. Tras la intervención, la niña ingresa en la UCIP con asistencia ventilatoria mecánica, requiere soporte inotrópico/vasoactivo creciente con adrenalina hasta 0,8 µg/kg/min y noradrenalina 1 µg/kg/min.
En el contexto de síndrome de bajo débito posquirúrgico, la niña desarrolló hipotensión sostenida (presión arterial sistólica <50 mmHg), con oligoanuria, saturación arterial de oxígeno del 66%, saturación venosa mixta del 35% y ácido láctico de 17 mmol/l (valor normal hasta 3,1 mmol/l). El ecocardiograma reveló discinesia septal, mala relajación diastólica, y fracciones de eyección y acortamiento severamente disminuidas. Ante estos hallazgos, comienza con ECMO a un flujo inicial de 180-200 cc/kg/min que, al tercer día, desciende a 120-140 cc/kg/min (Tabla).
Tabla
Línea
temporal, evolución, parámetros clínicos y bioquímicos
|
Día |
Pre-ECMO |
1 |
2 |
3 |
4 |
|
Flujo ECMO cc/kg/min |
- |
200 |
180 |
120 |
80 |
|
Adrenalina µg/kg/min |
0,8 |
0,05 |
0 |
0 |
0,2 |
|
Noradrenalina µg/kg/min |
1 |
0,08 |
0 |
0 |
0,1 |
|
Presión arterial |
45/22 |
65/35 |
70/45 |
81/45 |
70/40 |
|
Ácido láctico |
17,5 mmol/l |
6,8 mmol/l |
3,4 mmol/l |
1,9 mmol/l |
1,4 mmol/l |
|
Saturación venosa central |
35% |
41% |
62% |
65% |
66% |
|
Saturación de oxígeno |
66% |
75% |
85% |
80% |
83% |
|
Presión de oxígeno (mmHg) |
26 |
39 |
45 |
55 |
41 |
|
Plaquetas |
75.000 |
120.000 |
100.000 |
105.000 |
90.000 |
|
Ecocardiograma/Fracción de acortamiento |
12% |
18% |
21% |
23% |
25% |
Permaneció internada durante 4 días, lo que permitió la recuperación del ventrículo sistémico. Después de la descanulación, desarrolló una insuficiencia renal aguda y recibió diálisis peritoneal durante 5 días; al sexto día, se suspendieron las catecolaminas.
A los 14 días de la operación, se llevó a cabo el cierre del tórax diferido desde la cirugía, se logró la extubación el día 22 posoperatorio y permaneció con soporte no invasivo durante 4 días. Fue dada de alta de la UCIP el día 38 posquirúrgico. En la actualidad, está en el período interestadio de su segunda cirugía de anastomosis cavo-pulmonar (cirugía de Glenn).
Discusión
La hipoplasia ventricular izquierda es considerada una de las cardiopatías congénitas complejas más graves, y tiene una tasa de mortalidad alta. Su tratamiento quirúrgico consta de tres estadios.
La evolución durante las primeras 24-48 h posteriores a la cirugía de Norwood define la supervivencia al primer estadio en la mayoría de los pacientes. En este caso, la paciente desarrolló un síndrome de bajo gasto cardíaco severo durante las primeras 12-24 h posteriores a la cirugía, con progresión a falla multiorgánica sin respuesta al balance entre inotropismo y vasodilatación con drogas a altas dosis.
La ECMO es
una terapia ampliamente utilizada en pacientes pediátricos con cardiopatías
congénitas, especialmente con síndrome de bajo gasto cardíaco, hipoxia,
arritmias e imposibilidad de lograr el destete de la circulación extracorpórea.7,9 La tasa de mortalidad rondaba el 50%
en la década pasada, pero hoy, según cifras de la ELSO, es del 36% para niños
con soporte cardíaco.8,10
Durante
muchos años, se ha considerado a la ECMO una contraindicación en pacientes con
fisiología univentrircular. No obstante, este punto de vista puede ser
anacrónico en estos tiempos al analizar los recientes resultados y el aumento
creciente de los centros que indican esta terapéutica para esta compleja
cardiopatía congénita.8,9
Decidir cuándo iniciar la ECMO en estos pacientes puede ser un factor determinante de su evolución, ya que el tiempo que media entre la claudicación ventricular y la indicación precisa del soporte mecánico son factores determinantes para rescatar a este grupo de pacientes en quienes esta tecnología evitaría el aumento de drogas vasoactivas redundantes de efectos nocivos, como el mayor consumo de oxígeno en el miocardio o el desarrollo de arritmias acompañadas de alta letalidad.
El manejo del lactante en ECMO con fisiología de ventrículo único y anastomosis sistémico-pulmonar puede requerir que la anastomosis quede permeable con cierto grado de estenosis (se coloca un clip en tubo de Gore-Tex®) que asociado al incremento del flujo de la ECMO pueden compensar el run off pulmonar. Algunas publicaciones sugieren que un flujo de sangre de 150-200 cc/kg/min de la bomba de ECMO se asocia con mejores resultados y una compensación más rápida en el posoperatorio inmediato.9-11
Un estudio de una importante cohorte multicéntrica7 demostró que el mayor tiempo de ventilación y los niveles inotrópicos altos antes de la ECMO, junto con un soporte más prolongado, insuficiencia renal asociada y acidosis metabólica persistente incrementaron notoriamente la mortalidad.
Los riesgos más específicos incluyen una
pequeña aorta ascendente (<2 mm), estenosis mitral con atresia aórtica y
trombosis en el cortocircuito.7-10
Nuestra paciente tenía un bajo débito resistente a agentes inotrópicos y, al no tener residuo quirúrgico, fue considerada para soporte con ECMO.
Futuros estudios con más cantidad de pacientes podrán analizar la relación costo-eficacia de la ECMO en el SCIH y definir protocolos de cuidados e implementación considerando los distintos escenarios clínicos y sus riesgos. En pacientes con cardiopatías congénitas complejas con los riesgos que atañe el manejo de la ECMO, es menester analizar los protocolos vigentes a fin de optimizar la supervivencia y la calidad de vida.
Conclusión
La indicación de ECMO a niños sometidos a cirugía por hipoplasia del ventrículo izquierdo es controvertida; sin embargo, su indicación debe considerar el tiempo que media entre el desarrollo del síndrome de bajo gasto cardíaco y el aumento de agentes vasoactivos con el propósito de evitar los efectos nocivos asociados a estos fármacos.
Bibliografía
1. Reller MD, Strickland MJ, Riehle-Colarusso T, Mahle
WT, Correa A. Prevalence of congenital heart defects in metropolitan Atlanta,
1998-2005. J
Pediatr 2008; 153(6): 807-813. https://doi.org/10.1016/j.jpeds.2008.05.059
2.
Groisman
B, Bidondo MP, Barbero P, Gili J, Liascovich R. RENAC: Registro Nacional de
Anomalías Congénitas de Argentina. Arch Argent Pediatr 2013; 111(6): 484-494. https://doi.org/10.5546/aap.2013.484
3.
Samánek M, Slavík Z,
Zborilová B, Hrobonová V, Vorísková M, Skovránek J. Prevalence, treatment, and outcome of heart
disease in live-born children: a prospective analysis of 91,823 live-born
children. Pediatr Cardiol 1989; 10(4): 205-211. https://doi.org/10.1007/BF02083294
4.
Benson
DW, Martin LJ, Lo CW. Genetics
of hypoplastic left heart syndrome. J Pediatr 2016; 173: 25-31. https://doi.org/10.1016/j.jpeds.2016.02.052
5.
Graham
EM, Bradley S, Atz AM. Preoperative management of hypoplastic left heart syndrome. Expert Opin
Pharmacother 2005; 6(5): 687-693. https://doi.org/10.1517/14656566.6.5.687
6.
Jolley M,
Yarlagadda VV, Rajagopal SK, Almodovar MC, Rycus, PT, Thiagarajan RR.
Extracorporeal membrane oxygenation-supported cardiopulmonary resuscitation
following stage 1 palliation for hypoplastic left heart syndrome. Pediatr Crit
Care Med 2014; 15(6): 538-545. https://doi.org/10.1097/PCC.0000000000000159
7.
Sherwin
ED, Gauvreau K, Scheurer M, et al. Extracorporeal membrane oxygenation after
stage 1 palliation for hypoplastic left heart syndrome. J Thorac Cardiovasc
Surg 2012; 144(6): 1337-1343. https://doi.org/10.1016/j.jtcvs.2012.03.035
8.
Ugaki
S, Kasahara S, Kotani Y, et al. Extracorporeal
membrane oxygenation following Norwood stage 1 procedures at a single
institution. Artif Organs 2010; 34(11): 898-903. https://doi.org/10.1111/j.1525-1594.2010.01141.x
9.
Alsoufi
B, Shen I, Karamlou T, et al. Extracorporeal life support in neonates, infants,
and children after repair of congenital heart disease: Modern era results in a
single institution. Ann Thorac Surg 2005; 80:15-21. https://doi.org/10.1016/j.athoracsur.2005.02.023
10. ELSO, Extracorporeal Life Support Registry Report.
2014. Ann Arbor, MI.
11. Kolovos NS, Bratton SL, Moler FW, et al. Outcome of
pediatric patients treated with extracorporeal life support after cardiac
surgery. Ann Thorac Surg 2003; 76: 1435-1441. https://doi.org/10.1016/s0003-4975(03)00898-1