Complicaciones cardiovasculares, trombosis y coagulación en pacientes con COVID-19: “Una ayuda a su entendimiento”
[Cardiovascular complications,
thrombosis and coagulation in patients with COVID-19: “An aid for
understanding”]
Comité de Patología Crítica Cardiovascular. Sociedad
Argentina de Terapia Intensiva, Buenos Aires, Argentina
Dr. Luis Alberto Flores
Miembro Titular, SATI; Ex Director y Actual Secretario Científico del Comité de Patología Crítica Cardiovascular; Especialista Consultor en Cardiología y Terapia Intensiva.
Dr. Mario Kenar
Especialista en Terapia Intensiva y Cardiología; Miembro Titular, SATI; Director del Comité de Patología Crítica Cardiovascular SATI; Ex Jefe del Servicio de Terapia Intensiva, Clínica San Camilo, CABA.
Dra. Alicia B. Villaseca
Hematóloga; Miembro Titular de la Sociedad Argentina de Hematología, Sociedad Europea de Hematología, Sociedad Internacional de Hemostasia y Trombosis (ISTH); Jefa de Hematología Clínica San Camilo.
Dr. Jorge Ubaldini
Miembro Titular, SATI; Miembro del Comité de Patología Crítica Cardiovascular SATI; Profesor Titular de Emergentología, Facultad de Medicina, Universidad Católica Argentina, CABA
Dr. Gerardo Fernández Cid †
Miembro Titular, SATI; Secretario del Comité de Patología Crítica Cardiovascular SATI; Especialista en Cardiología y Terapia Intensiva.
Salvador De Francesca
Miembro Titular, SATI; Miembro del Comité de Patología Crítica Cardiovascular SATI; Especialista en Terapia Intensiva y Cardiología.
Dr. Daniel R. Andrada
Especialista en Terapia Intensiva - Diplomado en Ecocardiografía Doppler (UCC); Jefe de Servicio UTI, Sanatorio Junín, Catamarca; Jefe de Servicio UTI, IMP, Catamarca
Dra. Viviana Romero
Miembro Titular SATI; Miembro del Comité de Patología Crítica Cardiovascular SATI; Directora Médica de la “Clínica del Valle”, Comodoro Rivadavia, Chubut
Dra. Estela Molinas
Especialista en Terapia Intensiva; Miembro del Comité de Patología Crítica Cardiovascular SATI; Médica de Planta, Servicio de Terapia Intensiva, Hospital Zonal General de Agudos “Dr. Isidoro G. Iriarte”, Buenos Aires
Dr. Juan Francisco Loayza
Especialista en Terapia Intensiva - Miembro del Comité de Patología Crítica Cardiovascular SATI; Médico de Terapia Intensiva HZGA Evita Pueblo de Berazategui y Policlínico Santamarina Monte Grande
Dra. Karina Lozano
Miembro, SATI; Miembro del Comité de Patología Crítica Cardiovascular SATI; Médica de Planta y Coordinadora del Servicio de Emergencia, Hospital Británico, CABA
* Correspondencia: drfloresluis@gmail.com y mrkenar@gmail.com
† El Dr. Gerardo
Fernández Cid falleció el 8 de octubre de 2020. Agradecemos su participación en
este artículo.
Los
autores no declaran conflictos de intereses.
1. Introducción
A lo largo de la historia, los brotes de
enfermedades han complicado a la humanidad, muchas veces, devastando
civilizaciones. Desde 1930, se han descubierto numerosos coronavirus como la
etiología de enfermedades respiratorias, gastrointestinales, hepáticas y
neurológicas en animales. Únicamente se conocen siete coronavirus
causantes de enfermedad en los seres humanos. La mayoría de las veces son los
responsables del resfrío común y, en raras ocasiones, pueden producir
infecciones graves de las vías respiratorias inferiores. Estos coronavirus que
provocan infecciones respiratorias graves son patógenos zoonóticos que
comienzan en animales infectados y se transmiten de los animales a las
personas. En el siglo XXI, tres de siete de estos virus han sido responsables
de importantes brotes de neumonía de variada mortalidad. En 2002, se
identificó, en el sur de China, el SARS-CoV como la causa de un brote de
síndrome respiratorio agudo grave (severe acute respiratory syndrome,
SARS) y se extendió rápidamente a otros 28 países. Más de 8000 personas se
infectaron en julio de 2003, y 774 murieron. En 2012, se identificó el MERS-CoV
como la causa del síndrome respiratorio de Oriente Medio (Middle East
respiratory syndrome, MERS) que comenzó en Arabia Saudita, en 2012 y afectó
a 2500 personas. Un virus mucho menos contagioso que el SARS, pero que provocó
una mayor mortalidad, 858 muertes. En diciembre de 2019, comenzaron a
reportarse, en Wuhan, una ciudad de la provincia china de Hubei, los primeros
casos de una neumonía desconocida que no respondía a los tratamientos
tradicionales.1 El 30 de enero, la Organización
Mundial de la Salud declaró el estado de emergencia global y el 11 de marzo de
2020, declaró el estado de pandemia debido al alto número de contagiados en
todo el mundo. El patógeno, que llegó a identificarse como SARS-CoV-2, es un
nuevo coronavirus que ahora se sabe es el responsable de la enfermedad
COVID-19. Este nuevo virus pertenece a la misma familia del SARS‐coronavirus
(SARS‐CoV) y del MERS‐coronavirus (MERS‐CoV). Este virus de variable
contagiosidad tiene un número de reproducción (R0) aproximado de 3, por lo que
la cantidad de casos aumenta exponencialmente.2
Se transmite a través de las gotas de
Flügge al penetrar la vía respiratoria mediante la inhalación o al quedar sobre
superficies u objetos contaminados que, luego a través de las manos, pueden
tomar contacto con las membranas mucosas orales, nasales y oculares.3
El espectro de la enfermedad es muy
amplio, se puede presentar como casos asintomáticos, con síntomas leves
respiratorios o hasta una neumonía viral grave con gran compromiso del
parénquima pulmonar, insuficiencia respiratoria, shock y síndrome de disfunción
multiorgánica. Aunque las manifestaciones clínicas de la COVID-19 son
principalmente respiratorias, con el creciente número de pacientes infectados,
se han reportados complicaciones cardiovasculares, en una cantidad considerable
de casos.4,5
Los pacientes con factores de riesgo
cardiovascular que incluyen sexo masculino, edad avanzada, diabetes, hipertensión
y obesidad, así como aquellos con patología cardiovascular establecida y
enfermedad cerebrovascular, han sido reconocidos como poblaciones especialmente
vulnerables, con mayor morbilidad y mortalidad cuando padecen COVID-19. Además,
un número importante
de pacientes puede desarrollar una lesión cardíaca en el contexto de la
COVID-19, lo que originaría un mayor riesgo de muerte hospitalaria.6,7
La infección por SARS-CoV-2 está asociada con una variedad de mediadores proinflamatorios que se describen como componentes importantes en la fisiopatología de las complicaciones cardíacas y arrítmicas. La inflamación sistémica, un estado de coagulación anormal, la disfunción multiorgánica son factores que favorecen el aumento de las complicaciones trombóticas arteriales o venosas (síndromes coronarios agudos [SCA], tromboembolismo venoso). La miocarditis desempeñaría un papel importante en el desarrollo de insuficiencia cardíaca (IC) aguda por COVID-19.
Este documento tiene como objetivos:
a. Constituir una ayuda para la prevención y el manejo de pacientes con complicaciones cardiovasculares asociadas a la COVID-19, con especial acento en los pacientes críticos internados en terapia intensiva.
b. Abordar el impacto en las enfermedades cardiovasculares (ECV) preexistentes y las complicaciones cardíacas de novo en los resultados clínicos evolutivos de estos pacientes.
2. Consideraciones metodológicas
Los autores realizaron una exhaustiva revisión bibliográfica desde el inicio de la epidemia de COVID-19 hasta la actualidad. La revisión abarcó revistas de amplio impacto de Web of Science, revista nacionales e internacionales de prestigio reconocido por la comunidad médica. Utilizando los motores de búsqueda y las bases de datos de PubMed (MEDLINE), Google Scholar y SciELO, se realizó una búsqueda con los siguientes descriptores: “COVID-19”, “SARS-CoV-2” y “Coronavirus”, que se combinaron con “corazón”, “cardíaco”, “cardiovascular”, “lesión miocárdica”, “miocarditis”, “infarto agudo de miocardio”, “síndrome coronario agudo», «disritmia”, “arritmia”, “insuficiencia cardíaca”, “tromboembolismo venoso” y “coagulación”. También se revisaron las referencias cruzadas relevantes para estudios previos sobre el SARS y el MERS. Los autores incluyeron reportes de casos, estudios retrospectivos, estudios prospectivos, revisiones sistemáticas y metanálisis, guías clínicas y revisiones sistemáticas enfocadas en la COVID-19 y complicaciones cardiovasculares o tromboembolismo arterial y venoso. La búsqueda bibliográfica se restringió a estudios publicados en inglés y castellano.
3. Epidemiología
La Organización Mundial de la Salud, en
el reporte de situación número
186 del 24 julio de 2020, de 216 países, comunicó
15.296.926 personas infectadas con el nuevo coronavirus y 628.903 muertes por
COVID-19. En la región de las Américas, se han reportado 8.121.700 infectados,
con 325.625 defunciones asociadas a la COVID-19 con una tasa de letalidad del
4,1%. En la Argentina, se registraron 141.900 casos confirmados y 2617
pacientes fallecidos, para una tasa de letalidad del1,9%.8
La tasa de mortalidad asociada con la COVID-19 en el mundo es considerablemente más alta que con la influenza, según la estimación reciente de la Organización Mundial de la Salud. Esta tasa puede alcanzar valores más elevados en pacientes de edad avanzada, con comorbilidades y si no reciben cuidados intensivos eficientes.
Por otro lado, con otros coronavirus
zoonóticos, inclusive la epidemia del SARS 2002-2003 y, en el Medio Oriente, el
síndrome respiratorio (MERS-CoV), se han observado tasas de mortalidad
asociadas del 9,6% y 34,4%, respectivamente; sin embargo, la COVID-19 ha
provocado muchas más muertes que los dos brotes anteriores, debido a su
carácter pandémico.1,7
La gran mayoría de los estudios
realizados hasta el momento en China sugiere una potente asociación entre ECV y
la COVID-19 severa. Un análisis de las características epidemiológicas y
clínicas de 99 casos de la COVID-19 indicó que alrededor del 40% tenía ECV y
enfermedad cerebrovascular antes de la infección.9
Un metanálisis de seis estudios que incluyeron 1527 pacientes con COVID-19 examinó la prevalencia de ECV e informó que la prevalencia de hipertensión arterial (HTA) fue del 17,1%; la de ECV, del 16,4% y la de diabetes mellitus, del 9,7%. Los pacientes más graves y que requirieron ingreso en la unidad de cuidados intensivos (UCI) eran más propensos a sufrir estas comorbilidades comparados con los pacientes que no requirieron internación en la UCI.10 Se advirtieron tasas de letalidad más altas en el análisis de 44.672 casos confirmados de COVID-19 de Wuhan, China, en pacientes con ECV preexistente (10,5%), diabetes (7,3%) e HTA (6,0%), todas notablemente más altas que la tasa general de letalidad del 2,3%. La tasa de letalidad aumentó claramente con la edad: 8% en pacientes de 70 a 79 años (312 de 3918) y 14,8% en pacientes ≥80 años (208 de 1408).1
Un estudio realizado en Italia sugiere
tasas de letalidad y riesgo elevado de muerte en pacientes con comorbilidades,
similar a lo reportado en China.11 Asimismo, se
han estudiado otros factores de riesgo. En un estudio con 8910 pacientes de 169
hospitales de Asia, Europa y Norteamérica, se encontró que 515 habían fallecido
y 8395 habían sobrevivido. Los factores de riesgo asociados a la muerte fueron:
edad >65 años (razón de probabilidades [odds ratio, OR] 1,93; IC95%
1,60-2,41), enfermedad coronaria (OR 2,70; IC95% 2,08-3,51), IC (OR 2,48; IC95%
1,62-3,79), arritmia cardíaca (OR 1,95; IC95% 1,33-2,86), enfermedad pulmonar obstructiva
crónica (OR 2,96; IC95% 2,0-4,4) y tabaquismo (OR 1,79; IC95% 1,29-2,47). No se
halló un aumento en el riesgo de muerte en el hospital asociado con el uso de
inhibidores de la enzima convertidora de angiotensina (IECA) (2,1% vs. 6,1%; OR
0,33; IC95% 0,20-0,54) o el uso de bloqueantes de los receptores de
angiotensina (BRA) (6,8% vs. 5,7%; OR 1,23; IC95% 0,87-1,74).12
Por otra parte, los pacientes que desarrollaron las formas más graves de COVID-19 y que ingresaron en la UCI sufrieron un daño miocárdico agudo. En un estudio de 138 pacientes con COVID-19 internados en la UCI, se observó que tenían más probabilidades de sufrir complicaciones isquémicas o arritmia.
En un modelo ajustado de regresión de
Cox, los pacientes con elevación de biomarcadores circulantes de lesión cardíaca
tuvieron un riesgo incrementado de muerte. También se halló que el riesgo de
muerte asociado a lesión miocárdica fue un factor de riesgo más significativo
que la edad, la diabetes mellitus, la enfermedad pulmonar crónica o el
antecedente de ECV.13-15
En la cohorte de Wuhan, el daño
miocárdico y la IC ya sea sola o en combinación con insuficiencia respiratoria
representan hasta el 40% de la mortalidad en los pacientes más graves.16
Se han descrito complicaciones trombóticas arteriales y venosas, miocarditis con evolución hacia la IC y todo tipo de arritmias que complican el curso de la COVID-19, a los que se añaden los posibles efectos proarrítmicos del tratamiento médico dirigido a la COVID-19 y sus complicaciones.
Puntos clave
= Los pacientes con factores de riesgo cardiovasculares o ECV, en general, tienen las mismas probabilidades de contraer la infección por coronavirus que quienes no los tienen; sin embargo, en el caso de contraerla, su pronóstico es peor, son pacientes de riesgo.
= La COVID-19 severa se asocia a daño miocárdico y arritmia cardíaca. Puede debutar como trombosis arterial o venosa con el consiguiente SCA o tromboembolismo venoso, o provocar miocarditis y tener un papel protagonista en los pacientes con IC. Estas complicaciones aumentan significativamente la morbimortalidad de los pacientes graves con COVID-19.
Bibliografía
1.
Wu
Z, Mc Googan JM. Characteristics of
and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in
China: summary of a report of 72314 cases from the Chinese Center for Disease
Control and Prevention. JAMA 2020; 323(13): 1239-1242. https://doi.org/10.1001/jama.2020.2648
2.
Liu Y,
Gayle A, Wilder-Smith A, Rocklov J. The reproductive number of COVID-19 is
higher compared to SARS coronavirus. J Travel Med 2020; 27(2): taaa021. https://doi.org/10.1093/jtm/taaa021
3.
Van
Doremalen N, Bushmaker T, Morris DH, et al. Aerosol and surface stability of
SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med 2020; 382(16): 1564-1567. https://doi.org/10.1056/NEJMc2004973
4.
Shi S,
Qin M, Shen B, et al. Association of cardiac injury with mortality in
hospitalized patients with COVID‐19 in
Wuhan, China. JAMA 2020; 5(7): 802-810. https://doi.org/10.1001/jamacardio.2020.0950
5.
Hu H, Ma
F, Wei X, Fang Y. Coronavirus fulminant myocarditis saved with glucocorticoid
and human immunoglobulin. Eur Heart J 2021; 42(7): 206. https://doi.org/10.1093/eurheartj/ehaa190
6.
Zhou F,
Yu T, Du R, et al. Clinical course and risk factors for mortality of adult
inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet
2020; 395(10229): 1054-1062. https://doi.org/10.1016/S0140-6736(20)30566-3
7.
Driggin
E, Madhavan M, Bikdeli B, et al. Cardiovascular considerations for patients,
health care workers, and health systems during the COVID-19 pandemic. J Am Coll
Cardiol 2020; 18: 2352-2371. https://doi.org/10.1016/j.jacc.2020.03.031
8.
World
Health Organization. Situation Reports. Coronavirus disease (COVID-2019)
situation reports. Disponible
en: https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200724-covid-19-sitrep-186.pdf?sfvrsn=4da7b586_2
9.
Chen N,
Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases
of 2019 novel coronavirus pneumonia in Wuhan, China: A descriptive study.
Lancet 2020; 395: 507-513. https://doi.org/10.1016/S0140-6736(20)30211-7
10. Li B, Yang J, Zhao F, et al. Prevalence and impact of
cardiovascular metabolic diseases on COVID-19 in China. Clin Res Cardiol 2020;
109; 531-538. https://doi.org/10.1007/s00392-020-01626-9
11. Porcheddu R, Serra C, Kelvin D, et al. Similarity in
case fatality rates (CFR) of COVID-19/SARS-COV-2 in Italy and China. J Infect
Dev Ctries 2020; 14(2): 125-128. https://doi.org/10.3855/jidc.12600
12. Mehra MR, Desai SS, Kuy S, Henry TD, Patel AN.
Cardiovascular disease, drug therapy, and mortality in covid-19. N Engl J Med
2020; 382: e102. https://doi.org/10.1056/NEJMoa2007621
13. Wang D, Hu B, Hu C, et al. Clinical characteristics of
138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in
Wuhan, China. JAMA 2020; 323(11): 1061-1069. https://doi.org/10.1001/jama.2020.1585
14. Shi S, Qin M, Shen B, et al. Association of cardiac
injury with mortality in hospitalized patients with COVID-19 in Wuhan, China.
JAMA Cardiol 2020; 5(7): 802-810. https://doi.org/10.1001/jamacardio.2020.0950
15. Guo T, Fan Y, Chen M, et al. Cardiovascular implications
of fatal outcomes of patients with coronavirus disease 2019 (COVID-19). JAMA
Cardiol 2020; 5(7): 811-818. https://doi.org/10.1001/jamacardio.2020.1017
16. Ruan Q, Yang K, Wang W, Jiang L, Song J. Clinical
predictors of mortality due to COVID-19 based on an analysis of data of 150
patients from Wuhan, China. Intensive Care Med 2020; 46(5): 846-848. https://doi.org/10.1007/s00134-020-05991-x
4. Cuadro clínico - Manifestaciones cardiovasculares
Aunque la manifestación clínica predominante de la COVID-19 es la neumonía viral,1,2 se ha observado que también causa trastornos cardiovasculares, como miocarditis, arritmias, SCA y tromboembolismo.3 El daño miocárdico durante el curso de la COVID-19 es un factor predictivo independiente de alta mortalidad.4 Algunos pacientes se presentan sin los síntomas típicos de fiebre o tos y debutan con síntomas cardíacos, y estos resultan ser la primera manifestación clínica de la COVID-19.5 Además, se ha descrito un posible vínculo entre COVID-19 y el desarrollo de un síndrome similar a la enfermedad de Kawasaki en niños.
En la práctica clínica, cuando la lesión miocárdica se asocia con el típico dolor en el pecho, se debe sospechar un SCA. Si no hay lesiones significativas en las arterias subepicárdicas desde el punto de vista angiográfico, se descarta una enfermedad arterial coronaria.
Se deben investigar los diagnósticos alternativos de un infarto de miocardio sin obstrucciones coronaria (MINOCA), por ejemplo, microcirculación, disfunción endotelial y estados procoagulantes. Dentro de esta entidad cabe destacar la miocarditis, el síndrome de Takotsubo, el infarto por arterias epicárdicas de pequeño calibre asociadas a espasmo coronario, entre otros.
5. Métodos de diagnóstico no invasivos
La afectación y el compromiso de la
función cardíaca con la infección por SARS-CoV-2 (COVID-19) fueron reconocidos
y descritos en el curso de la pandemia. Su aparición de frecuencia considerable
determina un mal pronóstico y secuelas.1 Se
evidencia por la presencia de niveles elevados de troponinas (Tn) cardíacas, péptidos natriuréticos
y dímero D, coincidiendo con un elevado riesgo de infarto agudo de miocardio
(IAM), miocarditis, IC, paro cardíaco, arritmias y muerte súbita.3
El diagnóstico y el seguimiento de estos
cuadros en el marco de estrictos protocolos de aislamiento y seguridad para el
paciente y el personal sanitario afianzaron la ecocardiografía transtorácica
(ETT) como método eficaz al lado de los pacientes en las Unidades Críticas,
dejando de lado la ecocardiografía transesofágica (ETE), la tomografía
computarizada (TC), la resonancia magnética y la cardiología nuclear.6
Ecocardiografía transtorácica
= Su importancia ha sido comprobada y estudiada, pero corresponde hacer algunas consideraciones:
= No debe formar parte como estudio de rutina, se justifica el procedimiento si el resultado incide en la estrategia terapéutica.
= En pacientes con COVID-19, la ETT se debe realizar focalizada en la adquisición de imágenes que respondan cuestiones clínicas específicas para la resolución de problemas.
= La necesaria realización de estudios complementarios con ecografía pleuropulmonar en la UCI determina la eficacia de la estrategia POCUS (point of care ultrasound) para el diagnóstico y el seguimiento de las complicaciones cardiovasculares en pacientes críticos con COVID-19.6
= Requiere de un equipo de protección personal completo y aislamiento del equipo que evite la infección del operador y la transmisibilidad.
= A menudo, se debe realizar con el paciente en decúbito prono, lo que dificulta más el procedimiento.
= Interpretar el estudio en el marco de alto PEEP e interacción cardiopulmonar.
Indicaciones6
1. Elevación progresiva de biomarcadores de daño miocárdico (TnT, péptido natriurético tipo B [BNP]).
2. Aparición de cambios en el electrocardiograma sugerentes de isquemia.
3. Inestabilidad hemodinámica de aparición brusca.
4. Aumento de la demanda de drogas vasoactivas.
5. Deterioro de la función respiratoria.
6. Sospecha de cor pulmonar agudo, dímero D elevado.
7. Antes de la oxigenación por membrana extracorpórea (extracorporeal membrane oxygenation, ECMO) para valorar la función cardíaca.
Procedimiento
El procedimiento está establecido en las últimas guías de sociedades científicas.7 Se debe efectuar un estudio que sea rápido y responda a preguntas sobre el contexto clínico del paciente.
Evaluación de la
función cardíaca
Función del ventrículo izquierdo (VI)
= Contractilidad global: Según las Guías, se estima calculando la fracción de eyección del VI por el método de Simpson, en el plano A4C y A2C.7.8 Sin embargo, una estimación visual cualitativa o semicuantitativa ha demostrado una buena correlación con el método estándar en los pacientes críticos, por lo que puede ser una alternativa válida.9
= Monitorización hemodinámica: Se toma como parámetro la cuantificación de la integral velocidad-tiempo del flujo en el tracto de salida del VI (IVTTSVI) para la estimación del volumen sistólico sin el cálculo del área del tracto de salida del VI.4
= Precarga ventricular: La evaluación de variaciones en la distensibilidad de la vena cava inferior con el ciclo respiratorio (plano subcostal) predicen la respuesta a la expansión con fluidos.5
= Contractilidad segmentaria: Su evaluación resulta útil si hay IAM.
Función del ventrículo derecho (VD)
La elevada frecuencia de compromiso del VD observada en pacientes con infección por SARS-CoV-2 (COVID19) obliga a su evaluación sistemática con la ecocardiografía, la cual permite detectar si hay dilatación del VD, disfunción sistólica del VD, movimiento paradójico septal, dilatación de la vena cava inferior e hipertensión pulmonar. Estos datos son importantes, ya que configuran la presencia de fallo del VD secundario a un trastorno pulmonar primario que origina un incremento súbito en las resistencias vasculares pulmonares (cor pulmonar agudo). En estos pacientes, las causas más frecuentes de cor pulmonar agudo son el síndrome de dificultad respiratoria aguda (SDRA) y el tromboembolismo pulmonar.
= Valoración del tamaño del VD: Se objetiva preferentemente en el plano apical cuatro cámaras (A4C) que proporciona más información sobre el tamaño del VD, al permitir la comparación con el VI. Se debe obtener un plano A4C centrado en el VD, el plano paraesternal eje largo que muestra el tamaño del VD y su relación con el VI. El plano paraesternal eje corto (PSAX), a nivel de los músculos papilares o la válvula mitral, muestra al VD abrazando al VI en forma de semiluna. Se toma la relación entre ambos ventrículos para determinar la dilatación del VD:
VD/VI <0,6 ® tamaño del VD normal
VD/VI = 0,6-1 ® dilatación leve del VD
VD/VI >1 ® dilatación severa del VD
= Movimiento paradójico septal
Desviación del tabique interventricular hacia el VI durante la sístole.
= Valoración de la vena cava inferior
La vena cava inferior se estudia en el plano subcostal. Presencia de una vena cava inferior dilatada (>21 mm) y con escaso colapso respiratorio. Estima la presión de la aurícula derecha.
= Valoración de la hipertensión pulmonar
Se calcula de la obtención del gradiente de la insuficiencia tricuspídea, al cual se le suma la presión de AD estimada por la variación con el ciclo respiratorio de la vena cava inferior. Cuando la estimación de la presión sistólica de la arteria pulmonar por el método anterior no resulta posible, se puede utilizar el tiempo de aceleración de la arteria pulmonar.
= Valoración de la función sistólica del VD
Se obtiene de la medición de la excursión sistólica del anillo tricuspídeo y la velocidad máxima de la onda sistólica a nivel lateral del anillo tricuspídeo medida por Doppler tisular (onda St).
Ecocardiografía transesofágica
La ETE conlleva un incremento del riesgo de diseminación de la COVID-19 con aerosolización de una carga viral considerable, por lo cual se desaconseja. La angio-TC y la resonancia magnética cardíacas implican un alto riesgo en el paciente crítico con COVID-19, tanto por su traslado intrahospitalario, como por la contaminación y la diseminación en la unidad hospitalaria.
Puntos clave
= La ETT es la mejor herramienta diagnóstica y de seguimiento de los pacientes críticos con complicaciones cardiovasculares que tienen COVID-19.
= Debe realizarse bajo protocolo POCUS con el objetivo de lograr rápidamente la información necesaria.
= Reafirma la necesidad de formación en Ecografía Crítica y especializada en Ecocardiografía de los especialistas en terapia intensiva, los cuales cumplen en disponibilidad permanente la atención de los enfermos críticos.
= En el contexto de la pandemia y con un elevado riesgo de contagio del operador, deben extremarse las medidas de protección y aislamiento para su práctica segura.
Bibliografía
1.
Szekely
Y, Lichter Y, Taieb P, et al. The spectrum of cardiac manifestations in
coronavirus disease 2019 (COVID-19) - a systematic echocardiographic study.
Circulation 2020; 142(4): 342-353. https://doi.org/10.1161/CIRCULATIONAHA.120.047971
2.
Driggin
E, Madhavan M, Bikdeli B, et al. Cardiovascular
considerations for patients, health care workers, and health systems during the
COVID-19 pandemic. J Am Coll Cardiol 2020; 75(18): 2352-2371. https://doi.org/10.1016/j.jacc.2020.03.031
3. The European Society for Cardiology. ESC Guidance for the Diagnosis and Management of CV Disease during the COVID-19 Pandemic. Disponible en: https://www.escardio.org/Education/COVID-19-and-Cardiology/ESCCOVID-19-Guidance. (Última actualización: 10 de junio 2020)
4. Barbier C, Loubieres Y, Schmit C, et al. Respiratory changes in inferior vena cava are helpful in predicting fluid responsiveness in ventilated septic patients. Intensive Care Medicine 2004; 30(9): 1740-1746. https://doi.org/10.1007/s00134-004-2259-8
5. Fraile Gutiérrez V, Ayuela Azcárate JM, Perez Torres D, et al. Ecografía en el manejo del paciente crítico con infección por SARS-CoV-2 (COVID-19): una revisión narrativa. Med Intensiva 2020; 44(9): 551-565. https://doi.org/10.1016/j.medin.2020.04.016
6.
Mitchell
C, Rahko PS, Blauwet LA, et al. Guidelines for Performing a Comprehensive
Transthoracic Echocardiographic Examination in Adults: Recommendations from the
American Society of Echocardiography. J Am Soc Echocardiogr 2019; 32(1): 1-64. https://doi.org/10.1016/j.echo.2018.06.004
7.
Lang RM, Badano LP, Mor Avi V, et al. Recommendations for cardiac chamber
quantification by echocardiography in adults: an update from the American
Society of Echocardiography and the European Association of Cardiovascular
Imaging. Eur Heart J Cardiovasc Imaging 2015; 16: 233-270. https://doi.org/10.1093/ehjci/jev014
8. Shahgaldi K, Gudmundsson P, Manouras A, et al. Visually estimated ejection fraction by two dimensional and triplane echocardiography is closely correlated with quantitative ejection fraction by real-time three-dimensional echocardiography. Cardiovasc Ultrasound 2009; 7: 41. https://doi.org/10.1186/1476-7120-7-41
9. Cecconi M, De Backer D, Antonelli M, et al. Consensus on circulatory shock and hemodynamic monitoring. Task Force of the European Society of Intensive Care Medicine. Intensive Care Med 2014; 40(12): 1795-1815. https://doi.org/10.1007/s00134-014-3525-z
6. Fisiopatología de la lesión cardiovascular
Orthocoronavirinae,
comúnmente conocidos como coronavirus, es una
subfamilia de virus ARN monocatenario positivos perteneciente a la familia Coronaviridae. Se les
llama coronavirus por la corona de puntas que se ve alrededor de su superficie.
El SARS-CoV-2 es un nuevo
coronavirus identificado como la causa de la enfermedad por coronavirus de 2019
(COVID-19) que comenzó en Wuhan, China, a fines de 2019 y se ha
diseminado por todo el mundo. El SARS-CoV-2 posee un alto poder de contagio interhumano, pacientes
asintomáticos u oligosintomáticos que contagian, y una relativa baja virulencia
y letalidad facilitan su transmisión.1
El
SARS-CoV-2 penetra por la mucosa nasal, los bronquios y llega a los neumocitos,
uniéndose y penetrando en la célula. La proteína viral
(S) que tiene forma de pico, se une al receptor de la ECA 2 (ECA2), que se
encuentra en la superficie externa de la célula; en un segundo paso, la serina
proteasa transmembrana tipo 2 (TMPRSS2) facilita la entrada del virus en la
célula y, de allí, su proceso de reproducción intracelular. El receptor de la
ECA2 y la TMPRSS2 tienen gran expresión en neumocitos tipo ll, las células
renales e intestinales y el endotelio.2
Por otro lado, el bloqueo farmacológico de los receptores de la ECA2 y los antagonistas del receptor de la angiotensina (ARA) no afecta esta enfermedad, según un estudio de 4480 pacientes, no se observaron efectos adversos.3 Cuando el SARS-CoV-2 infecta los linfocitos T se produce linfopenia agregada a la respuesta inflamatoria de tipo humoral (citocinas) y mediada por inmunidad celular, que limita la producción de linfocitos (linfopoyesis), se induce la apoptosis, generando una marcada disminución de linfocitos. La replicación viral altera las barreras epiteliales en el pulmón y afecta el endotelio produciendo un influjo de monocitos y neutrófilos que desencadena una respuesta inflamatoria con infiltrado celular y edema tipo membrana hialina, que son las primeras imágenes que aparecen en la TC de pulmón con infiltrados difusos, primeras fases del SDRA.
La fractura en la integridad de la barrera endotelial, la alteración de la difusión del oxígeno a través de las membranas alvéolo-capilar y el deterioro de la capacidad de oxigenación son las expresiones típicas de la COVID-19.
En las formas más graves, se produce una activación de la coagulación.4 La inflamación alveolar y capilar induce la formación de microtrombosis, con mayor daño pulmonar. Si esta enfermedad que nos ocupa tiene una respuesta mayor en estos puntos es algo que actualmente desconocemos.
Esto contribuye a la alta incidencia de complicaciones trombóticas, venosas y arteriales, trombosis venosa profunda, tromboembolismo pulmonar, trombosis arteriales en miembros, isquemia cerebral e IAM sin mediar un accidente de placa, como sucede en la mayoría de los casos.5
La respuesta desmedida de huésped ante
esta agresión produce sepsis, shock séptico, lo que contribuye a la falla
multiorgánica.6
Un grupo pequeño de pacientes con COVID-19 desarrolla manifestaciones cardiovasculares, el denominado “síndrome cardiovascular agudo COVID-19”.7-9
Este cuadro se presenta como una lesión cardíaca aguda con miocardiopatía, arritmias ventriculares y cuadros de inestabilidad hemodinámica. Es difícil precisar su etiología, pero puede estar relacionada con miocarditis, lesión microvascular o depresión miocárdica por citocinas.
El SARS-CoV-2 podría replicarse dentro del miocito y los pericitos que, en sí, es una miocarditis viral.
La experiencia con los otros coronavirus, MERS y SARS, y actualmente con el SARS-CoV-2 muestra que son capaces de producir miocarditis. El daño miocárdico se pone de manifiesto con una variedad de presentaciones, aumento de marcadores cardíacos especialmente Tn de alta sensibilidad (Tn-AS), cambios en el electrocardiograma, alteraciones en la ecocardiografía, deterioro de la función ventricular, cuadro clínico de IC, arritmias ventriculares, SCA atípico y muerte súbita.9
En un estudio de enfermos críticos con COVID-10 de China, el 29% de 52 pacientes tenía una lesión miocárdica (TnI-AS >28 ng/l). Un informe retrospectivo de 416 pacientes hospitalizados con COVID-19 indicó que aproximadamente el 20% (82/416) tenía una lesión miocárdica aguda (TnI >0,04 μg/l) y que aquellos con una lesión miocárdica tenían más edad y comorbilidades.
La lesión miocárdica se asoció con una mayor mortalidad, que persistió después del ajuste de las características basales y las comorbilidades.10-12 La elevación de Tn es un marcador de daño miocárdico y siempre su presencia indica mal pronóstico en pacientes con COVID-19. Cuando se presenta como un cuadro de sepsis, esta, en un alto porcentaje cursa con aumento de Tn, por la lesión miocárdica por citocinas, drogas inotrópicas y, en este cuadro en particular, también por la severa hipoxemia.
El receptor de la ECA2 tiene una alta expresión en el epitelio alveolar pulmonar tipos I y II, pericitos, cardiomiocitos, enterocitos en el intestino delgado, incluidos el duodeno, el yeyuno y el íleon, y las células endoteliales arteriales y venosas.
Los estudios de autopsia en pacientes que murieron por SARS-CoV-1 han confirmado la presencia de virus dentro de las células que expresan prominentemente el receptor de la ECA2, incluidas las células epiteliales bronquiolares y alveolares, las células epiteliales tubulares renales, las células epiteliales de la mucosa y del tracto gastrointestinal, y los cardiomiocitos.
Las muestras histológicas de tejido pulmonar de pacientes con COVID-19 revelan un patrón de lesión similar al que se informó con el SARS-CoV-1.
Los datos se recogieron de muestras pequeñas para COVID-19, pero ofrecen una prueba de lesión celular directa en tejidos con expresión del receptor de la ECA2.
Los objetivos celulares del miocardio para el SARS-CoV-2 pueden incluir pericitos, cardiomiocitos, fibroblastos y células inmunes, como los macrófagos residentes.12 Podría ser que el SARS-CoV-2 puede infectar directamente el miocardio, como cualquier miocarditis se manifestará predominantemente en una primera etapa aguda o subaguda.
Es dudosa la hipótesis de que el SARS-CoV-1 o el SARS-CoV-2 pueden inducir la producción de autoanticuerpos cardíacos que se desarrollarían debido a la semejanza molecular, como el virus coxsackie B y la proteína S2 de la miosina cardíaca.
Si la persistencia viral o la inflamación de la COVID-19 pueden causar una miocardiopatía crónica dilatada, como ocurre con otros virus, es algo que todavía se desconoce, pero la presencia viral en el tejido cardíaco, la inducción de autoanticuerpos contra estructuras de la célula cardíaca unidas a la proteína S viral y el receptor de la ECA2 también se desconocen.9,13
Hablamos de miocarditis, enfermedad casi siempre de origen viral, que produce un daño agudo, subagudo y, en un alto porcentaje, evoluciona a formas crónicas, como miocardiopatía dilatada, que al final termina frecuentemente en trasplante cardíaco o la muerte.
La miocarditis aparece en pacientes con COVID-19 varios días después del inicio de la fiebre. Esto indica daño al miocardio causado por una infección viral. Los mecanismos de la lesión miocárdica inducida por el SARS-CoV-2 pueden estar relacionados con la regulación positiva de la ECA2 en el corazón y los vasos coronarios. La insuficiencia respiratoria y la hipoxia en pacientes con COVID-19 también pueden causar daño al miocardio y los mecanismos inmunitarios de la inflamación miocárdica pueden ser especialmente importantes. Por ejemplo, la lesión cardíaca conduce a la activación de la respuesta inmune innata con liberación de citocinas proinflamatorias, así como a la activación de mecanismos de tipo autoinmune adaptativo a través del mimetismo molecular.
Su diagnóstico se basa principalmente en criterios clínicos y en técnicas no invasivas, especialmente la resonancia magnética cardíaca.14 La inducción de inflamación y la liberación de citocinas pueden producir la alteración de la función miocárdica.
El 25-60% de los casos de shock séptico por bacterias grampositivas o gramnegativas induce un cuadro de depresión miocárdica, que se denomina “disfunción miocárdica” un proceso de deterioro de la función ventricular, con disfunción sistólica y diastólica, con un mecanismo íntimo que es la hibernación del cardiomiocito, para no morir en este proceso de escaso aporte de energía y que habitualmente con la mejoría del cuadro general, la reversión de la sepsis, el corazón retoma su función normal.
La lesión miocárdica en pacientes con COVID-19 también puede ser el resultado de una activación inflamatoria profunda y la liberación de citocinas. Un estudio de autopsia mínimamente invasiva en pacientes con COVID-19 describió la presencia de SARS-CoV-2 dentro del tejido alveolar, pero no se lo aisló en el tejido cardíaco. Se encontraron cambios degenerativos y necrosis de tejido miocárdico, esto sugiere un mecanismo secundario de lesión, no directa por el SARS-CoV-2, como sí lo hace el SARS-CoV-1.
Sabemos que la lesión miocárdica aguda por activación inmune viral diferente de la COVID-19 puede deberse a la activación de células T y B que inducen una cascada inflamatoria, producción de citocinas y de anticuerpos. En pacientes con COVID-19 graves o críticos, se produce la respuesta inflamatoria con producción de citocinas.6,15
La marcada respuesta inflamatoria también puede desencadenar el desarrollo de coagulopatía intravascular diseminada en pacientes críticos. Como tal, la trombosis microvascular en los vasos coronarios debido a la coagulopatía intravascular diseminada es otro mecanismo, pero no se ha probado que puede contribuir a la lesión miocárdica.6,16,17
Puntos clave
= La fisiopatología de la infección por coronavirus implica la unión del SARS-CoV-2 al receptor de la ECA2 del huésped para mediar la entrada en las células.
= La ECA2, que se expresa en los pulmones, el corazón y los vasos, es un miembro clave del sistema renina angiotensina (SRA) importante en la fisiopatología de las ECV.
= La ECV asociada con la COVID-19 probablemente implica la desregulación del sistema SRA/ECA2 debido a la infección por SARS-CoV-2 y a comorbilidades, como la hipertensión.
= La ECV puede ser un fenómeno primario en pacientes con COVID-19, pero puede ser secundario a una lesión pulmonar aguda que conduce a un aumento de la carga de trabajo cardíaco, potencialmente problemático en pacientes con IC preexistente.
= La tormenta de liberación de citocinas, originada por el desequilibrio de la activación de las células T con la liberación desregulada de interleucina (IL)-6, IL-17 y otras citocinas, puede contribuir a la ECV en pacientes con COVID-19. Esto también es común en los cuadros de sepsis. El direccionamiento de IL-6 se está probando terapéuticamente.
=
La
activación del sistema inmunológico junto con las alteraciones del
inmunometabolismo pueden causar la inestabilidad de la placa, lo que contribuye
al desarrollo de episodios coronarios agudos.
Bibliografía
1.
Bansal
M. Cardiovascular disease and COVID-19. Diabetes and Metabolic Syndrome:
Clinical Research and Reviews 2020; 14(3): 247e250. https://doi.org/ https://doi.org/10.1016/j.dsx.2020.03.013
2. Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 2020; 181(2): 271-280. https://doi.org/10.1016/j.cell.2020.02.052
3. Fosbøl EL, Butt JH, ØstergaardL, et al. Association of angiotensin-converting enzyme inhibitor or angiotensin receptor blocker use with COVID-19 diagnosis and mortality. JAMA 2020; 324(2): 168-177. https://doi.org/10.1001/jama.2020.11301
4. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 2020; 18(4): 844-847. https://doi.org/10.1111/jth.14768
5. Klok FA, Kruip M JHA, vander Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res 2020; 191: 145-147. https://doi.org/10.1016/j.thromres.2020.04.013
6. Joost Wiersinga W, Rhodes A, Cheng AC, et al. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19). A review. JAMA 2020; 324(8): 782-793. https://doi.org/10.1001/jama.2020.12839
7. Docherty AB, Harrison EM, Green CA, et al; ISARIC4C investigators. Features of 20 133 UK patients in hospital with COVID-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study. BMJ 2020; 369:m1985. https://doi.org/10.1136/bmj.m1985
8. Li B, Yang J, Zhao F, et al. Prevalence and impact of cardiovascular metabolic diseases on COVID-19 in China. Clin Res Cardiol 2020; 109(5): 531-538. https://doi.org/10.1007/s00392-020-01626-9
9. Hendren NS, Drazner MH, Bozkurt B, et al. Description and proposed management of the acute COVID-19 cardiovascular syndrome. Circulation 2020; 141(23): 1903-1914. https://doi.org/10.1161/CIRCULATIONAHA.120.047349
10. Shi S, Qin M, Shen B, et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol 2020; 5(7): 802-810. https://doi.org/10.1001/jamacardio.2020.0950
11. Inciardi RM, Lupi L, Zaccone G, et al. Cardiac involvement in a patient with coronavirus disease 2019 (COVID-19). JAMA Cardiol 2020; 5(7): 819-824. https://doi.org/10.1001/jamacardio.2020.1096
12. Tian S, Hu W, Niu L, et al. Pulmonary pathology of early-phase 2019 novel coronavirus (COVID-19) pneumonia in two patients with lung cancer. J Thorac Oncol 2020; 15(5): 700-704. https://doi.org/10.1016/j.jtho.2020.02.010
13. Caforio AL, Calabrese F, Angelini A, et al. A prospective study of biopsy-proven myocarditis: prognostic relevance of clinical and aetiopathogenetic features at diagnosis. Eur Heart J 2007; 28: 1326-1333. https://doi.org/10.1093/eurheartj/ehm076
14. Kindermann I, Barth C. Update on myocarditis. J Am
Coll Cardiol 2012; 59(9): 779-792. https://doi.org/
10.1016/j.jacc.2011.09.074
15. Fei Zhou, Ting Yu, Ronghui Du, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020; 395(10229): 1054-1062. https://doi.org/10.1016/S0140-6736(20)30566-3
16. Boral BM, Williams DJ, Boral LI.
Disseminated intravascular coagulation. Am J Clin Pathol 2016; 146(6): 670-680.
https://doi.org/10.1093/ajcp/aqw195
17. European Society of Cardiology. ESC Guidance for the Diagnosis and Management of CV Disease during the COVID-19 Pandemic. 2020. Disponible en: https://www.escardio.org/Education/COVID-19-and-Cardiology/ESC-COVID-19-Guidance https://www.escardio.org/Education/COVID-19-and-Cardiology/ESC-COVID-19-Guidance https://www.escardio.org/Education/COVID-19-and-Cardiology/ESC-COVID-19-Guidance
7. Insuficiencia cardíaca y
COVID-191-5
Paciente con IC crónica
Los pacientes con IC crónica son un grupo especialmente vulnerable, por su mayor riesgo de contagio y la gravedad de la enfermedad. Además, como los pacientes con COVID-19 probablemente sean mayores y tengan comorbilidades, tales como enfermedad arterial coronaria, HTA y diabetes; la IC podría ser el resultado de una exacerbación de estas afecciones preexistentes. Por otro lado y, en una etapa más avanzada de infección por el coronavirus, la respuesta del sistema inmune a la infección podría desencadenar el desarrollo de una miocardiopatía inducida por estrés o disfunción miocárdica relacionada con citocinas, como ocurre con la disfunción cardíaca asociada a sepsis. Dado que la población con IC tiene un mayor riesgo de infección por SARS-CoV-2 y el pronóstico de la COVID-19 es peor en ellos, parece razonable limitar al máximo las consultas presenciales durante un brote epidémico. También es de ayuda la información que se puede obtener a través de la revisión, en remoto, de los desfibriladores automáticos implantables con terapia de resincronización o sin ella. La Asociación de Insuficiencia Cardiaca de la Sociedad Española de Cardiología ha emitido recomendaciones respecto a la asistencia del paciente con IC crónica (Figura 1). De la misma manera, recomienda en qué situaciones especiales se debe considerar una visita presencial o remitir a urgencias (Tabla 1).
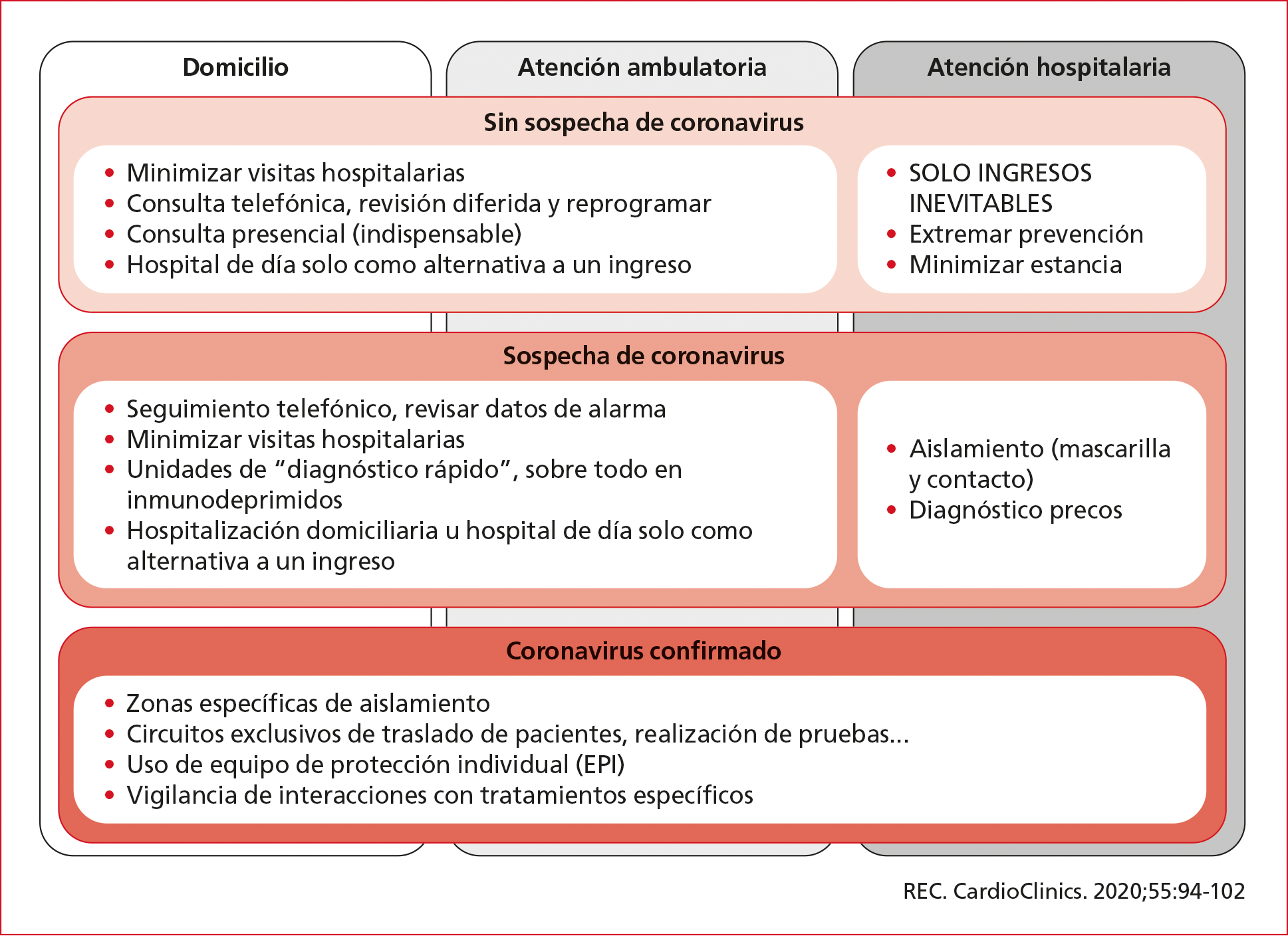
Figura 1. Recomendaciones de la Sociedad Española de Cardiología.
TABLA 1
Situaciones
en las que considerar una visita presencial o derivar a urgencias
|
= Empeoramiento
de los síntomas o signos de IC que no hayan respondido al aumento
domiciliario de diuréticos o cuando se presente un aumento de >1 grado de
clase funcional, datos de bajo gasto o síncope = Descargas
repetidas del desfibrilador automático implantable (DAI) o aparición de
alarmas graves en la revisión telemática = Frecuencia
cardíaca repetida <40 lat./min o >100 lat./min = Dolor
torácico de perfil isquémico y de características inestables = Deseo
del paciente, consensuado con el médico y tras valorar el riesgo/beneficio |
El tratamiento acorde a las guías, que incluye betabloqueantes, IECA, BRA o sacubitril/valsartán y antagonista del receptor de mineralocorticoides, debe continuarse en pacientes con IC crónica, independientemente de la COVID-19 y, en caso de infección, deberá adecuarse a las complicaciones que surjan. Se han propuesto tres fases probables de la infección y su compromiso orgánico: estadio 1 (leve) o infección temprana; estadio 2 (moderado) con compromiso pulmonar con (IIa) o sin (IIb) hipoxia; y estadio III (severo) donde prima la respuesta inflamatoria sistémica aumentada.
Los pacientes con IC crónica pueden desarrollar COVID-19. En particular, los pacientes de edad avanzada con función diastólica reducida pueden desarrollar IC con fracción de eyección preservada durante el curso de la COVID-19, que puede desencadenarse por fiebre alta, taquicardia, hidratación excesiva e insuficiencia renal. En pacientes con IC con fracción de eyección preservada, la resonancia magnética cardíaca podría ayudar a detectar los cambios inducidos por la COVID-19.
Pacientes con trasplante cardíaco
Este es un grupo vulnerable muy especial. La Sociedad Española de Cardiología recomienda mantener la inmunosupresión en casos leves o suspenderla por 48 h y, en casos moderados o severos, considerar la suspensión de micofenolato/azatioprina y reducir los niveles de anticalcineurínico, se puede aumentar la dosis de la corticoterapia o incluso administrar inmunoglobulinas.
Paciente internados con IC aguda y COVID-19 presunto o confirmado
El daño miocárdico y la IC, ya sea sola o en combinación con insuficiencia respiratoria, representan hasta el 40% de la mortalidad en estos pacientes. Los mecanismos subyacentes de la IC aguda en pacientes con COVID-19 pueden incluir isquemia miocárdica aguda, infarto tipos 1 o 2, SDRA, lesión renal aguda e hipervolemia, miocardiopatía inducida por estrés, miocarditis y arritmias.
La neumonía por COVID-19 puede empeorar el estado hemodinámico debido a la hipoxemia, la deshidratación y la hipoperfusión. Además, el aumento de la demanda metabólica de una enfermedad sistémica puede causar la descompensación de la IC estable preexistente.
En la situación de pandemia actual, ante un paciente con IC crónica y aumento de su disnea habitual, se hace necesario descartar la COVID-19 como causa de la descompensación; por otro lado, podrá desencadenar la agudización de la IC. Si la disnea se acompaña de fiebre, tos o contacto con personas con diagnóstico de COVID-19, deberíamos considerar a nuestro paciente como caso sospechoso. Hay parámetros clínicos y exámenes complementarios que ayudan al diagnóstico (Tabla 2).
TABLA 2
Parámetros
diferenciales clínicos y exámenes en pacientes con COVID19 e insuficiencia cardíaca
|
|
COVID-19 |
Insuficiencia cardíaca |
|
Analítica |
|
|
|
Linfopenia |
+++ |
− |
|
Aumento del NT-proBNP |
−/+ |
+++ |
|
Aumento de la proteína C reactiva |
+++ |
+ |
|
Aumento del dímero D |
+++ |
−/+ |
|
Estudios por imágenes |
|
|
|
Radiografía de tórax |
|
|
|
Infiltrados |
Periféricos |
Centrales, “alas de mariposa” |
|
Hilios aumentados |
−/+a |
+++ |
|
Cardiomegalia |
− a |
+ |
|
Derrame pleural |
− a |
+ |
|
Tomografía computarizada |
Imágenes en vidrio deslustrado de predominio
periférico bilaterales (al inicio pueden ser unilaterales) ± condensaciones
segmentarias ± engrosamiento
pleural |
Imágenes en vidrio deslustrado de predominio
central Condensaciones de predominio central Dilatación de venas pulmonares Derrame pleural |
NT-proBNP = porción N-terminal del pro-péptido
natriurético tipo B.
a Puede estar presente en caso de insuficiencia
cardiaca de base.
− Ausente.
−/+ Ausente/poco
frecuente.
+ Poco frecuente
Se recomienda realizar una ecocardiografía urgente en aquellos pacientes que desarrollen IC aguda de novo, o crónica agudizada, arritmia, cambios en el electrocardiograma o cardiomegalia. Será útil para evaluar, además, una posible falla del VD e hipertensión pulmonar en el contexto de un enfermo grave.
Respecto a la fluidoterapia, ante una situación de dificultad respiratoria sin hipoperfusión, se recomienda una estrategia conservadora de administración de fluidos. En caso de shock, es esencial un soporte hemodinámico precoz con vasopresores y monitorización invasiva (vía arterial, vía central).
En cuanto a la oxigenoterapia, no se recomienda la ventilación no invasiva cuando hay COVID-19 debido al riesgo de aerosolizacion de partículas y la alta tasa de fallo. Dada la importancia de inicio de la ventilación invasiva precoz en esta entidad, en pacientes con edema agudo de pulmón y alta sospecha de COVID-19, no se debe demorar el inicio de la ventilación mecánica invasiva. La oxigenoterapia nasal de alto flujo también se desaconseja por la dispersión que produce, salvo que se cuente con una habitación de presión negativa, con estrecho límite para decidir la intubación. La secuencia escalonada aconsejada en pacientes con COVID-19 es bigotera de O2 y por encima barbijo quirúrgico, si no mejora (Sat. <90%), máscara de alta concentración y por encima barbijo quirúrgico; si no mejora la oxigenación en un plazo de 1 h o clínicamente hay un mayor esfuerzo respiratorio, se debe optar por la intubación orotraqueal y la ventilación mecánica invasiva. La estrategia en ventilación mecánica se debe realizar según protocolo de ventilación protectora con esquema de sedoanalgesia por nomograma y adecuado a las funciones renal y hepática. La maniobra de intubación debe estar a cargo del operador más hábil presente, dado que, en estas circunstancias, es una maniobra que produce brusca y severa hipoxemia. La oxigenación por membrana extracorpórea puede ser necesaria ante el fracaso en conseguir una adecuada oxigenación, pese a la ventilación, o shock con fallo multiorgánico asociado.
Biomarcadores
La lesión por cardiomiocitos, cuantificada por las concentraciones de TnT/I cardíacas, y el estrés hemodinámico, cuantificado por las concentraciones del BNP y la porción N-terminal del pro-péptido natriurético tipo B (NT-proBNP) pueden ocurrir en pacientes con COVID-19 como con otras neumonías. El nivel de esos biomarcadores se correlaciona con la gravedad y la mortalidad por el cuadro.
Tanto las concentraciones de TnT/I, BNP y NT-proBNP deben interpretarse como variables cuantitativas. En pacientes hospitalizados con COVID-19, las elevaciones leves de TnT/I o BNP/NT-proBNP son, en general, el resultado de una enfermedad cardíaca preexistente o una lesión aguda/estrés relacionado con la COVID-19.
Si no hay angina de pecho típica, dolor
o cambios isquémicos en el electrocardiograma, los pacientes con elevaciones
leves (p. ej., <2-3 veces el límite superior normal) no requieren evaluación
o tratamiento para el infarto de miocardio tipo 1 (T1MI).
La medición de concentraciones de TnT/I cardíacas será de utilidad si el diagnóstico de T1MI se está considerando por motivos clínicos, o en una disfunción del VI de aparición reciente, tanto para el diagnóstico como el pronóstico (Figura 2). Los niveles de elevación de este biomarcador pueden orientar al diagnóstico.

Figura 2. Interpretación de las concentraciones de troponina de alta sensibilidad.
T1MI = infarto de miocardio tipo 1, HF = insuficiencia cardíaca, PE = embolia pulmonar, ARDS = síndrome de dificultad respiratoria aguda.
En el estudio del Seventh Hospital de la
ciudad de Wuhan, con 187 pacientes, aquellos con niveles séricos elevados de
TnT presentaron una tasa mayor de comorbilidades, que incluían HTA,
coronariopatía, miocardiopatía, diabetes, enfermedad pulmonar obstructiva
crónica e insuficiencia renal crónica.
También los marcadores inflamatorios, como proteína C reactiva y procalcitonina,
fueron significativamente más altos en los pacientes con niveles elevados de
TnT (p <0,001 para todas las determinaciones).
Por otro lado, los pacientes con niveles elevados de TnT tuvieron un nivel significativamente mayor de otros biomarcadores de lesión miocárdica, inclusive creatinfosfoquinasa y mioglobina, NT-proBNP.
Finalmente, la tasa de mortalidad fue marcadamente superior en los pacientes con niveles séricos altos de TnT comparados con aquellos con niveles normales de este marcador. Cabe destacar que se halló que la lesión cardíaca es un factor de riesgo independiente de mortalidad hospitalaria.
Otros factores predictivos de lesión miocárdica incluyen edad avanzada, comorbilidades y altos niveles de proteína C reactiva.
Miocarditis asociada a la COVID-19
Se postula un esquema/una hipótesis de
lesión cardíaca generada por la COVID-19, en la cual existirían cuatro formas
de daño: 1) daño mediado por ECA2, 2) lesión miocárdica inducida por
hipoxia, 3) daño microvascular cardíaco, 4) síndrome de respuesta inflamatoria sistémica.
La miocarditis
se presentan con dos patrones: lesión y disfunción miocárdica aguda o lesión
miocárdica que exacerba la gravedad de la patología previa.
El 7% de 68 muertes de una serie de 150 pacientes con COVID-19 se atribuyó a miocarditis con insuficiencia circulatoria (shock cardiogénico). Las muertes o casos más graves estuvieron relacionados con una mayor carga viral y el hallazgo de infiltrados inflamatorios mononucleares en el tejido miocárdico.
Aquellos pacientes con SDRA debido a la COVID19, acompañado de hipoxemia severa, poseen una alta probabilidad de presentar una lesión miocárdica aguda, la cual incluye aumento de Tn >99 percentil del límite superior de referencia, cambios en el electrocardiograma y anormalidades ecocardiográficas.
La miocarditis se asocia a enfermedad más severa, mayor requerimiento de asistencia respiratoria mecánica y peor pronóstico. Debe considerarse como causa precipitante de shock cardiogénico.
Según los reportes de casos, existe una forma de presentación de miocarditis fulminante que clínicamente se manifiesta como IC aguda y está asociada a alta mortalidad (40-70% según la serie). De acuerdo con publicaciones en China, la tasa de mortalidad se ve reducida por un tratamiento precoz y agresivo que implica el uso de esteroides e inmunoglobulinas por vía intravenosa y soporte mecánico de apoyo (asistencia respiratoria mecánica, soporte ventricular, ya sea balón intraórtico de contrapulsación, Impella® u oxigenación por membrana extracorpórea).
Ante el ingreso en la UCI de un paciente con probable diagnóstico de COVID-19, asociada a IC nueva, sospechar miocarditis, determinar Tn, realizar un electrocardiograma y una ecocardiografía. La detección de arritmias ventriculares malignas y la elevación de Tn deben incrementar la sospecha de miocarditis.
Shock cardiogénico
En pacientes con COVID-19 graves, riesgo de shock cardiogénico (como aquellos con IAM extenso, IC aguda descompensada) y sepsis, se debe sospechar una etiología mixta del shock: shock séptico más cardiogénico.
En casos seleccionados, tales como pacientes con razones poco claras de deterioro hemodinámico, el monitoreo a través de un catéter de arteria pulmonar puede proporcionar información útil, pero siempre es una decisión que debe ser meditada, dado que estamos ante un paciente con dificultad pulmonar severa, alta presión intrapulmonar, alta PEEP, lo que hace que la medición de la presión enclavada pulmonar pueda no ser verdadera. Un diagnóstico temprano, preciso y rápido es esencial.
La duración media entre el inicio de los síntomas y el ingreso en la UCI de pacientes críticos con COVID-19 ha sido entre 9 y 10 días, lo que sugiere un deterioro respiratorio gradual en la mayoría de los casos. Respecto al tratamiento, no difiere de lo habitual.
Recientemente la Society of Cardiovascular Angiography and Interventions (SCAI) ha propuesto un esquema de clasificación para el diagnóstico de shock cardiogénico, que se resume en la Figura 3 (adaptada).
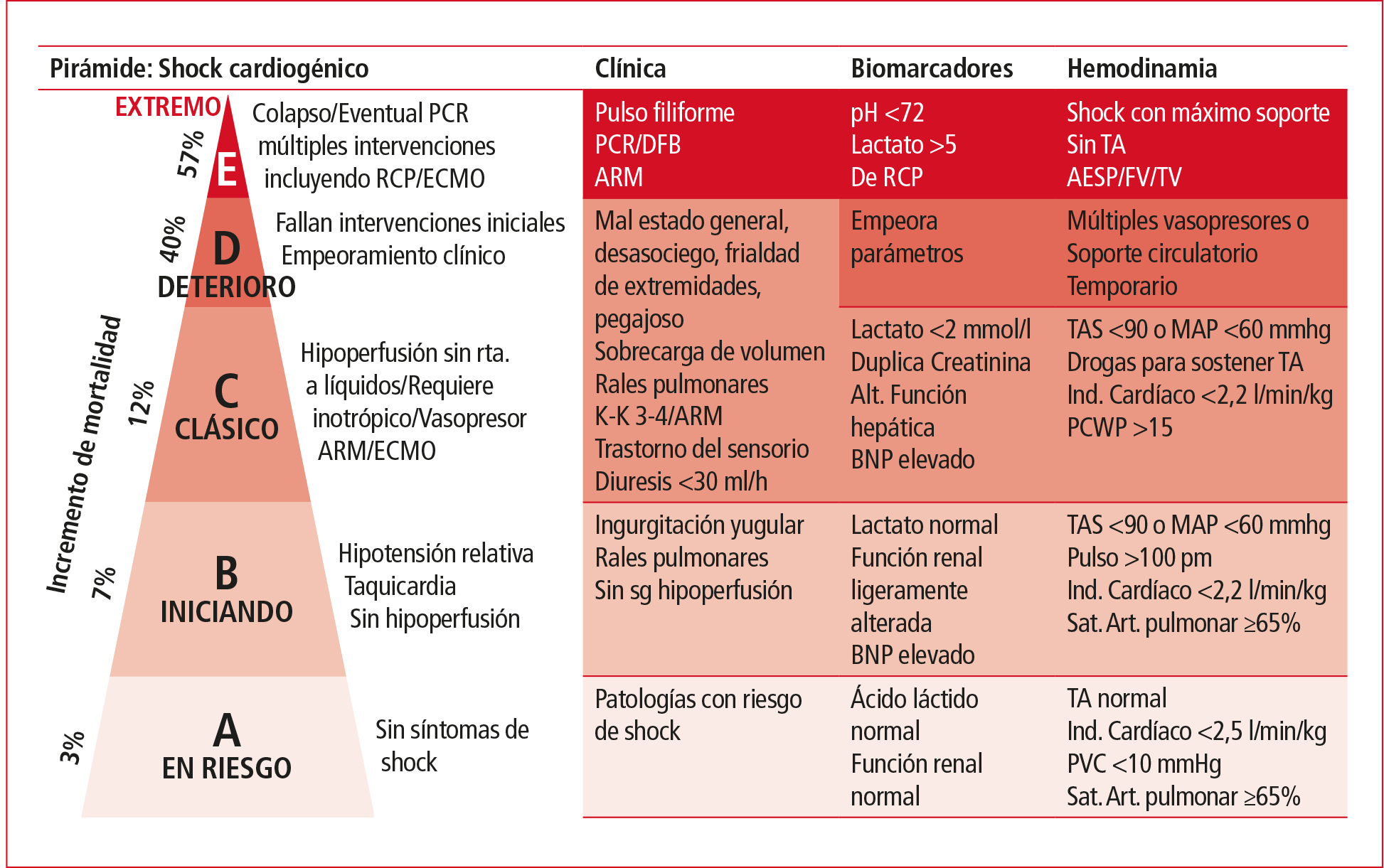
Figura 3. Clasificación para el diagnóstico de shock cardiogénico.
En caso de sospechar shock mixto, y teniendo en cuenta que no se recomienda ventilación no invasiva, es prioritario iniciar la asistencia respiratoria mecánica. Por otro lado, se debe agregar hidrocortisona 50 mg, cada 6 h, por shock séptico (considerar que el paciente puede estar recibiendo dexametasona en el momento del deterioro, por lo que será necesario rotar). Otras consideraciones terapéuticas son la superioridad de la noradrenalina sobre la dopamina, asociada a dobutamina y el tratamiento antitrombótico adecuado.
Conclusión
La COVID-19 se ha asociado con múltiples complicaciones cardiovasculares directas e indirectas, generando una mayor morbimortalidad. Aquellos pacientes con antecedentes de ECV y que contraen la COVID-19 tienen peor evolución.
Puntos clave
= En la situación de pandemia actual, ante un paciente con IC crónica y aumento de su disnea habitual, se hace necesario descartar la COVID-19 como causa de la descompensación.
= Ante el ingreso en la UCI de un paciente con probable diagnóstico de COVID-19, con IC nueva, sospechar miocarditis, determinar Tn y realizar un electrocardiograma y una ecocardiografía.
= La lesión por cardiomiocitos, cuantificada por las concentraciones de TnT/I cardíaca, y el estrés hemodinámico, cuantificado por las concentraciones de BNP y NT-proBNP pueden ocurrir en pacientes con COVID-19 como con otras neumonías. El nivel de esos biomarcadores se correlaciona con la gravedad y la mortalidad por el cuadro.
= En pacientes con COVID-19 graves, riesgo de shock cardiogénico (como aquellos con IAM extenso, IC aguda descompensada) y sepsis, se debe sospechar una etiología mixta del shock: shock séptico más cardiogénico.
= La presencia de ECV implica un mayor riesgo de morbilidad y mortalidad en el contexto de la COVID-19.
Bibliografía
1. Masataka Nishiga, Dao Wen Wang, Yaling Han, et al. COVID-19 and cardiovascular disease: from basic mechanisms to clinical perspectives. Nat Rev Cardiol 2020; 17(9): 543-558. https://doi.org/10.1038/s41569-020-0413-9
2.
Implicaciones de la pandemia por COVID-19 para
el paciente con insuficiencia cardiaca, trasplante cardiaco y asistencia
ventricular. Recomendaciones de la Asociación de Insuficiencia
Cardiaca de la Sociedad Española de Cardiología.
REC CardioClinics 2020;55 (2)
94-102. https://doi.org/10.1016/j.rccl.2020.03.007
3. The European Society for Cardiology. ESC Guidance for the Diagnosis and Management of CV Disease during the COVID-19 Pandemic. Disponible en: https://www.escardio.org/Education/COVID-19-and-Cardiology/ESC- COVID-19-Guidance. (Última actualización: 10 de junio 2020)
4. Thiele H, Magnus Ohman E, de Waha-Thiele S, et al. Management of cardiogenic shock complicating myocardial infarction: an update 2019. Eur Heart J 2019; 40: 2671-2683. https://doi.org/10.1093/eurheartj/ehz363
5. Soporte no invasivo en la falla respiratoria aguda hipoxémica asociada a infección por nCoV-19. Comité de Neumonología Crítica. Capítulo de Kinesiología Intensivista. 2020
8. Hipertensión arterial y tratamiento de los pacientes infectados por SARS-CoV-2
Desde que se conoció que el SARS-CoV-2 emplea el receptor de la ECA2 como una de las principales vías de entrada en el interior de la célula, y que esta enzima aumenta en los pacientes tratados con IECA o ARA2, existe una preocupación importante por saber si la presencia de HTA o el tratamiento contra la HTA son situaciones que podrían causar una alteración en la expresión de ECA2, y podrían influir en la mortalidad de los pacientes con COVID-19. En los primeros momentos de la pandemia, se publicaron algunos estudios observacionales que plantearon la posibilidad de que el tratamiento con IECA o ARA se asociaran a un aumento de la mortalidad con la infección viral. Esta alerta aparentemente tenía sentido, ya que el virus emplea el receptor de la ECA2 como puerta de entrada a las células y estos fármacos manipulan la expresión y la disponibilidad del receptor. Inmediatamente surgió la duda de si debíamos retirar estos tratamientos en los pacientes que los estaban tomando para “protegerlos” de una evolución desfavorable en una posible infección. Sin embargo, las sociedades científicas reaccionaron de forma ágil para explicar que estos datos obtenidos en pacientes con COVID-19 eran muy preliminares y que no eran suficientes para contrarrestar todo el peso de la evidencia acumulada sobre el efecto beneficioso del bloqueo del eje renina-angiotensina-aldosterona en todo tipo de problemas cardiovasculares, por lo que recomendaban mantener el tratamiento con IECA o ARA en los pacientes que los necesitaran según las guías de práctica clínica. En Wuhan, se llevó a cabo un estudio observacional retrospectivo de todos los pacientes ingresados por COVID-19 entre el 5 de febrero y el 15 de marzo de 2020, en el Hospital Huo Shen Shan, uno de los hospitales dedicados al tratamiento de la COVID-19 durante el estallido epidémico de la enfermedad en la ciudad china de Wuhan.1 Recogieron de las historias clínicas los datos relacionados con el diagnóstico de HTA y los tratamientos recibidos antes de la infección y los correlacionaron con la mortalidad por COVID-19 durante el ingreso. El 29,5% (850) de los 2877 pacientes hospitalizados tenía antecedente de HTA. Tras hacer el ajuste estadístico para descartar el efecto de posibles factores de confusión, los pacientes con HTA tuvieron un riesgo relativo dos veces mayor de fallecer que los pacientes sin HTA (4,0% vs. 1,1%, razón de riesgo [HR] ajustada 2,12; IC95% 1,17-3,82; p = 0,013). Los pacientes con HTA, pero sin tratamiento antihipertensivo (n = 140) tuvieron un riesgo significativamente mayor de muerte que los pacientes que sí recibían tratamiento antihipertensivo (n = 730) (7,9% vs. 3,2%, HR ajustado 2,17; IC95% 1,03-4,57; p = 0,041). Las tasas de mortalidad fueron similares entre los pacientes que tomaban inhibidores del sistema renina-angiotensina-aldosterona y los que tomaban otro tipo de fármacos. Sin embargo, en un metanálisis que realizaron los propios autores combinando sus datos con los de otros estudios previos, comprobaron que los pacientes que recibían algún inhibidor del sistema renina-angiotensina-aldosterona antes de la infección tenían una tendencia a un menor riesgo de muerte (riesgo relativo 0,65; IC95% 0,45-0,94; p = 0,02). El estudio sugiere que tanto la HTA como la ausencia de medicación para tratarla podrían ser factores relacionados con una mayor mortalidad por SARS-COV-2. Este estudio está realizado en una cohorte muy amplia de casi 3000 pacientes y tiene una metodología más cuidadosa que trata de controlar los posibles factores de confusión. Los datos ofrecen conclusiones importantes:
Los pacientes con antecedente de HTA tuvieron un riesgo doble de fallecer durante el ingreso por la infección por coronavirus, especialmente si no estaban recibiendo tratamiento antihipertensivo.
Los pacientes que tomaban inhibidores del sistema renina-angiotensina-aldosterona no estuvieron expuestos a un mayor riesgo de muerte.
De hecho, nuevos datos obtenidos en
modelos animales sugieren que, en estos pacientes, en realidad, existiría una
sobreexpresión del receptor de la ECA2, por lo que el bloqueo del receptor con
un inhibidor del sistema renina-angiotensina-aldosterona podría ser incluso
beneficioso.2
Diferentes estudios han dejado claro
que no aumentan las complicaciones en los pacientes tratados con IECA o
ARA2. Incluso se postula que estos medicamentos podrían ser más beneficiosos
que perjudiciales.3
Este artículo de Wang y Wang revisa la
correlación entre la ECA2 y los factores de riesgo severos de COVID-19 y los
posibles mecanismos.2
La ECA2 es un componente crucial del SRA. El clásico eje regulador RAS ACE Ang II AT1R y el eje regulador contrario ACE2 Ang 1 MasR desempeñan un papel esencial en el mantenimiento de la homeostasis en los seres humanos. El ACE2 se distribuye ampliamente en el corazón, los riñones, los pulmones y los testículos, antagoniza la activación del SRA clásico y protege contra el daño orgánico, y contra la HTA, la diabetes y la ECV. Como el SARS-CoV-1, el SARS-CoV-2 también utiliza el receptor de la ECA2 para invadir las células epiteliales alveolares humanas. El SDRA es una enfermedad clínica de alta mortalidad, y el ACE2 tiene un efecto protector sobre este tipo de lesión pulmonar aguda. Las investigaciones actuales muestran que el mal pronóstico de los pacientes con SARS-CoV-2 está relacionado con factores, como el sexo (masculino), la edad (>60 años), las enfermedades subyacentes (HTA, diabetes y ECV), el SDRA secundario y otros factores relevantes. Debido a estos efectos protectores del ACE2 sobre las enfermedades crónicas subyacentes y el SDRA, el desarrollo de vacunas basadas en la proteína de espiga y medicamentos que mejoran la actividad del ACE2 puede convertirse en uno de los enfoques más prometedores para el tratamiento del SARS-CoV-2 en el futuro. Como ocurre con todos los estudios observacionales en pacientes con SARS-CoV-2, los resultados se deben valorar con cautela. Quién sabe si los resultados nos dirán que no solo no hay que retirar los inhibidores del sistema renina-angiotensina-aldosterona en estos pacientes, sino que tenemos que considerarlos como parte del tratamiento específico del compromiso cardiovascular por el coronavirus. De hecho, ya hay ensayos clínicos en marcha para demostrar si realmente estos medicamentos pueden ser beneficiosos durante la enfermedad por SARS-CoV-2. De momento, se desconocen los resultados, pero sí hay datos confirmatorios de que estos fármacos son seguros y de que no se deben suspender en los pacientes infectados por el nuevo coronavirus.
Un estudio reciente investigó el uso continuo y discontinuo de IECA o ARA II durante la hospitalización de 614 pacientes hipertensos confirmados por laboratorio con SARS- CoV-2.3 Se analizaron los datos demográficos, las comorbilidades, los signos vitales, los resultados de laboratorio y el uso de IECA/ARA II. Las tasas de mortalidad (22% vs. 17%, p >0,05) y de ingreso en la UCI (26% vs. 12%, p >0,05) no fueron significativamente diferentes entre los grupos que sin IECA/ARA II y con IECA/ARA II. Sin embargo, los pacientes que continuaron con IECA o ARA II en el hospital tuvieron una tasa de ingreso en la UCI marcadamente más baja (12% vs. 26%, p = 0,001, OR = 0,347 [IC95% 0,187-0,643]) y una tasa de mortalidad (6% vs. 28%, p = 0,001, OR = 0, 215 [IC95% 0,101-0,455]) en comparación con los pacientes que suspendieron los IECA o ARA II. Estos hallazgos indican que mantener el tratamiento con IECA o ARA II en pacientes hipertensos con SARS-CoV-2 produce mejores resultados clínicos. De acuerdo con estos datos iniciales y a la espera de la aparición de nuevas publicaciones, es factible considerar que los pacientes con emergencias o urgencias hipertensivas deben ser tratados como lo hacemos habitualmente, al margen de que sean positivos o negativos para SARS-CoV-2, dado que su tratamiento precoz mejora la evolución. De todas formas, deben cumplirse todos los cuidados relativos a la protección del paciente y del personal de salud involucrado en el tratamiento en cuanto a aislamiento y elementos de protección personal.
Bibliografía
1.
Chao
Gao, Yue Cai, Kan Zhang, et al. Association of hypertension and antihypertensive
treatment with COVID-19 mortality: a retrospective observational study. Eur Heart J 2020; 41(22): 2058-2066.
https://doi.org/10.1093/eurheartj/ehaa433
2.
Cheng
H, Wang Y, Wang G‐QJ, et al. Organ-protective effect
of angiotensin‐converting enzyme 2 and its effect
on the prognosis of COVID‐19. Med Virol 2020; 92: 726-730. https://doi.org/10.1002/jmv.25785
3.
Lam
KW, Chow KW, Vo J, et al. Continued in-hospital ACE inhibitor and ARB use in
hypertensive COVID-19 patients is associated with positive clinical outcomes. J
Infect Dis 2020; 222(8): 1256-1264. https://doi.org/10.1093/infdis/jiaa44
9. Manejo de las arritmias en pacientes con
COVID-191-6
La COVID-19 es capaz de producir no solo una neumonía viral, sino también varias complicaciones mayores en el sistema cardiovascular. Si bien la neumonía parece ser la manifestación grave más frecuente de la infección, la COVID-19 puede presentarse como SCA o tromboembolismo venoso, miocarditis e IC descompensada. Se ha reportado un gran espectro de arritmias durante la infección por SARS-CoV-2, muchas producidas como efectos adversos de medicaciones para intentar tratar la infección o sus complicaciones. Podemos afirmar que un grupo pequeño de pacientes con COVID-19 desarrollará manifestaciones cardiovasculares que podrían llamarse “síndrome cardiovascular agudo COVID-19.1 Este cuadro se presenta como lesión cardíaca aguda, con miocardiopatía, arritmias ventriculares, cuadros de inestabilidad hemodinámica. El daño miocárdico se expresa de forma variada, con aumento de marcadores cardíacos especialmente Tn-AS, con cambios en el electrocardiograma y deterioro de la función ventricular, originando un variado cuadro clínico, que va desde arritmias (fibrilación auricular [FA], taquicardia ventricular [TV] y fibrilación ventricular [FV]), SCA atípico, miocarditis fulminante, IC, embolia pulmonar y coagulopatía intravascular diseminada y muerte súbita. La evaluación temprana y la monitorización continua del daño miocárdico (TnI y NT-proBNP) y de la coagulación DD en los pacientes internados pueden identificar a pacientes con lesión cardíaca y predecir complicaciones de la COVID-19. Las arritmias estarían explicadas en la fase de enfermedad grave por hallazgos frecuentes de hipoxia y las anormalidades electrolíticas, pero, en la actualidad, se desconoce el riesgo arrítmico relacionado con la COVID-19 en pacientes con enfermedad menos grave o aquellos que se recuperan de la fase aguda de la enfermedad grave. Se cree que el daño miocárdico podría representar un impulsor principal de riesgo arrítmico aumentado en estos pacientes. La lesión cardíaca de miocitos es reflejada por aumento de Tn, particularmente en aquellos con enfermedad grave. En consecuencia, se informó una mayor incidencia de TV/FV en pacientes con TnT elevada. Los mecanismos de afectación miocárdica aún están bajo investigación, probablemente incluyen infección viral directa, apoptosis inducida por hipoxia y tormentas relacionadas con las citocinas y daño celular. La evidencia demostró que, en pacientes de la UCI, a pesar de la alta frecuencia de arritmias (~50% de los casos), solo la mitad tenía una lesión cardíaca aguda (con mediana de los niveles de TnI que caen en el rango normal), esto sugiere que factores distintos del daño miocárdico también están involucrados en el incremento del riesgo de arritmias en pacientes con COVID-19.
Habitualmente no utilizamos monitoreo cardíaco continuo si no hay arritmias documentadas, sospecha de isquemia miocárdica o indicaciones estándar para este cuadro; sin embargo, cada vez más, las instituciones utilizan monitoreo continuo junto con lecturas automáticas de la presión arterial y oximetría de pulso para disminuir la exposición del personal y preservar los equipos de protección personal.
Si bien las arritmias se consideran una complicación frecuente y ocurren en la mayoría de los pacientes internados en la UCI, su tratamiento en el episodio agudo no debe ser significativamente diferente del que se instaura para pacientes sin COVID-19.
La creciente evidencia sugiere que la COVID-19 está cargada de mayor riesgo de eventos arrítmicos, con importantes implicaciones para la supervivencia. Se comunicó que las palpitaciones eran uno de los síntomas iniciales más comunes de la enfermedad (7,3%). En reportes de pacientes hospitalizados con COVID-19, las arritmias representaron la complicación principal (19,6%) después del SDRA, particularmente en aquellos en la UCI donde la prevalencia aumentó al 44,4%. Específicamente, se detectaron arritmias ventriculares malignas (TV/FV) en el 5,9% de los casos, incluso se han reportado arritmias auriculares y ventriculares asociadas durante la fase de recuperación de la enfermedad pulmonar.
Durante la pandemia, es importante diferenciar los procedimientos urgentes de los que pueden ser postergados para disminuir la exposición del personal y de los pacientes. La justificación para retrasar los procedimientos no urgentes o programados debería ser idealmente discutida con el paciente y documentada en la historia clínica.
Por el contrario, los procedimientos semiurgentes, urgentes o de emergencia incluyen aquellos en los que hay:
= Amenaza para la vida del paciente si el procedimiento no se realiza con urgencia.
= Amenaza de disfunción permanente de una extremidad o sistema de órganos.
= Riesgo de empeoramiento rápido de síntomas graves.
La arritmia más común en pacientes con COVID-19 es la taquicardia sinusal y las arritmias patológicas más frecuentes incluyen FA, aleteo auricular y TV monomorfa o polimorfa.
El tratamiento agudo de las arritmias no debe ser significativamente diferente del indicado para pacientes sin COVID-19; por lo tanto, deben evaluarse inmediatamente los síntomas, los signos, el nivel de conciencia y la estabilidad o inestabilidad hemodinámica en los diferentes escenarios.
Puntos clave
= Las arritmias son una complicación importante y ocurren, con más frecuencia, en pacientes internados en un área cerrada.
= Siempre que sea posible se recomienda el monitoreo y el seguimiento en forma monitoreo remoto reduciendo, al mínimo, la exposición del personal.
= El tratamiento agudo de las arritmias no debe ser significativamente diferente del de los pacientes sin COVID-19.
= Siempre se deben considerar las interacciones farmacológicas, incluidos los agentes antivirales, antiarrítmicos y anticoagulantes, antes de la administración.
= Solo deben realizarse procedimientos urgentes después de haber considerado otras opciones terapéuticas.
Taquicardia supraventricular
Teniendo en cuenta que los tratamientos definitivos, como la ablación por radiofrecuencia por taquiarritmias supraventriculares, deben ser postergados hasta finalizar la pandemia y que pueden producirse exacerbaciones durante el transcurso de la enfermedad, es esperable que se incrementen los eventos de taquicardia supraventricular, la cual debe ser tratada según las guías convencionales; por lo tanto, en pacientes estables y sin contraindicaciones, es válido administrar adenosina y resultan seguros los betabloqueantes o bloqueantes calcio en la terapia de mantenimiento. Siempre se debe evitar la bradicardia para no provocar un incremento del intervalo QT.
Fibrilación auricular
Se sabe que la incidencia de FA es alta en los pacientes críticos; es probable que la infección por SARS-CoV-2 la desencadene. La FA aguda se relaciona con un incremento de la mortalidad en pacientes críticos a corto y largo plazo, aumento de la tasa de recurrencia en el tiempo, riesgo tromboembólico y falla cardíaca. Hoy no hay evidencia que sostenga una diferencia entre pacientes con COVID-19 y sin COVID-19; por lo tanto, el tratamiento se basa en controlar la frecuencia cardíaca y el ritmo, y la profilaxis tromboembólica.
En caso de FA o aleteo auricular con inestabilidad hemodinámica, debe considerarse la cardioversión eléctrica con el riesgo que implica la maniobra de más equipo de salud y la eventual necesidad de protección de la vía aérea. Es preciso tener en cuenta el escenario donde se desarrolla la arritmia, considerando que sería poco probable que, en un paciente crítico con insuficiencia respiratoria y tal vez otros desencadenantes reversibles (como trastornos hidroelectrolíticos, cambios de la volemia, aumento del tono simpático o sobreinfección), el solo hecho de realizar cardioversión eléctrica pudiese darle un beneficio hemodinámico sostenible y al retorno del ritmo sinusal perdurable en el tiempo. Por lo tanto, en pacientes críticos, debe valorarse la posibilidad de cardioversión farmacológica con amiodarona. En el artículo publicado por Stadler, se postula a este clásico antiarrítmico como posible inhibidor de la entrada del SARS-CoV-2 en la célula.
Si el paciente presenta FA o aleteo auricular estable hemodinámicamente y recibe antivirales, se aconseja suspender los antiarrítmicos y controlar la frecuencia con betabloqueantes si están contraindicados los bloqueantes cálcicos con digoxina o sin ella, teniendo precaución con las contraindicaciones.
La anticoagulación en pacientes debe guiarse por el puntaje de la escala CHA2DS2-VASc.
Se recomienda el inicio precoz de la anticoagulación y evitar realizar un ETE por el alto riesgo de aerosoles.
Puntos clave
= Las arritmias son una complicación frecuente y su tratamiento no debe ser significativamente diferente del indicado para pacientes sin COVID-19.
= Siempre se debe considerar la corrección de las causas reversibles.
= En caso de taquicardia supraventricular paroxística aguda, está indicada la adenosina y el mantenimiento con betabloqueantes o bloqueantes cálcicos.
= En pacientes con FA/aleteo auricular sin inestabilidad hemodinámica, considerar el control de la respuesta ventricular y anticoagulación según el puntaje de la escala CHA2DS2-VaSC.
= Ante un paciente con FA/aleteo auricular con inestabilidad hemodinámica, realizar cardioversión eléctrica y considerar la administración de propafenona o amiodarona por vía intravenosa, para controlar el ritmo y la anticoagulación según el puntaje de la escala CHA2DS2-VaSC.
= Optimizar el medio interno (K >4 mEq/l y suplementos con magnesio) y los factores corregibles proarrítmicos (hipoxemia, hipotermia o acidosis).
= Considerar la ETT solo cuando hay inestabilidad hemodinámica y su acción tenga consecuencias terapéuticas.
Teniendo en cuenta que las infecciones virales se asocian con disfunción metabólica, inflamación del miocardio y activación del sistema simpático, todos factores predisponentes de arritmia, se debe ser especialmente cuidadoso en pacientes con síndromes hereditarios, como síndrome del QT largo, síndrome de Brugada, síndrome del QT corto y TV polimorfa catecolaminérgica. Según el defecto hereditario, los pacientes serán más susceptibles a los efectos proarrítmicos relacionados con la COVID-19, como fiebre, estrés, trastornos electrolíticos, hipotermia, isquemia miocárdica y uso de antivirales.
La prolongación severa del intervalo QTc en estas condiciones podría resultar similar al síndrome del QT largo congénito, en una arritmia ventricular polimorfa autolimitada o incluso la muerte súbita, según el cuadro de base y su asociación al riesgo de prolongación del intervalo QT o torsades de pointes.
La prolongación del intervalo QT adquirida suele ser reversibles tras la eliminación de la causa, ya sea la suspensión del medicamento o la corrección del trastorno que la ocasionó. Es importante destacar que no existe correlación entre la dosis o la concentración sanguínea de las drogas antiarrítmicas y la aparición de torsades de pointes.
En pacientes con arritmias ventriculares malignas debe seguirse el protocolo habitual para pacientes sin COVID-19.
Cabe recordar que, durante el soporte vital avanzado, los profesionales de la salud deben contar con su equipo de protección personal y, durante la asistencia, no se debe realizar ventilación para evitar aerosolización.
En pacientes con FV, se debe realizar desfibrilación asincrónica o cardioversión eléctrica en caso de TV con inestabilidad hemodinámica.
Se recomienda la cardioversión eléctrica, si un paciente tiene TV monomorfa sostenida y recibe agentes antivirales combinados que prolongan el intervalo QT, especialmente si está ventilado. En estos casos, es una opción administrar lidocaína o procainamida por vía intravenosa a pacientes hemodinámicamente estables.
Podría considerarse la amiodarona por vía intravenosa en pacientes con cardiopatía estructural conocida y función ventricular deteriorada.
El tratamiento de elección para la TV sostenida es la amiodarona; en caso de combinación con cloroquina o hidroxicloroquina o azitromicina puede considerarse una opción más segura que es la lidocaína principalmente si se sospecha isquemia miocárdica.
Es fundamental corregir todas las situaciones reversibles para prevenir torsades de pointes.
La terapéutica para esta TV polimorfa en pacientes estables consiste en suspender los fármacos que pueden prolongar el intervalo QT, optimizar el potasio (K >4,5 mEq/l), administrar magnesio por vía intravenosa y aumentar la frecuencia cardíaca, retirando los agentes bradicárdicos. Si es necesario, administrar isoproterenol por vía intravenosa o estimulación con marcapaso transcutáneo para aumentar la frecuencia cardíaca.
El régimen estándar para un adulto es 2 g de sulfato de magnesio. La velocidad de la infusión dependerá de la situación clínica, asociada a las otras medidas para aumentar la frecuencia cardíaca.
Los pacientes con torsades de pointes sostenida generalmente se vuelven hemodinámicamente inestables, gravemente sintomáticos o sin pulso, en estos casos, se debe realizar cardioversión.
No está indicado el tratamiento inicial con antiarrítmicos en pacientes con torsades de pointes con inestabilidad hemodinámica, excepto el magnesio.
El isoproterenol está contraindicado si el paciente tiene síndrome del QT largo congénito.
Puntos clave
= La amiodarona es el agente de elección en pacientes críticos con inestabilidad hemodinámica debido a TV/FV recurrente, pero debe evitarse en asociación con hidroxicloroquina y azitromicina.
= Optimización y corrección precoces de las alteraciones electrolíticas, la disfunción renal y la bradicardia en la prevención de la TV de torsades de pointes.
= El tratamiento de la torsades de pointes consiste en suspender todos los fármacos que prolongan el intervalo QT, dirigidos a K+ >4,5 mEq/l, magnesio por vía intravenosa y aumento de la frecuencia cardíaca (retirar agentes bradicárdicos y si es necesario isoproterenol por vía intravenosa o estimulación temporal).
= En pacientes con FA/aleteo auricular, se deben revaluar las opciones terapéuticas de frecuencia, el control del ritmo y la anticoagulación a largo plazo según el puntaje de la escala CHA2DS2-VASc.
= Ante un paciente con arritmias ventriculares malignas no relacionadas con la prolongación del intervalo QT, se debería considerar la necesidad de realizar una ecocardiografía para evaluar la función ventricular y el miocardio.
Bibliografía
1. Hendren NS, Drazner MH, Bozkurt B, Cooper LT Jr. Acute COVID-19 cardiovascular syndrome. Circulation 2020; 141: 1903-1914. https://doi.org/10.1161/CIRCULATIONAHA.120.047349
2. Fitz Maurice M, DanteBarja L, Fórmica Mazraani N, et al. Taquicardias ventriculares polimórficas en el escenario de la pandemia por COVID-19. Hidroxicloroquina, Azitromicina y prolongación QTc. Rev Electro y Arritmias 2020; 12: 12-23. Disponible en: https://www.researchgate.net/publication/343096892_Taquicardias_ventriculares_polimorfcas_en_el_escenario_de_la_pandemia_por_COVID-19_Hidroxicloroquina_Azitromicina_y_prolongacion_de_QTc
3. Guzik TJ, Mohiddin SA, Dimarco A, et al. COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc Res 2020; 116(10): 1666-1687. https://doi.org/10.1093/cvr/cvaa106
4.
Driggin
E, Madhavan MV, Bikdeli B, et al. Cardiovascular considerations for patients,
health care workers, and health systems during the coronavirus disease 2019
(COVID-19) pandemic. J Am Coll Cardiol 2020; 75(18): 2352-2371. https://doi.org
/10.1016/j.jacc.2020.03.031
5.
Mehra
MR, Desai SS, Ruschitzka F, Patel AN. Hydroxychloroquine or chloroquine with or
without a macrolide for treatment of COVID-19: a multinational registry
analysis. Lancet 2020; S0140-6736(20)31180-6. https://doi.org/10.1016/S0140-6736(20)31180-6
6. Lakkireddy DR, Chung MK, Russo AM, et al. Guidance for Cardiac Electrophysiology During the COVID-19 Pandemic from the Heart Rhythm Society COVID-19 Task Force; Electrophysiology Section of the American College of Cardiology; and the Electrocardiography and Arrhythmias Committee of the Council on Clinical Cardiology, American Heart Association. Circulation. 2020; 141: e823-e831. https://doi.org/10.1161/CIRCULATIONAHA.120.047063
10. Síndrome coronario agudo
La prevalencia de los SCA está clara y establecida en la población occidental. Hace muchos años, se han determinado los factores de riesgo y su tratamiento está incluido en las guías de manejo clínico de las distintas sociedades científicas. Así mismo, hay situaciones patológicas de gran inflamación que pueden predisponer a su aparición. Cabe destacar que, al igual que con otras enfermedades infecciosas, como el SARS y la influenza, la COVID-19 puede ser el disparador de los SCA.1 En los primeros estudios de China, una pequeña proporción de pacientes con COVID-19 se presentó con dolor en el pecho al ingresar en el hospital, pero las características del dolor torácico no se describieron.2 En una serie de casos de Nueva York que involucran a 18 pacientes con COVID-19 y elevación del segmento ST, indicativo de un posible IAM, cinco de los seis pacientes con infarto requirieron intervención coronaria percutánea.1 En Italia, en una serie de 28 pacientes con COVID-19 e infarto con elevación del segmento ST, la evaluación por angiografía mostró que 17 tenían evidencia de una lesión culpable que requirió revascularización.3 Asimismo, el IAM con elevación del segmento ST fue la primera manifestación clínica de la COVID-19 en 24 de estos 28 pacientes que aún no habían recibido el resultado positivo de la PCR para COVID-19 en el momento del cateterismo. Estas observaciones sugieren que la COVID-19 puede causar SCA incluso si no hay una respuesta inflamatoria sistémica sustancial. Sin embargo, la incidencia de SCA en los pacientes con COVID-19 aún se desconoce. Los mecanismos subyacentes al SCA inducido por COVID-19 pueden implicar rotura de la placa, espasmo coronario o microtrombos debido a inflamación sistémica o la tormenta de citocinas.4 Por ejemplo, los macrófagos activados secretan colagenasas que degradan el colágeno, un componente importante del capuchón fibroso en las placas ateroscleróticas, y pueden conducir a la rotura de la placa.4 Los macrófagos activados también secretan factor tisular, un potente procoagulante que desencadena la formación de trombos cuando la placa se rompe.4 El daño endotelial o la lesión vascular directa causados por la infección por SARS-CoV-2 también podrían aumentar el riesgo de formación de trombos con el consiguiente SCA.
En relación con el tratamiento y el abordaje de este tipo de eventos, es importante destacar que las diferentes sociedades plantearon recomendaciones sobre el tema.
Con respecto a la terapia de reperfusión, se ha demostrado consistentemente que la angioplastia primaria reduce la mortalidad, el reinfarto, el accidente cerebrovascular, las complicaciones mecánicas y evite eventos hemorrágicos al compararla con los agentes trombolíticos, como el tratamiento de reperfusión en pacientes con SCA con elevación del segmento ST.
A su vez, se establece que, ante la posibilidad que se demore la angioplastia, el tratamiento entre ambas opciones es similar,5 se debe optar por el que se disponga con más urgencia dentro de los tiempos establecidos.
En los distintos países, las sociedades científicas han desarrollado protocolos con recomendaciones sobre la elección del tratamiento de reperfusión durante el brote de COVID-19, con consejos que resultaron opuestos, según las condiciones en cada país. Por ejemplo, el Pekín Unión Medical College Hospital de China recomendó la trombólisis como primera opción terapéutica y solo recomendaba la intervención percutánea coronaria después de descartar COVID-19 incluso en caso de contraindicación trombolítica.6
Por el contrario, la Asociación de Cardiología Intervencionista de España recomendó la angioplastia primaria como tratamiento de primera elección, y considerar la trombólisis solo si el paciente está en un centro sin capacidad de realizar una angioplastia primaria y fuera necesario su traslado, y este retrasara el tratamiento por más de 120 min, o si el paciente fuera positivo para COVID-19 con mal estado clínico que dificultara el traslado o positivo para COVID19 con bajo riesgo hemorrágico y síntomas de menos de 3 h de duración.7
La angioplastia primaria también permite el alta temprana sin más exámenes invasivos en un porcentaje de pacientes, esto simplifica el manejo de estos pacientes, limita la capacidad de exposición al ambiente hospitalario y reduce la ocupación hospitalaria.
Bibliografía
1.
Bangalore
S, Sharma A, Slotwiner A, et al. ST-segment elevation in patients with COVID-19
– a case series. N Engl J Med 2020;
382(25): 2478-2480. https://doi.org/10.1056/NEJMc2009020
2. Huang C, Wang Y, Li Xingwang, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395(10223): 497-506. https://doi.org/10.1016/S0140-6736(20)30183-5
3.
Stefanini
GG, Montorfano M, Trabattoni D, et al. ST-elevation myocardial infarction in
patients with COVID-19: clinical and angiographic outcomes. Circulation 2020;
141(25): 2113-2116. https://doi.org/10.1161/CIRCULATIONAHA.120.047525
4.
Libby
P, Tabas I, Fredman G, Fisher EA. Inflammation and its resolution as
determinants of acute coronary syndromes. Circ Res 2014; 114(12): 1867-1879.
https://doi.org/10.1161/CIRCRESAHA.114.302699
5.
Ibañez B, James S, Agewall S, et al. 2017 ESC
Guidelines for the management of acute myocardial infarction in patients
presenting with ST-segment elevation. Eur Heart J 2018; 39: 119-177. https://doi.org/10.1093/eurheartj/ehx393
6. Jing ZC, Zhu HD, Yan XW, et al. Recommendations from the Pekin Union Medical College Hospital for the management of acute myocardial infarction during the COVID-19 outbreak. Eur Heart J 2020; 41(19): 1791-1794. https://doi.org/10.1093/eurheartj/ehaa258
7. Romaguera R, Cruz-Gonzalez I, Jurado-Roman A, et al. Considerations on the invasive management of ischemic and structural heart disease during the COVID-19 coronavirus outbreak. Consensus statement of the Interventional Cardiology Association and the 7 Ischemic Heart Disease and Acute Cardiac Care Association of the Spanish Society of Cardiology. REC Interv Cardiol 2020; 2(2): 112-117. https://doi.org/10.24875/RECICE.M20000121
11. Fenómenos tromboembólicos
en pacientes con COVID-191-12
En diciembre de 2019, se reportan los primeros casos de un nuevo tipo de neumonía, esto sucede en la provincia de Hubei, China. En breve, se determinó que nos enfrentábamos a una compleja patología causada por un virus de la familia Coronaviridae, que rápidamente se extiende al resto del continente y fuera de él por su alta contagiosidad.
Aproximadamente
el 5-10% de los pacientes con COVID-19 requiere ingreso en la UCI y ventilación
mecánica debido a la progresión a una neumonía grave con severa hipoxemia, que
incluye enfermedad parenquimatosa, daño alveolar masivo y SDRA con sombreado
radiológico parcheado y en vidrio esmerilado.
Con el correr de los días, comenzó a conocerse que estos pacientes presentaban inflamación excesiva asociada a manifestaciones trombóticas frecuentes, como embolias pulmonares (20-30% de los casos), trombosis venosa profunda, trombosis relacionada con el catéter y trombosis arterial, como ictus isquémicos. Además, también se ha informado de trombosis microvascular, acrosíndrome y síndrome de extravasación capilar que afectan pulmones, riñones y corazón, potencialmente complicados por falla multiorgánica.
Intentaremos revisar brevemente los mecanismos complejos que determinan la hemostasia observados en pacientes con COVID-19 en estadio moderada o grave.
El SARS-CoV-2 entra en las células del huésped uniéndose a la ECA2, altamente expresada en células epiteliales alveolares pulmonares, miocitos cardíacos, endotelio vascular y algunas otras células.
La agresión del pulmón por el SARS-CoV-2 provoca una rotura de las células epiteliales y endoteliales junto con un infiltrado de células inflamatorias alveolares que conduce a niveles elevados de citocinas proinflamatorias de respuesta temprana (IL-1b, IL-6 y factor de necrosis tisular a).
En pacientes con COVID-19 que evolucionan de estadios leves a moderados-graves, esta respuesta inmune es excesiva y, por lo tanto, se describe como una “tormenta de citocinas” generalizada que precipita la aparición de un síndrome de respuesta inflamatoria sistémica, sepsis, shock séptico.
Si bien estos trastornos pueden ser secundarios al efecto propio de la invasión viral celular, no puede descartarse el rol de la hipoxia combinada con la trombo-inmuno-inflamación desencadenada apoyada por la endoteliopatía y el estado de hipercoagulabilidad de la enfermedad.
En primer término, la hipoxia asociada a COVID-19 produce vasoconstricción y reducción del flujo sanguíneo que contribuyen a la disfunción endotelial. En segundo lugar, la hipoxia también puede cambiar el fenotipo basal antitrombótico antinflamatorio y fibrinolítico de la barrera endotelial.
La lesión endotelial determina una endoteliopatía que da como resultado la liberación de multímeros del factor de von Willebrand (FvW) extragrandes implicados en la hemostasia primaria y la sobreexpresión del factor tisular. Los multímeros del FvW extragrandes actúan como un puente entre las plaquetas activadas, la célula endotelial dañada y el subendotelio.
Los monocitos, los neutrófilos, las plaquetas y las micropartículas circulantes se unen al endotelio activado y generan localmente trampas extracelulares de factor tisular y neutrófilos para la activación de la coagulación a través de la vía factor tisular/FVIIa generándose cantidades excesivas de trombina con un estado de hipercoagulabilidad posterior.
El estado hipercoagulable se ve reforzado por un desequilibrio entre el aumento de factores procoagulantes, factor V, factor VIII y fibrinógeno, y los inhibidores naturales de la coagulación potencialmente disminuidos o normales, es decir, antitrombina, proteínas C y S.
El bajo flujo sanguíneo (inducido por vasoconstricción y estasis) junto con la endoteliopatía e hipercoagulabilidad (tríada de Virchow) respaldaría el mayor riesgo de trombosis en pacientes con COVID-19 en sus formas moderadas o graves.
La fisiopatología de la microtrombosis sistémica relacionada con COVID-19 (en última instancia complicada por falla multiorgánica) puede ser específica y diferente de la CID: de hecho, a diferencia de la coagulopatía inducida por sepsis, NO SE OBSERVA el consumo de plaquetas y el FIBRINÓGENO suele estar elevado, sin descenso de los factores de coagulación; las complicaciones hemorrágicas son poco frecuentes en los pacientes con COVID-19 grave, lo que sugiere que la CID no es la alteración de la hemostasia característica de la COVID-19, sino un estado hipercoagulable al que se le asocia, además, una supresión de la fibrinólisis.
La microtrombosis pulmonar es el sustrato fisiopatológico del SDRA relacionado con la COVID-19. Los pacientes críticos con COVID-19 presentan una alteración de los alvéolos y la microvasculatura pulmonar asociada con cadenas ricas en plaquetas/FvW extragrandes ancladas al endotelio lesionado y depósito de fibrina intralveolar que forma microtrombos localizados/diseminados.
Es posible que estos últimos se deban a una alteración local del equilibrio fino entre la coagulación del huésped y la vía fibrinolítica dentro de los espacios alveolares; también es probable que este proceso de vasoclusión microtrombótica se incremente significativamente por la vasoconstricción y el flujo sanguíneo reducido inducido por la hipoxemia profunda en los capilares pulmonares.
¿Qué pruebas de hemostasia serían útiles para evaluar a estos pacientes?
De acuerdo con la experiencia que venimos adquiriendo durante la pandemia, el panel mínimo de pruebas de hemostasia debe incluir tiempo de protrombina, fibrinógeno, recuento de plaquetas, tiempo parcial de tromboplastina activada y dímero D.
Se ha identificado que el aumento de los niveles de dímero D es un factor predictivo del desarrollo del SDRA, la necesidad de ingreso en la UCI y de muerte. Los niveles elevados de fibrinógeno y dímero D reflejan el estado de hipercoagulabilidad e inflamación, probablemente el uso de pruebas viscoelásticas en sangre total podría ser útil tanto para explorar mejor la hipercoagulabilidad como para predecir eventos trombóticos en este contexto, bastaría con realizar solo una prueba de EXTEM, vía extrínseca, sin que sea necesario un panel completo.
Rol de la heparina en la COVID- 19
En la práctica clínica, la heparina no fraccionada y los derivados de heparina siguen siendo las terapias antitrombóticas predominantes administradas por vía parenteral.
En este momento de la pandemia, agosto 2020, no se discute que estar hospitalizado por COVID-19 requiere profilaxis antitrombótica con heparina no fraccionada o heparina de bajo peso molecular con los esquemas de dosis habituales, 5000 UI cada 12 h, en el primer caso y 40 o 60 mg/kg/día, según el índice de masa corporal o la depuración de creatinina.
Tampoco se discute que todo paciente que cursa un fenómeno arterial o venoso agudo recibirá dosis terapéuticas (Guías de la International Society of Thrombosis and Hemostasis), de la American Society of Hematology.
La heparina se une a la antitrombina III (AT-III), una glucoproteína plasmática y, en pequeña medida, también al cofactor de heparina II. El resultado de esta unión produce un cambio conformacional y un fuerte aumento del efecto inhibidor de la trombina, que se vuelve aproximadamente 1000 veces más potente que antes. Otros blancos de la heparina sobre la coagulación son la inhibición o activación reducidas de los factores V, VIII y IX, y la inhibición de la función trombocítica, debido a una unión inespecífica del factor plaquetario IV.
La heparina más allá de sus efectos anticoagulantes en la neumonía por COVID-19
La heparina es un fármaco que tiene no solo propiedades anticoagulantes, también muchas otras (interacción con factores de crecimiento, regulación de la proliferación celular y angiogénesis, modulación de proteasas y antiproteasas), convirtiéndola en un tema interesante de investigaciones en el campo de la inflamación, alergia e inmunología, fibrosis pulmonar intersticial y oncología. La inhalación de heparina produce efectos antinflamatorios y antifibróticos locales.
Además, se han descrito posibles efectos
para prevenir la infección viral, incluidos los Coronaviridae, en especial, el
estudio actual que publican Skidmore et al donde describen la capacidad del
SARS-CoV-2 S1 RBD para unirse a la heparina, un requisito previo importante
para la investigación de base relacionada con el desarrollo de la terapéutica
con heparina no fraccionada inhalatoria SARS-CoV-2.10
Estudios experimentales de heparina no fraccionada inhalatoria en sujetos sanos mostraron que las dosis <32.000 UI a través del tracto respiratorio inferior eran seguras. En un estudio de cohorte prospectivo realizado en adultos jóvenes, Harenberg determinó que la dosis inhalada de heparina de bajo peso molecular debía ser 10 veces mayor que la administrada por vía subcutánea para lograr niveles similares de anti-factor Xa.
Considerando el papel de la coagulopatía y la inflamación en la inducción de una lesión pulmonar secundaria a respiradores, la heparina nebulizada mejoró la función pulmonar en pacientes ventilados, en forma equivalente al uso de corticoides. También se la ha comparado con otras intervenciones para estimular la fibrinólisis o bloquear la coagulación para suprimir la respuesta inflamatoria y reducir la lesión pulmonar en el SDRA, y la lesión inhalatoria pulmonar.
La nebulización con heparina podría resultar una herramienta en pacientes con formas moderadas de neumonía para evitar su progresión a formas severas.
Finalmente se plantea el aparente difícil problema de nebulizar sin aerosolizar. Existen diferentes tipos de máscaras, ya sea de toda la cara para practicar snorkel y que pueden adaptarse colocando un adaptador superior para filtrar el aire de salida y en la válvula de descarga un conector de Venturi, o adaptando las máscaras orofaríngeas de anestesia con arnés, colocando en la entrada un conector doble para Venturi y filtrado de aire.
La pandemia no finalizará rápidamente, la comprensión fisiopatológica nos ayudará a encontrar tal vez abordajes terapéuticos que reduzcan la evolución a cuadros graves potencialmente mortales.
Bibliografía
1.
Ciceri
F, Beretta L, Scandroglio AM, et al. Microvascular COVID-19 lung vessels obstructive
thromboinflammatory syndrome (MicroCLOTS): an atypical acute respiratory
distress syndrome working hypothesis. Crit Care Resus 2020; 22(2): 95-97. PMID: 32294809
2.
Jie
Cui, Fang Li, Zheng-Li Shi. Origin and evolution of pathogenic coronaviruses. Nat
Rev Microbiol 2019;: 17(3): 181-192. https://doi.org/10.1038/s41579-018-0118-9
3. Fogarty H, Townsend L, Ni Cheallaigh C, et al. COVID-19 coagulopathy in Caucasian patient. Br J Haematol 2020; 189(6): 1044-1049. https://doi.org/10.1111/bjh.16749
4. Glas GJ, Serpa Neto A, Horn J, et al. Nebulized heparin for patients under mechanical ventilation: an individual patient data meta-analysis. Ann Intensive Care 2016; 6(1): 33. https://doi.org/10.1186/s13613-016-0138-4
5.
Guan W-J, Ni Z-Y, Hu Y, et al. Clinical characteristics of coronavirus disease
2019 in China. N Engl J Med 2020; 382: 1708-1720. https://doi.org/10.1056/NEJMo2002032
6.
Helms
J, Tacquard C, Severac F, et al. High risk of thrombosis in patients in severe
SARS-CoV-2 infection a multicenter prospective cohort study. Intensive Care Med
2020; 46(6): 1089-1098. https://doi.org/10.1007/s00134-020-06062-x
7.
Bikdeli B, Madhavan MV, Jimenez D, et al. COVID-19 and thrombotic or
thomboembolic disease disease: implications for prevention, antithrombotic. J
Am Coll Cardiol 2020; 75(23): 2950-2973. https://doi.org/10.1016/j.jacc.2020.04.031
8.
Panigada M, Bottino N, Tagliabue P, et al. Hypercoagulability of COVID-19
patients in intensive care unit. A report of thromboelastography fndings and
other parameters of hemostasis. J Thromb Haemost 2020; 18(7): 1738-1742.
https://doi.org/10.1111/jth.14850
9.
Phelps
MK, Thompson MJ, Murphy CV, et al. Nebulized heparin for adult patients with
smoke inhalation injury: A review of the literature. J Pharm Technol 2020;
36(4): 130-140. https://doi.org/10.1177/8755122520925774
10. Scazziota A, Pons S. Heparin effects
beyond antithrombotic activity. Hematología 2017; 21: 166-175.
11. Scheuch G, Brand P. Anticoagulative
effects of the inhaled low molecular weight heparin certoparin in healthy subjects.
J Physiol Pharmacol 2007; 58 Suppl 5(Pt 2): 603-614. PMID: 18204174
12. Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheitis in Covid 19. Lancet 2020; 395(10234): 1417-1418. https://doi.org/10.1016/S0140 -6736(20)30937-5
12. La enfermedad tromboembólica en la pandemia de COVID-19
Se puede considerar a la enfermedad tromboembólica como una patología oportunista. Aunque no sucede en todos los casos, lo más habitual es que se manifieste encadenada con otra enfermedad que la predispone, sea tan solo un cuadro menor que obliga al reposo durante unos pocos días o tan trascendente como una neoplasia. Quizá por eso es tan prevalente; en el mundo, afecta a 1 de cada 1000 personas al año y cursa con una alta tasa de morbilidad y mortalidad. Es la tercera causa de muerte cardiovascular, detrás de la cardiopatía isquémica y la enfermedad cerebrovascular.1
La enfermedad comienza en las venas periféricas, la localización más común y más grave es en los miembros inferiores, que aloja a los trombos más voluminosos y cuando supera el nivel de la vena poplítea, por su efecto local, deja muchas veces secuelas invalidantes. La migración de estos trombos de gran tamaño hacia la circulación pulmonar produce las embolias más graves, generadoras de un brusco incremento de la resistencia vascular pulmonar, que compromete la función del VD. La causa de muerte más frecuente por embolia pulmonar es la insuficiencia ventricular derecha aguda.
COVID-19 y trombosis
La enfermedad causada por el SARS-CoV-2 tiene todos los ingredientes que predisponen tanto a la dificultad respiratoria aguda con microtrombosis, como a la macrotrombosis, tanto en el circuito arterial como en el venoso: tormenta inflamatoria, activación plaquetaria, disfunción endotelial y estasis. Afecta, en forma predominante, a quienes padecen de diabetes o ECV. La edad es un factor predictivo de severidad. Aunque con menos frecuencia, también las personas jóvenes y sanas están expuestas a graves complicaciones, entre ellas, enfermedad respiratoria y diversas formas de trombosis.
El SDRA del adulto2
predispone a la enfermedad tromboembólica. En este contexto, recientemente, se
han propuesto mecanismos hemostáticos que permiten comprender la patogenia
molecular, asociada con enfermedad endotelial que produce inflamación y altera
los mecanismos de coagulación en la sepsis viral o bacteriana y otras
enfermedades críticas.3 La alteración endotelial
que produce la enfermedad viral que nos ocupa genera dos mecanismos moleculares
mayores: el primero es una inapropiada respuesta inflamatoria con producción de
citocinas: IL proinflamatorias, factor de necrosis tumoral a y otras (“tormenta de citocinas”) y el otro
es la liberación, por el endotelio, de factores procoagulantes. Estos últimos
son responsables de los fenómenos de microtrombosis que afectan al parénquima
pulmonar y eventualmente a otros órganos. Cuando a estos factores se asocia la
activación del factor tisular, producto del endotelio asociado al tejido
subendotelial, se inicia la ruta de la macrotrombosis (Figura 4), una de cuyas
expresiones es, a nivel del territorio venoso periférico, la trombosis venosa
profunda.4
Figura 4. En la imagen se ve al agresor, en este caso, el COVID-19 que activa por el endotelio a la vía del factor de von Willebrand extraliviana, generando microtrombosis en diversos órganos, especialmente en el pulmón que es su puerta de ingreso. Pero también, al acceder al subendotelio, activa la formación de fibrina y la macrotrombosis.
COVID-19 y enfermedad tromboembólica
Recientes estudios han mostrado una correlación entre los niveles elevados de dímero D, un producto de degradación del fibrinógeno, marcador de enfermedad tromboembólica y de mortalidad por COVID-19, planteando la posibilidad de que esta fatal evolución se atribuya, en un número aún no fehacientemente determinado de casos, a enfermedad tromboembólica enmascarada. Obviamente, los signos y síntomas de la enfermedad respiratoria por el virus de referencia tienen gran similitud con los de la embolia pulmonar y no es posible detectar solamente con la clínica esta complicación tan temible.
En el
análisis retrospectivo de 191 pacientes del Wuhan Pulmonary Hospital publicado
recientemente por Zhou et al5 se demostró, por
análisis multivariado, que los factores predisponentes para una mayor
mortalidad fueron: edad avanzada (p = 0,0043), índice SOFA (p <0,0001) y
nivel alto de dímero D (p = 0,0033). A pesar de que el valor máximo de los
pacientes fallecidos fue 40 veces superior al de los supervivientes, el
incremento del dímero D se atribuyó exclusivamente al trastorno de la
coagulación y la microtrombosis, y la enfermedad tromboembólica no fue
explorada. Poco tiempo después, en Holanda,6 se
evaluó a 184 pacientes
internados en UCI locales, en quienes se analizó la incidencia de
macrotrombosis: accidente cerebrovascular isquémico, infarto de miocardio y
trombosis en el circuito venoso. En 75 de ellos, se diagnosticó algún episodio
de trombosis y, en 65 (87%) de estos, se diagnosticó embolia pulmonar. Otros
dos padecieron trombosis en catéteres de miembro superior, a un tercero se le
diagnosticó una flebotrombosis profunda de miembro inferior. Todos los
internados habían recibido tromboprofilaxis según protocolo hospitalario,
excepto 17 que venían ya anticoagulados por otras razones, y que continuaron
esta terapéutica, sin sufrir complicaciones hemorrágicas. La macrotrombosis
implicó un mayor riesgo de mortalidad (HR 5,4; IC95% 2,4-12). Helms et al
publicaron un análisis de 150 pacientes con diagnóstico de SDRA por COVID-19.7 En este estudio, los autores estudiaron con angio-TC
exclusivamente a los pacientes que tuvieron un acentuado empeoramiento clínico
en un lapso breve o un salto significativo en el nivel de dímero D. En el 25%
de estos enfermos, se confirmó la presencia de embolias pulmonares.
Diagnóstico de enfermedad tromboembólica en el contexto de la COVID-19
La clínica. Como ya hemos expuesto, el diagnóstico es dificultoso, ya que no es razonable estudiar a todos los pacientes con angio-TC. De acuerdo con Helms et al, parece lógico solicitar una TC a quienes evolucionan peor y en quienes se incrementan abruptamente los valores de dímero D. Datos clínicos por tener en cuenta: antecedentes de fenómenos trombóticos, de cáncer o cirugía reciente.
La ecografía. Una opción simple, aunque no muy sensible, es la ecografía de miembros inferiores en los pacientes con más de tres días de reposo en cama, pero la mitad de los enfermos con embolia pulmonar no tiene flebotrombosis profunda demostrable. Más aún, no está claro cuántos de los presuntos émbolos son, en realidad, macrotrombosis in situ, causada por la enfermedad viral.
Con los pacientes que empeoran se puede intentar la ecografía pulmonar con el protocolo BLUE propuesto por Liechtenstein et al,8 con las dificultades del caso. Es de ayuda también la ecocardiografía que permite evaluar la repercusión sobre el VD, la presión en el circuito cardiopulmonar y eventualmente, detectar trombos en tránsito.
El dímero D. Es raro encontrar un paciente con COVID-19 grave y dímero D normal, pero si fuera el caso, se debe descartar enfermedad tromboembólica. Lo habitual es que estos pacientes, con compromiso respiratorio, tengan niveles elevados de dímero D y fibrinógeno, debido a la hipercoagulabilidad producida por la ya mencionada tormenta de citocinas. Un incremento acentuado es un dato por considerar.
Tratamiento y profilaxis. El manejo de estos enfermos no difiere demasiado del que se propone en las Guías de enfermedad tromboembólica.9-11
Recordemos que algunas drogas en investigación para el tratamiento de la COVID-19 incrementan el riesgo de trombosis, como el bevacizumab, que aumenta la incidencia de complicaciones cardiovasculares y exigen una especial alerta en los pacientes más vulnerables. Como norma, cuando se agregan varios fármacos, debieran analizarse sus posibles interacciones.
Se debe estratificar a todos los pacientes a fin de que reciban la adecuada profilaxis antitrombótica farmacológica; se pueden emplear: heparina sódica, heparinas de bajo peso molecular, fondaparinux o argatrobán. Si las drogas antitrombóticas estuvieran contraindicadas, se recomienda emplear profilaxis mecánica (compresión neumática intermitente). En los casos con mayor riesgo, por los antecedentes, se pueden asociar profilaxis farmacológica y mecánica. Evaluando individualmente los casos, se sugiere la posibilidad de una profilaxis extendida en pacientes con cáncer, IC avanzada o movilidad disminuida.
Anticoagulación. La heparina sódica sigue siendo de elección en los pacientes muy
inestables o los que pueden requerir una maniobra quirúrgica o punción a ciegas
de un vaso o una cavidad cerrada. Para los demás se sugiere el uso de heparinas
de bajo peso molecular y, cuando el paciente es dado de alta, anticoagulación
oral con los nuevos anticoagulantes.10
Los pacientes críticos, en especial con alteración severa de la coagulación, si es posible, llevarlos a Hemodinamia (puede ser complicado si están en decúbito prono), es preferible confirmar el diagnóstico por angiografía y remover los trombos mecánicamente o con bajas dosis de líticos.
La lisis farmacológica luego de la confirmación por angio-TC es una opción factible, pero que requiere el acuerdo del hematólogo cuando el paciente tiene serias alteraciones de la coagulación.
Para concluir, parece conveniente recordar lo que, en la práctica, es evidente e insoslayable: el enfoque terapéutico de estos pacientes es multidisciplinario. Confluyen intensivistas, infectólogos, hematólogos, neumonólogos, cardiólogos y quizás alguno más que no he tenido en cuenta.
Bibliografía
1.
Cushman
M. Epidemiology and risk factors for venous thrombosis. Semin Hematol 2007;
44(2): 62-69. https://doi.org/10.1053/j.seminhematol.2007.02.004
2.
Del
Sorbo L, Slutsky AS. Acute respiratory distress syndrome and multiple organ
failure. Curr Opin Crit Care 2011; 17 (1): 1-6. https://doi.org/10.1097/MCC.0b013e3283427295
3.
Chang
JC. Acute respiratory distress syndrome as an organ phenotype of vascular
microthrombotic disease: based in hemostatic theory and endothelial molecular
pathogenesis. Clin Appl Thromb Hemost 2019; 25:1076029619887437. https://doi.org/10.1177/1076029619887437
4.
Rotzinger
DC, Beigelman-Aubry C, von Garnier C. Pulmonary embolism in patients with
COVID-19. Time to change the paradigm of computed tomography. Thromb Res 2020;
190: 58-59. https://doi.org/10.1016/j.thromres.2020.04.011
5.
Zhou
F, Yu T, Du R. Clinical course and risk factors for mortality of adult
inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet
2020; 395(10229): 1054-1062. https://doi.org/10.1016/S0140-6736(20)30566-3
6.
Klok FA, Kruip MJHA, van der Meer NJM, et al. Confirmation of the high cumulative
incidence of thrombotic complication in critically ill ICU patients with
COVID-19. An updated analysis. Thromb Res 2020; 191: 148-150. https://doi.org/ https://doi.org/10.1016/j.thromres.2020.04.041
7.
Helms
J, Tacquard C, Severac F, et al. High risk of thrombosis in patients with
severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive
Care Med 2020; 46(6): 1089-1098. https://doi.org/10.1007/s00134-020-06062-x
8. Lichtenstein DA, Mezière GA. Relevance of lung ultrasound in the diagnosis of acute respiratory failure: the BLUE protcol. Chest 2008; 134: 117-125. https://doi.org/10.1378/chest.07-2800
9. Ubaldini JE. Consenso de Enfermedad Tromboembólica Aguda. Revista Argentina de Cardiología 2016; 84: 74-91. https://doi.org/10.7775/rac.es.v84.i1.7739
10. Bikdeli
B, Madhavan MV, Jiménez D, et al. COVID-19 and thrombotic and
thromboembolic disease: Implication for prevention, antithrombotic therapy, and
follow up: JACC State-of-the-Art Review. J Am Coll Cardiol 2020; 75: 2950-2973.
https://doi.org/10.1016/j.jacc.2020.04.031
11. Flores LA, Ubaldini JE, Kenar MR, et al. Guías de Manejo y Tratamiento de la Enfermedad Tromboembólica Aguda. RATI 2019; 36:2. Disponible en: http://revista.sati.org.ar/index.php/MI/article/view/642/780