Pautas preliminares para el uso de tocilizumab
en pacientes con neumonía por COVID-19
[Preliminary Guidelines for the Use of
Tocilizumab in Patients with COVID-19 Pneumonia]
Pablo Saúl, Viviana
Chediack, Laura Sabater, Javier Farina, Cecilia Pereyra, Marisol
García-Sarubbio, Cecilia Domínguez, Alberto Cremona, Eduardo Serra, Ana
Victoria Sánchez, Analía Palaoro, María Cecilia García, Analía De Cristófano,
Gabriela Sheehan, Darío Godoy, Juan José Videla, Mariela Velásquez, María
Monserrat Lloria, Paula Juárez, Soledad Areso, Sonia Vélez, Analía Costas,
María Candela Llerena, Leandro Aguirre, Yésica Lamberto, Marco Flores-Monte,
Silvina Neyro, María Mezzenzani, Florencia Gil, Florencia Sáinz, María Belén
Guzmán-Martínez, Sofía Esposto, Mónica Lares, Ana Laura González, Wanda
Cornistein, Miriam Blanco, Carina Balasini, Eleonora Cunto*. Comité de Infectología Crítica, Sociedad Argentina de
Terapia Intensiva
* Correspondencia: eleonora1958@hotmail.com
Los
autores no declaran conflictos de intereses.
Advertencia: Debido a la pandemia en curso, el carácter
preliminar de los datos y la rápida evolución del conocimiento que estamos experimentando día a día sobre la COVID-19, los conceptos vertidos en
este documento son provisorios y pueden variar de acuerdo con nueva evidencia.
Resumen
La enfermedad grave por COVID-19 tiene una
fase inicial con alta carga viral seguida de una segunda fase donde predomina un
síndrome hiperinflamatorio. El tocilizumab es un anticuerpo monoclonal
recombinante dirigido contra el receptor alfa soluble y ligado a la membrana de
IL-6 y su uso se ha aprobado para ciertas enfermedades. Se debe evaluar en
pacientes con neumonía por COVID-19 que tienen un mayor riesgo de progresión,
en quienes aumenta la intensidad del soporte respiratorio, especialmente si
requieren ventilación no invasiva o cánula de alto flujo y, en una etapa
temprana, ante el requerimiento de ventilación mecánica, con un beneficio en la
tasa de mortalidad. Este documento es una revisión de las publicaciones sobre
la elegibilidad de los pacientes y el tratamiento con tocilizumab.
Palabras clave: COVID-19; neumonía; tocilizumab; ventilación
mecánica.
Abstract
Severe COVID-19 disease has an initial phase
with high viral load followed by a second phase where a hyperinflammatory
syndrome predominates. Tocilizumab is a recombinant monoclonal antibody
directed against the soluble and membrane-bound alpha receptor of IL-6 and its
use has been approved for certain pathologies. It should be evaluated in
patients with COVID-19 pneumonia and higher risk of progression, in whom the
intensity of respiratory support increases, especially if they require
non-invasive ventilation or high-flow cannula and early on mechanical
ventilation requirement, with benefit in mortality. This document reviews
publications on patient eligibility and treatment with tocilizumab.
Keywords: COVID-19; pneumonia; tocilizumab; mechanical ventilation.
Introducción
Aproximadamente el 15% de los pacientes
con COVID-19 presenta una forma grave de neumonía con una tasa alta de
mortalidad y una significativa ocupación del sistema de salud por el
requerimiento de ventilación no invasiva, invasiva y soporte de las
disfunciones orgánicas.1,2
La enfermedad grave causada por el
coronavirus tiene una fase inicial con alta carga viral, seguida,
aproximadamente a los 7-10 días de evolución, por una segunda fase, en la que
predomina un síndrome hiperinflamatorio.3
Este síndrome hiperinflamatorio se caracteriza por un incremento de citocinas proinflamatorias, marcadores de inflamación (proteína C reactiva, ferritina, dímero D), evolución a síndrome de dificultad respiratoria del adulto y, en los casos más graves, disfunción multiorgánica.
Los niveles de una de estas citocinas
proinflamatorias, la interleucina 6 (IL-6), se relacionan con la gravedad de la
COVID-19 y esto ha llevado a estudiar el uso de antagonistas de IL-6 en esta
enfermedad.4-6
Un análisis genómico reciente de
pacientes críticos con COVID-19 mostró una potencial relación entre variantes
genéticas en la vía inflamatoria de la IL-6 y enfermedad crítica.7
El
tocilizumab es un anticuerpo monoclonal recombinante dirigido contra el
receptor alfa soluble y ligado a la membrana de IL-6 y su uso se ha aprobado
para ciertas enfermedades inflamatorias y autoinmunes (como artritis
reumatoide, artritis juvenil idiopática y síndrome de liberación de citocinas
inducido por la terapia quimérica dirigida al receptor de células T).
Desde los inicios de la pandemia, se han
publicado series de casos y estudios observacionales que sugerían beneficios
del tocilizumab para pacientes con neumonía grave por COVID-19.8-17
Los primeros estudios aleatorizados (y un estudio de cohorte en pacientes críticos) mostraron resultados conflictivos sin un beneficio claro, pero incluyeron relativamente pocos pacientes, y la intensidad del soporte respiratorio y el intervalo desde inicio de los síntomas hasta la inclusión variaban. Asimismo, en algunos estudios, el porcentaje de pacientes que recibían corticoides era relativamente bajo.18-24
Recientemente se presentaron dos grandes estudios, el REMAP-CAP que evaluó el uso de tocilizumab en pacientes críticos y el RECOVERY que estudió el tocilizumab en pacientes hospitalizados.
Estos estudios tenían un gran número de
pacientes (el RECOVERY incluyó cuatro veces más pacientes que la suma de los
estudios aleatorizados previos), y la mayoría recibía tratamiento concomitante
con corticoides. Se incorporaron pacientes críticos que recibieron tocilizumab
en forma precoz (dentro de las primeras 24 h del inicio del soporte
ventilatorio).25,26
Los dos estudios mostraron un beneficio
significativo sobre la tasa de mortalidad, la estancia hospitalaria y el tiempo
necesario de soporte ventilatorio y cardiovascular en los pacientes críticos.
Este beneficio se observó en pacientes que no recibían corticoides y fue
adicional al beneficio que confiere el uso de dexametasona.25,26
En pacientes críticos (estudio REMAP-CAP), el tocilizumab asociado a corticoides disminuyó el riesgo de muerte relativa en un 24% (8,5% de reducción absoluta) con respecto al tratamiento estándar y redujo aproximadamente una semana la internación en la Unidad de Terapia Intensiva (UTI). En este ensayo, el número necesario de pacientes por tratar para evitar una muerte fue de 12.
Los pacientes críticos con tocilizumab
tuvieron más días sin
soporte orgánico (ventilación mecánica, ventilación no invasiva, cánula nasal
de alto flujo y soporte vasopresor o inotrópico) (Anexo 1) que
el grupo con tratamiento estándar.25
Los
resultados del estudio RECOVERY sugieren que el uso de tocilizumab más
corticoides podría reducir un tercio la tasa de mortalidad en los pacientes que
reciben solo oxígeno y hasta un 50% en quienes requieren ventilación mecánica,
además de acortar la estancia hospitalaria (en, al menos, una semana) y la
necesidad de ventilación mecánica (Anexo 2). El número necesario de pacientes por tratar para
evitar una muerte fue de 25, a diferencia del REMAP-CAP.25,26
Según un metanálisis reciente de estudios aleatorizados realizado por Cochrane, el tratamiento con tocilizumab evita 32 muertes por 1000 pacientes.
Sobre la base de estos datos preliminares (el RECOVERY solo se ha presentado como preprint y recientemente se ha publicado el REMAP-CAP), el National Health Service del Reino Unido, la Infectious Diseases Society of America y los National Institutes of Health (NIH) de los Estados Unidos publicaron recomendaciones para el uso de tocilizumab en pacientes hospitalizados por COVID-19 con ciertos cuadros que confieren un riesgo incrementado de progresión y mala evolución clínica.27-34
Los NIH
concluyen en que los estudios RECOVERY y REMAP-CAP muestran evidencia
consistente de que el tocilizumab asociado a dexametasona ofrece un beneficio
en la tasa de mortalidad, en el grupo de pacientes hospitalizados graves con
deterioro clínico rápido (incremento del requerimiento de soporte respiratorio
y respuesta inflamatoria aumentada).30
En el Reino Unido, según la base ISARIC (International Severe Acute Respiratory and Emerging Infection Consortium), se estima que un 49% de los pacientes hospitalizados con neumonía grave por COVID-19 cumplirían los criterios para considerar el uso de tocilizumab (Anexo 3).26
Si bien no
ha sido incorporado aún en las guías de tratamiento de la Organización Mundial
de la Salud y no está aprobado por la Administración Nacional de Medicamentos,
Alimentos y Tecnología Médica (ANMAT) en nuestro país para el tratamiento de la
COVID-19, debido a los beneficios adicionales al uso de dexametasona que podría
tener tocilizumab, disminuyendo la tasa de mortalidad (particularmente en los
casos más graves o con alto riesgo de progresión) y aliviando la tensión sobre
los servicios de salud (al acortar el tiempo de soporte orgánico y la estancia
hospitalaria), consideramos oportuno elaborar recomendaciones preliminares para
el uso de tocilizumab en pacientes hospitalizados por COVID-19 en nuestro
medio.
Recomendaciones preliminares para el uso de tocilizumab (Anexo 4)
• Considerar el uso de tocilizumab en pacientes con alto riesgo de progresión.
1. Criterios para el uso de tocilizumab (debe cumplir todos los criterios):
2. Pacientes hospitalizados con COVID-19 confirmada.
3. Con evidencia de neumonía por COVID-19.
4. En tratamiento con dexametasona 8 mg/día por vía endovenosa (o dosis equivalente de corticoides).
5. Evolución del cuadro ≤10 días.
6. Sin contraindicaciones para la administración de tocilizumab.
• Más alguna de las siguientes situaciones:
a. Paciente en la UTI: dentro de las 24 h del requerimiento de soporte respiratorio (ventilación mecánica invasiva, ventilación no invasiva, cánula nasal de alto flujo con FiO2 >0,4 y flujo >30 l/min). Se debe priorizar a los pacientes con internación reciente en la UTI (<24 h).
b. Paciente en Sala (en algunos centros de salud de nuestro país, estos pacientes, con frecuencia, son internados en la UTI para un mejor control) y que presente:
- SaO2 ≤92% con FiO2 0,21 más proteína C reactiva ≥75 mg/l.
- Requerimiento de O2 más proteína C reactiva ≥75 mg/l.
En estos casos, se debe priorizar a los pacientes con internación reciente (≤3 días) y con rápido escalamiento del soporte respiratorio, sobre todo, si requieren ventilación no invasiva o cánula nasal de alto flujo, a pesar del uso de dexametasona.
• Contraindicaciones para el uso de tocilizumab:
1. Inmunodepresión significativa.
2. Sin requerimiento de dexametasona.
3. Uso reciente de inmunomoduladores biológicos.
4. Proceso infeccioso no controlado (bacteriano, fúngico o viral distinto de la COVID-19).
5. Elevación de transaminasas ≥ x 5.
6. Neutrófilos <2000/mm3.
7. Plaquetas <50.000/mm3.
8. Alto riesgo de perforación gastrointestinal.
9. Embarazo y lactancia (salvo que los beneficios excedan claramente los riesgos).
10. Menores de 18 años (no se dispone de suficiente información).
11. Hipersensibilidad conocida a tocilizumab.
Notas:
• Indicación de tocilizumab en la UTI: Los NIH recomiendan el tocilizumab si el paciente está dentro de las primeras 24 h de ingreso en la UTI y requiere soporte respiratorio: ventilación mecánica, ventilación no invasiva, cánula de alto flujo u oxigenación por membrana extracorpórea.
El NHS, en cambio, recomienda el tocilizumab dentro de las 24 h del comienzo del soporte orgánico sin considerar la estancia en la UTI.
El estudio REMAP-CAP incluyó a pacientes con una mediana de
hospitalización de 1.2 días (rango 0.8-2.8) y dentro de las 24 h de ingreso en
la UTI.
En nuestro país, muchos pacientes graves con requerimiento de máscara con reservorio son internados en la UTI para un control más estrecho; por esta realidad local, consideramos el intervalo del inicio del soporte orgánico (respiratorio, terapia de reemplazo renal, hemodinámico) y no la estancia en la UTI, aunque ante una situación de poca disponibilidad de tocilizumab, debería priorizarse el paciente con internación reciente.
• Ante la situación poco frecuente de un paciente que requiera solo soporte hemodinámico (vasopresor o inotrópico) y no respiratorio, se podría considerar el uso de tocilizumab dentro de las 24 h del comienzo de este soporte.
• Tocilizumab fuera de la UTI: Se debe administrar idealmente dentro de los tres días de la hospitalización. El estudio RECOVERY incluyó a pacientes con una mediana de 2 días (rango 1-5).
• Tocilizumab solo debe administrarse asociado a dexametasona.
• Se han comunicado
casos de hiperinfección/estrongiloidiasis diseminada en pacientes con COVID-19 tratados
con tocilizumab más dexametasona. Se debe considerar la profilaxis con
ivermectina en áreas endémicas de estrongiloidiasis o en pacientes provenientes
de esas áreas.34-36
Dosis de tocilizumab
Se recomienda una sola dosis tocilizumab de 8 mg/kg de peso actual (dosis máxima de 800 mg).
Nota:
En los estudios REMAP-CAP y RECOVERY, se administró una segunda dosis a las 12-24 h a un grupo de pacientes, según el criterio del médico, y no se demostró un mayor beneficio y el costo aumentó, por lo cual se recomienda actualmente una sola dosis.25,26,28-30,37 En el estudio RECOVERY, se propone una dosis de acuerdo con los rangos de peso:26
• ≤40 kg = 8 mg/kg
• 41-65 kg = 400 mg
• 66-90 kg = 600 mg
• 90 kg = 800 mg
Sin embargo, esto puede llevar a administrar dosis menores o mayores que las que corresponden por mg/kg, por lo que sería conveniente usar 8 mg/kg para cada paciente.
Presentación de tocilizumab: frasco ampolla de 400 mg/20 ml.
Administración de tocilizumab: debe administrarse en 100 ml de solución fisiológica (volumen de la ampolla + diluyente de solución fisiológica: 100 ml en total) en el transcurso de 1 h (Figura).
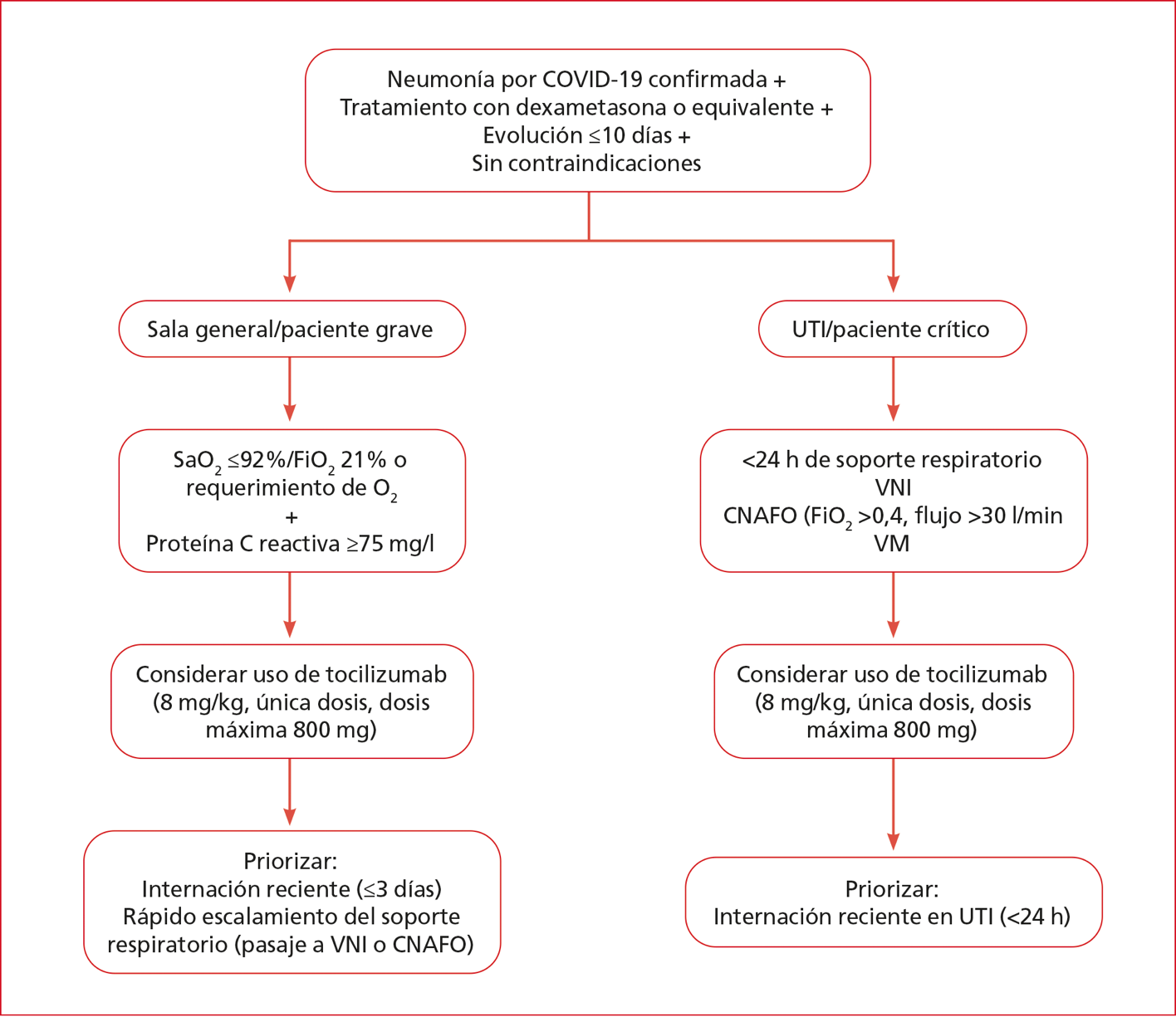
Figura. Flujograma para la indicación de tocilizumab.
UTI = Unidad de Terapia Intensiva, VNI = ventilación no invasiva, VM = ventilación mecánica, CNAFO = cánula nasal de alto flujo.
Si bien el costo de una infusión de tocilizumab es de 700-1300 dólares, según la dosis, su efecto sobre la tasa de mortalidad y la estancia hospitalaria podría convertirla en una intervención costo-efectiva. Se debe recordar, por ejemplo, que un día de internación en la UTI cuesta alrededor de 700-1000 dólares, es decir, el tocilizumab costaría el equivalente a 1-2 días de terapia intensiva con el beneficio de disminuir la tasa de mortalidad relativa en alrededor del 24%, acortar el tiempo de soporte orgánico y el tiempo de estancia en alrededor de una semana.
Reacciones adversas
En los estudios aleatorizados llevados a cabo hasta la fecha, no se han observado reacciones adversas serias. La frecuencia de episodios adversos ha sido, en general, similar a la de los grupos estándar o placebo.18-26 Si bien, en algunos estudios pequeños, se describe un aumento de las infecciones bacterianas, esto no se ha observado en los estudios aleatorizados, al menos, en el corto plazo (Tabla).18-26
Tabla
Infecciones en estudios aleatorizados de
tocilizumab en pacientes con COVID-19
|
Estudio |
Tocilizumab |
Control |
Comentario |
|
RECOVERY |
–––––––––– |
–––––––––– |
Sin diferencias significativas en los
eventos adversos |
|
REMAP-CAP |
–––––––––– |
–––––––––– |
Sin diferencias significativas en los
eventos adversos |
|
COVACTA |
Infecciones 21% |
Infecciones 26% |
Sin diferencias significativas en los
eventos adversos |
|
EMPACTA |
Infecciones 5% |
Infecciones 7% |
Sin diferencias significativas en los
eventos adversos |
|
CORIMUNO-TOCI-1 |
Eventos adversos 44% |
Eventos adversos 44% |
Sin diferencias significativas en los
eventos adversos Infecciones poco frecuentes |
|
BACC-Bay |
Infecciones 8% |
Infecciones 17% |
Infecciones: en grupo de control (p 0,03) Neutropenia mayor en grupo de tocilizumab
(p 0,002) |
|
RCT-TCZ-COVID-19 |
–––––––––– |
–––––––––– |
Solo 2 infecciones graves (grupo de control) |
|
TOCIBRAS |
Eventos adversos 43% |
Eventos adversos 34% |
Sin diferencias significativas en los
eventos adversos |
Sin embargo, el seguimiento de pacientes que recibieron tocilizumab ha sido breve, en general, de no más de un mes, por lo que se desconocen sus efectos a largo plazo.
Interacciones
Con una sola dosis no se esperan interacciones clínicamente significativas. Se puede administrar dexametasona, en forma concomitante, con tocilizumab.
Conclusiones
El uso de tocilizumab en pacientes con COVID-19 sigue siendo muy controvertido. Sin bien los dos últimos estudios aleatorizados con gran número de pacientes (REMAP-CAP y RECOVERY) muestran beneficios en la tasa de mortalidad, estudios previos (también aleatorizados), aunque con menor cantidad de pacientes, no arrojaron beneficios significativos en ese desenlace.
Otra dificultad que se agrega es el costo de cada tratamiento individual. Si bien parece ser una estrategia costo-efectiva, el gran número de pacientes en los que podría indicarse (50% de los internados) podría impactar, en forma significativa, desde el punto de vista económico, en el sistema de salud. Por lo tanto, no es posible hacer una recomendación fuerte por el momento. Solo se podría considerar de acuerdo con la disponibilidad y luego de una evaluación del riesgo/beneficio, el agregado de tocilizumab a pacientes con mayor riesgo de progresión, como aquellos que rápidamente –a pesar del tratamiento con dexametasona– requieren aumentar la intensidad del soporte respiratorio (especialmente si necesitan ventilación no invasiva o cánula nasal de alto flujo) y probablemente dentro de las 24 h del requerimiento de ventilación mecánica.
Otro factor importante parece ser la precocidad de su indicación, no más allá de los tres días de internación (dentro de los 10 días del comienzo de los síntomas) y probablemente dentro de las 24 h de ingresar en la UTI.
En este contexto, el uso de tocilizumab se enmarcaría en una indicación fuera de prospecto (off-label), es decir, se administraría fuera de las indicaciones para las cuales está aprobado el fármaco. Por ello, antes de la administración, se debe solicitar la firma del consentimiento informado (el Anexo 5 muestra un modelo de consentimiento informado).
Asimismo, se debe informar al comité de
ética en investigación de la institución sobre esta decisión para que evalúe el
caso y asesore en este proceso. Por último, en el Anexo 6, se
muestra un listado de verificación que puede ayudar en el proceso de toma de
decisiones.
Bibliografía
1.
Guan
W-J, Ni Z-Y, Hu Y, et al. Clinical
characteristics of coronavirus disease 2019 in China. N Engl J
Med 2020; 382: 1708-1720. https://doi.org/10.1056/NEJMoa2002032
2.
Yang
X, Yu Y, Xu J, et al. Clinical
course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in
Wuhan, China: a single-centered, retrospective, observational study. Lancet
Respir Med 2020; 8: 475-481. https://doi.org/10.1016/S2213-2600(20)30079-5
3.
Cevik
M, Tate M, Lloyd O, et al. SARS-CoV-2,
SARS CoV-1 and MERS-CoV viral load dynamics, duration of viral shedding and
infectiousness—a living systematic review and meta-analysis. Lancet
Microbe 2021; 2(1): e13-e22. https://doi.org/10.1016/S2666-5247(20)30172-5
4.
Giamarellos-Bourboulis
EJ, Netea MG, Rovina N, et al. Complex
immune dysregulation in COVID-19 patients with severe respiratory failure. Cell
Host Microbe 2020; 27(6): 992.e3-1000.e3. https://doi.org/10.1016/j.chom.2020.04.009
5.
Aziz M,
Fatima R, Assaly R. Elevated interleukin-6 and severe COVID-19: a
meta-analysis. J Med Virol 2020; 92: 2283-2285. https://doi.org/10.1002/jmv.25948
6.
Zhu J,
Pang J, Ji P, et al. Elevated interleukin- 6 is associated with severity of
COVID-19: a meta-analysis. J Med Virol 2021; 93(1): 35-37. https://doi.org/10.1002/jmv.26085
7.
Pairo-Castineira
E, Clohisey S, Klaric L, et al. Genetic mechanisms of critical illness in
Covid-19. Nature 2021; 591(7848): 92-98. https://doi.org/10.1038/s41586-020-03065-y
8.
Cellina
M, Orsi M, Bombaci F, et al. Favorable
changes of CT findings in a patient with COVID-19 pneumonia after treatment
with tocilizumab. Diagn Interv Imaging 2020; 101: 323-324. https://doi.org/10.1016/j.diii.2020.03.010
9.
Michot
J-M, Albiges L, Chaput N, et al. Tocilizumab, an anti-IL-6 receptor antibody,
to treat COVID-19-related respiratory failure: a case report. Ann Oncol 2020;
31: 961-964. https://doi.org/10.1016/j.annonc.2020.03.300
10. Antwi-Amoabeng D, Kanji Z, Ford B, et al. Clinical
outcomes in COVID-19 patients treated with tocilizumab: an individual patient
data systematic review. J
Med Virol 2020; 92: 2516-2522. https://doi.org/10.1002/jmv.26038
11. Xu X, Han
M, Li T, et al. Effective treatment
of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A 2020;
117: 10970-10975. https://doi.org/10.1073/pnas.2005615117
12. Kaye A, Siegel R. The efficacy of IL-6 inhibitor tocilizumab
in reducing severe COVID-19 mortality: a systematic review. Disponible
en: https://www.medrxiv.org/content/10.1101/2020.07.10.20150938v2
13. Guaraldi G, Meschiari M, Cozzi-Lepri A, et al. Tocilizumab
in patients with severe COVID-19: a retrospective cohort study. Lancet
Rheumatology 2020; 2(8): e474-e484. https://doi.org/10.1016/S2665-9913 (20) 30173-9
14. Somers EC, Eschenauer GA, Troost JP, et al.
Tocilizumab for treatment of mechanically ventilated patients with COVID-19.
Clin Infect Dis 2021; 73(2): e445-e454. https://doi.org/10.1093/cid/ciaa954
15. Sinha P, Mostaghim A, Catherine G, et al. Early
administration of interleukin-6 inhibitors for patients with severe COVID-19
disease is associated with decreased intubation, reduced mortality, and
increased discharge. Int J Infect Dis 2020; 99: 28-33. https://doi.org/10.1016/j.ijid.2020.07.023
16. Ramiro S, Remy LM, Magro-Checa C, et al. Historically
controlled comparison of glucocorticoids with or without tocilizumab versus
supportive care only in patients with COVID-19-associated cytokine storm
syndrome: results of the CHIC study. Ann Rheum Dis 2020; 79(9): 1143-1151. https://doi.org/10.1136/annrheumdis-2020-218479
17. Price CC, Altice FL, Shyr Y, et al. Tocilizumab
treatment for cytokine release syndrome in hospitalized COVID-19 patients:
survival and clinical outcomes. Chest 2020; 158(4): 1397-1408. https://doi.org/10.1016/j.chest.2020.06.006
18. Stone JH, Frigault MJ, Serling-Boyd NJ, et al.
Efficacy of tocilizumab in patients hospitalized with COVID-19. N Engl J Med
2020; 383(24): 2333-2344. https://doi.org/10.1056/NEJMoa2028836
19. Salvarani C, Dolci G, Massari M, et al. Effect of
tocilizumab vs standard care on clinical worsening in patients hospitalized
with COVID-19 pneumonia: a randomized clinical trial. JAMA Intern Med 2021;
181(1): 24-31. https://doi.org/10.1001/jamainternmed.2020.6615
20. Hermine O, Mariette X, Tharaux PL, et al. Effect of
tocilizumab vs usual care in adults hospitalized with COVID-19 and moderate or
severe pneumonia: a randomized clinical trial. JAMA Intern Med 2021; 181(1):
32-40. https://doi.org/10.1001/jamainternmed.2020.6820
21. Gupta S, Wang W, Hayek SS, et al. Association between
early treatment with tocilizumab and mortality among critically ill patients
with COVID-19. JAMA Intern Med 2021; 181(1): 41-51. https://doi.org/10.1001/jamainternmed.2020.6252
22. Rosas I, Bräu N,
Waters M, et al. Tocilizumab in hospitalized patients with severe COVID-19
pneumonia. NEJM 2021; 384(16):
1503-1516. https://doi.org/10.1056/NEJMoa2028700
23. Veiga VC,
Prats J, Farias DLC, et al. Effect of
tocilizumab on clinical outcomes at 15 days in patients with severe or critical
coronavirus disease 2019: randomised controlled trial. BMJ 2021;
372: n84. https://doi.org/10.1136/bmj.n84
24. Salama C,
Han J, Yau L, et al. Tocilizumab in
patients hospitalized with COVID-19 pneumonia. N Engl J Med 2021; 384(1):
20-30. https://doi.org/10.1056/NEJMoa2030340
25. Gordon AC, Mouncey PR, Al-Beidh F, et al (REMAP-CAP
Investigators). Interleukin-6 receptor antagonists in critically ill patients
with COVID-19. N Engl J Med 2021. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/33631065
26. Horby PW, Pessoa-Amorim G, Peto L, et al (RECOVERY
Collaborative Group). Tocilizumab in patients admitted to hospital with
COVID-19 (RECOVERY): preliminary results of a randomised, controlled,
open-label, platform trial. medRxiv 2021. Disponible en: https://www.medrxiv.org/content/10.1101/2021.02.11.21249258v1
27. COVID-19 rapid evidence summary: Tocilizumab for
COVID-19 .15 January 2021. Disponible en: www.nice.org.uk/guidance/es33
28. Interim Clinical Commissioning Policy: Tocilizumab for
hospitalised patients with Covid-19 pneumonia (adults). Rapid Policy Statement.
NHS. 8 January 2021.
29. Interim Position Statement: Interleukin-6 inhibitors
(tocilizumab or sarilumab) for patients admitted to ICU with COVID-19 pneumonia
(adults). NHS. 22 February 2021.
30. The COVID-19 Treatment Guidelines Panel’s Statement on the Use of Tocilizumab for the
Treatment of COVID-19. Coronavirus Disease 2019 (COVID-19) Treatment
Guidelines. 05/03/2021.NIH.Disponible en: www.covid19treatmentguidelines.nih.gov
31. Wise J. Covid 19: arthritis drug tocilizumab improve
survival in intensive care patients, shows study. BMJ 2021; 372: n61. https://doi.org/10.1136/bmj.n61
32. Wise J. Covid 19: arthritis drug tocilizumab reduces
deaths in hospitalised patients, study shows. BMJ 2021; 372: n433. https://doi.org/10.1136/bmj.n433
33. Bhimraj A, Morgan RL, Shumaker AH, et al. Infectious
Diseases Society of America Guidelines on the Treatment and Management of
Patients with COVID-19 March 5, 2021 Version 4.1.0. Disponible
en: www.idsociety.org/COVID19guidelines
34. Lier AJ, Tuan JL, Davis MW, et al. Case report:
disseminated strongyloidiasis in a patient with COVID-19. Am J Trop Med Hyg.
2020; 103(4): 1590-1592. https://doi.org/10.4269/ajtmh.20-0699
35. Marchese V, Crosato V, Gulletta M, et al.
Strongyloides infection manifested during immunosuppressive therapy for
SARS-CoV-2 pneumonia. Infection 2021; 49(3): 539-542. https://doi.org/10.1007/s15010-020-01522-4
36. Stauffer WM, Alpern JD, Walker PF. COVID-19 and
dexamethasone: a potential strategy to avoid steroid related strongyloides
hyperinfection. JAMA 2020; 324(7): 623-624. https://doi.org/10.1001/jama.2020.13170
37. Chalmers JD, Crichton ML, Goeminne PC, et al.
Management of hospitalised adults with coronavirus disease-19 (COVID-19): A
European Respiratory Society living guideline. Eur Respir J 2021; https://doi.org/10.1183/13993003.00048-2021 [en
prensa]
38. Tocilizumab for COVID-19. Evidence review. NICE
(National Institute for Health and Care Excellence). 15 February 2021 last
updated 24 February 2021. Disponible en: www.nice.org.uk/advice/es33
39. Ghosn L, Chaimani A, Evrenoglou T, et al.
Interleukin-6 blocking agents for treating COVID-19: a living systematic
review. Cochrane
Database Syst Rev 2021; 3: CD013881. https://doi.org/10.1002/14651858.CD013881
40. Sociedad
Argentina de Infectología. Terapéutica para SARS-CoV2. 15 de marzo de 2021.
Disponible en www.sadi.org.ar
Anexo 1. Resumen del estudio REMAP-CAP26,37
REMAP-CAP es un estudio internacional, aleatorizado,
abierto, realizado en una plataforma adaptativa. Se incluyeron pacientes
adultos con COVID-19 internados en una Unidad de Terapia Intensiva, dentro de
las 24 h del comienzo del soporte respiratorio o cardiovascular.
Los pacientes fueron aleatorizados, en forma abierta, a
recibir tocilizumab 8 mg/kg (dosis máxima 800 mg), sarilumab 400 mg (otro
anticuerpo monoclonal antagonista de IL-6) o cuidado estándar. El 93% recibió
tratamiento concomitante con corticoides. El 29% del grupo de tocilizumab
recibió una dosis adicional a las 12-24 h, a criterio del investigador.
Debido al bajo número de pacientes en la rama sarilumab
(48), solo se mostrarán los resultados para tocilizumab. El objetivo primario
fue los días libres de soporte respiratorio y cardiovascular al día 21.
Definición de soporte orgánico:
• Ventilación
mecánica
• Ventilación
no invasiva
• Cánula
nasal de alto flujo con FiO2 >0,4 y flujo >30 l/min
• Soporte
vasopresor o inotrópico
En la Tabla, se muestran los principales resultados del
estudio.
Se observaron también beneficios en otros objetivos
secundarios, como mortalidad a los 90 días, tiempo de estancia en la Unidad de
Terapia Intensiva y tiempo de hospitalización.
Los beneficios se observaron, en forma independiente,
de los niveles de proteína C reactiva. El número necesario de paciente por
tratar para evitar una muerte fue de 12.
El efecto de tocilizumab fue
mayor en pacientes que recibieron corticoides, lo que sugiere que el beneficio
de tocilizumab se produce en este subgrupo de pacientes.
Tabla
Estudio REMAP-CAP
|
Parámetro |
Tocilizumab |
Tratamiento estándar |
Razón de probabilidades (odds ratio, OR) |
|
Cantidad de pacientes |
353 |
402 |
– |
|
Intervalo hasta la inclusión Desde la hospitalización (días) Desde el ingreso en la UTI (horas) |
1.2 (0.8-2.8) 13 (6.6-19) |
1.2 (0.8-2.8) 14 (6.8-19.5) |
– |
|
Soporte respiratorio (%) CNAFO VNI VM |
29 42 29 |
27 42 30 |
– |
|
Días libres de soporte orgánico (mediana) |
10 |
0 |
1.64 (IC95% 1.25-2.14) |
|
Tasa de mortalidad hospitalaria |
28% |
36% |
↓ absoluta del 8,5% (relativa del 24%) OR 1,61 (1,25-2,14) |
|
Progresión a intubación, ECMO o muerte (sin
VM al ingresar en el estudio) |
41,3% |
52,7% |
OR 1,69 (1,7-2,42) |
UTI = Unidad de Terapia Intensiva, CNAFO =
cánula nasal de alto flujo, VNI = ventilación no invasiva, VM = ventilación
mecánica, IC95% = intervalo de confianza del 95%, ECMO = oxigenación por
membrana extracorpórea.
Anexo 2. Resumen del estudio
RECOVERY26,37
RECOVERY es una plataforma que evalúa distintas
opciones terapéuticas para la COVID-19 en una forma aleatorizada, controlada y
abierta. En esta plataforma, se evalúa, en el Reino Unido, el tratamiento con
tocilizumab más tratamiento estándar vs. tratamiento estándar (aleatorización
1:1) en pacientes con las siguientes características:
a. Hipoxia definida como: SaO2 <92% con FiO2
0,21 o requerimiento de oxígeno.
Más
b. Evidencia de inflamación sistémica (proteína C reactiva ≥75 mg/l)
En el grupo con tocilizumab, se administró tocilizumab
400-800 mg (según el peso) con la opción de una segunda dosis a las 12-48 h si
no se observaba una mejoría clínica. El 29% del grupo de tocilizumab recibió
una segunda dosis. El 82% de los pacientes recibió tratamiento concomitante con
corticoides.
Objetivo primario: mortalidad a los 28 días.
Objetivos secundarios: tiempo hasta el alta
hospitalaria vivo, progresión a ventilación mecánica o muerte (en pacientes que
no estaban en ventilación mecánica en el momento de la inclusión).
Otros objetivos complementarios
fueron: uso de ventilación no invasiva o cánula nasal de alto flujo, tiempo
hasta la liberación de la ventilación mecánica y uso de soporte dialítico. Se
incluyó a 4116 pacientes.
En la Tabla, se muestran las principales
características y los resultados del estudio.
Nota: Se observó un claro efecto sobre la tasa
de mortalidad en pacientes que recibían tratamiento con corticoides.
Los datos del estudio sugieren que el uso de
tocilizumab más corticoides podría reducir un tercio la mortalidad en pacientes
que reciben solo oxígeno y hasta un 50% en aquellos que requieren ventilación
mecánica. En definitiva, los resultados de este estudio muestran que, en
pacientes hospitalizados con COVID-19 e hipoxia más inflamación sistémica, el
uso de tocilizumab está asociado a una mejoría de la supervivencia, un aumento
de las posibilidades de alta hospitalaria vivo a los 28 días y probablemente
una reducción de la necesidad de ventilación mecánica.
También se estima que el uso de tocilizumab disminuye
en, al me , cinco días la estancia hospitalaria. Estos efectos beneficiosos se
observan sin importar el nivel de soporte respiratorio en el momento de la
inclusión en el estudio y son adicionales a los de los corticoides.
En el análisis de subgrupos,
se observó un beneficio mayor en los hombres. El número necesario de paciente
por tratar para evitar una muerte fue de 25.
Tabla
Estudio RECOVERY
|
Parámetro |
Tocilizumab |
Tratamiento
estándar |
Análisis
estadístico |
|
Cantidad de pacientes |
2022 |
2094 |
|
|
Soporte respiratorio (%) O2 (Global 45%) VNI (Global 41%) VM (Global 14%) |
46% 41% 13% |
45% 41% 14% |
|
|
Mortalidad a 28 días |
29% |
33% |
RR 0,86 (IC95% 0,77-0,96)
p = 0,007 Reducción relativa de la mortalidad del 14% |
|
Mortalidad Corticoides Sin corticoides |
27% 39% |
33% 35% |
p = 0,01 No significativo |
|
Alta hospitalaria vivo (28 días) |
54% (mediana de días 20) |
47% (mediana de días >28) |
RR 1,22 (1,12-1,34 p >0,0001 |
|
Progresión a VM o muerte (pacientes sin VM
al ingresar en el estudio) |
33% |
38% |
RR 0,85
(0,78-0,93) p = 0,0005 |
|
Requerimiento de soporte dialítico |
5% |
7% |
RR 0,75
(0,59-0,96) p = 0,02 |
|
Requerimiento de VM |
12% |
15% |
RR 0,81
(0,68-0,95) p = 0,01 |
|
Liberación de la VM |
34% |
32% |
1,07 (0,8-1,43) p = 0,64 |
VNI = ventilación no invasiva, VM =
ventilación mecánica, RR = riesgo relativo, IC95% = intervalo de confianza del
95%.
Anexo 3. Estudios aleatorizados
de tocilizumab en pacientes con COVID-19
Los autores del
estudio RECOVERY realizaron un metanálisis de ocho estudios aleatorizados
(incluidos el REMAP-CAP y el RECOVERY) y observaron una reducción del 13% de la
mortalidad a los 28 días (RR 0,87; IC95% 0,79-0,96; p = 0,005).26
Por otro lado, la
Respiratory European Society también llevó a cabo un metanálisis de los ocho
estudios aleatorizados cuyos resultados se muestran en la Tabla 1.37
Recientemente la
colaboración Cochrane también realizó un metanálisis de los estudios
aleatorizados (con más de 6000 pacientes), y se observó una disminución de la
mortalidad con tocilizumab al día 28 en comparación con placebo o tratamiento
estándar (RR 0,89; IC95% 0,82-0,97; p <0,05), con un efecto estimado de
evitar 32 muertes por 1000. No se observó un beneficio claro en otros
desenlaces, como la evolución clínica o los efectos sobre la progresión a
intubación.
Tabla 1
Resultados del metanálisis de tocilizumab en
pacientes con COVID-19
|
Parámetro |
Resultado |
|
Mortalidad |
Sin beneficio (820/3309 con tocilizumab -
24,8% vs. 893/3038 -29,4% - tratamiento estándar) OR 0,90; IC95% 0,73-1,12 Los autores reconocen que los dos estudios
con mayor número de pacientes (REMAP-CAP y RECOVERY) sí muestran una
disminución significativa de la mortalidad |
|
Progresión a ventilación mecánica o muerte |
Disminución. OR 0,74 (IC95% 0,72-0,88 - 6
estudios evaluados) |
|
Ventilación mecánica |
Reducción del 25% |
IC95% = intervalo de confianza del 95%, OR (odds
ratio) = razón de probabilidades.
Estudios aleatorizados (Respiratory
European Society)
En la Tabla 2, se muestra una comparación de las características basales
y los resultados de los estudios aleatorizados que evaluaron tocilizumab en
pacientes con COVID-19.
Tabla 2
Comparación de las características de los
estudios aleatorizados18-26,38,39
|
Estudio |
n |
Corticoides |
Gravedad2 |
Días hasta la inclusión |
Mortalidad3 |
Estancia |
Progresión:
intubación o muerte |
Soporte orgánico |
|
REMAP-CAP1 |
747 |
>90% |
Crítico |
<24 h/soporte
orgánico (0.8-2.8 días) |
↓ (Hospitalaria) |
↓ (UTI y hospital) |
↓ |
↓ |
|
RECOVERY1 |
4116 |
>80% |
Grave /crítico |
10 días (9-14 días) inicio de los síntomas 2 días de internación (1-5 días) |
¯ (28 y 90 días) |
↓ |
¯ |
¯ (diálisis) |
|
CORIMUNO-TOCI-11 |
131 |
33-61% |
Moderado /grave |
10 días (7-13
días) |
NS (28 días) |
– |
↓ ¿NS?4 |
– |
|
EMPACTA1 |
377 |
82% |
Grave |
8 días |
NS (28 días) |
NS |
↓ |
– |
|
RCT-TCZ COVID 191 |
123 |
9,8% |
Grave |
8 días (6-11
días) |
NS (28 días) |
NS |
– |
– |
|
BACC-Bay1 |
243 |
9,5% |
Grave |
9 (6-13 días) |
NS (28 días) |
– |
NS |
– |
|
TOCIBRAS1 |
129 |
>89% |
Grave/ crítico |
9-10 días |
↑con tocilizumab (21% vs. 3%)5 |
↓ |
NS |
– |
|
COVACTA1 |
452 |
36-54% |
Grave/ crítico |
10-11 días |
NS (28 días) |
↓ |
– |
– |
UTI = Unidad de Terapia Intensiva, NS = no
significativo.
1 Metodología de los estudios. Aleatorizado
abierto: REMAP-CAP, RECOVERY, CORIMUNO-TOCI-1, EMPACTA, RCT-TCZ COVID-19,
TOCIBRAS; aleatorizado doble ciego con placebo: BACC-Bay, COVACTA.
2 Gravedad: según los criterios del NIH.
3 Mortalidad. REMAP-CAP: disminución relativa
24%, absoluta 8,5%; número necesario de pacientes por tratar 12. RECOVERY:
disminución relativa 14%, absoluta 4%, número necesario de pacientes por tratar 25. Disminución de la
mortalidad de un tercio en pacientes con requerimiento de oxígeno, 50% en
pacientes con ventilación mecánica.
4 Disminución de la progresión a intubación o
muerte en el límite de significancia (cociente de riesgos instantáneos [hazard
ratio] 0,33-1,00).
5 Estudio TOCIBRAS: aumento de la mortalidad con
tocilizumab, pero pocos pacientes incluidos, pocas muertes (11 con tocilizumab,
2 en el grupo estándar) y tasa de mortalidad muy baja en el grupo estándar
(3%).
Anexo 4. Guías de uso de
tocilizumab en pacientes con COVID-19
|
Guía |
Indicaciones |
Calidad de la recomendación |
|
NHS (Reino Unido) |
- COVID-19 confirmado o
con alta sospecha (por clínica o imágenes) - En tratamiento (o que lo haya completado) con dexametasona - Sin contraindicación para el uso de tocilizumab MÁS alguna de las siguientes situaciones: • SaO2 <92% con aire ambiente/requerimiento de O2 + proteína C reactiva ≥75 mg/dl • Paciente en UTI dentro de las 24 h del comienzo del soporte respiratorio (VNI, CNAFO, VM) |
El National Institute for Health and Care Excellence (NICE) y el NHS del Reino Unido, luego de revisar la evidencia, apoyan su indicación |
|
NIH (EE.UU.) |
Usar tocilizumab + dexametasona en el paciente hospitalizado con diagnóstico de COVID-19 y alto riesgo de descompensación respiratoria (sin contraindicación para tocilizumab): • Pacientes internados recientemente (≤3 días) con menos de 24 h de internación en la UTI que requieran soporte respiratorio: - VNI - CNAFO: FiO2 >0,4 flujo >30 l/min - VM • Pacientes internados recientemente (≤3 días) en sala general que requieran VNI o CNAFO más proteína C reactiva ≥75 mg/l |
BIIa (fuerza de recomendación moderada, basada en ensayos clínicos) |
|
IDSA (EE.UU.) |
Paciente con COVID-19 con enfermedad grave progresiva (SaO2 ≤94% con FiO2 21% o requerimiento de O2) o crítica y marcadores inflamatorios elevados (proteína C reactiva ≥75 mg/dl): se recomienda tocilizumab + dexametasona |
Recomendación condicional con baja evidencia |
|
ERS (Europa) |
Ofrecer tocilizumab a pacientes hospitalizados con COVID-19 que requieren O2 o soporte respiratorio (VNI, CNAFO, VM) Se debe priorizar a: - pacientes con <24 h de iniciado el soporte respiratorio (VNI, CNAFO, VM) - pacientes con rápido escalamiento del requerimiento de O2 a pesar del tratamiento con dexametasona |
Recomendación convencional con baja evidencia |
|
Sociedad Argentina de Infectología (SADI)40 |
Considerar tocilizumab + dexametasona en pacientes con hipoxemia y aumento de marcadores inflamatorios No usar en pacientes críticos fuera de un ensayo clínico |
Por la necesidad de tratar un gran número de pacientes para obtener resultados (25) y el costo del tratamiento en nuestro país, es difícil considerar su uso en una recomendación |
NHS = National Health Service, NIH = National Institutes of
Health, IDSA = Infectious Diseases Society of America,
ERS = European
Respiratory Society, UTI = Unidad de Terapia Intensiva, VNI = ventilación
no invasiva, VM = ventilación mecánica, CNAFO = cánula nasal de alto flujo.
Anexo 5. Modelo de
consentimiento informado
Consentimiento informado para
la prescripción de tocilizumab en pacientes con neumonía grave por COVID-19
fuera de prospecto
Yo, ……………………………………………………… declaro en forma
libre y voluntaria haber sido ampliamente informado por mi médico/a tratante
sobre la necesidad de recibir el medicamento TOCILIZUMAB bajo una modalidad llamada
“fuera de prospecto u off-label”.
La indicación llamada “fuera de prospecto u off-label”
indica la posibilidad de utilizar un medicamento para una indicación distinta
por la que oficialmente se encuentra registrada y autorizada su
comercialización, en la medida en que no existan tratamientos alternativos, y
que la evolución de la afección padecida signifique una amenaza para la salud
y/o integridad y/o vida del paciente. He comprendido y manifiesto ante la
gravedad del caso (neumonía grave por COVID-19) y la falta de respuesta al
tratamiento habitual en este estadio (dexametasona) mi médico/a tratante me ha
propuesto, la utilización del medicamento denominado TOCILIZUMAB.
El Dr./Dra …………………………………………………………… me informó también que dicha
especialidad medicinal se encuentra registrada y autorizada para su
comercialización por la autoridad nacional (ANMAT) para el tratamiento de otras
enfermedades, pero que sin embargo me informa que su uso se encuentra en etapa
experimental para esta enfermedad en una fase avanzada y que por medio de esa
droga se espera un beneficio potencial en mi salud.
Se me ha explicado, y he comprendido que, por el
momento para mi profesional tratante y para otros especialistas en la materia
esta indicación es una de las pocas alternativas terapéuticas disponibles para
el tratamiento de mi dolencia.
TOCILIZUMAB es un medicamento que inhibe una de las
vías del proceso inflamatorio que se produce en los casos más graves de
COVID-19.
TOCILIZUMAB se ha usado ampliamente durante muchos años
en enfermedades inflamatorias como la artritis reumatoidea, artritis idiopática
juvenil sistémica y artritis idiopática juvenil poliarticular.
TOCILIZUMAB le será administrado una sola vez por vía
endovenosa, la dosis varía según el peso corporal.
Debido a que es un fármaco antinflamatorio podría
aumentar el riesgo de infecciones, pero en los estudios recientes realizados en
pacientes con COVID-19 (más de 5000 pacientes), los procesos infecciosos fueron
muy raros.
Otras reacciones adversas poco frecuentes son la
disminución de glóbulos blancos en la sangre, inflamación del hígado, náuseas,
vómitos, diarrea, diverticulitis, perforación gastrointestinal, exantema
(reacción alérgica en la piel). Pueden producirse otras reacciones muy poco
frecuentes que le serán explicadas por su médico.
El equipo médico tratante realizará un monitoreo estricto de su estado de
salud para detectar y tratar precozmente las eventuales reacciones adversas.
He comprendido que la prescripción de este fármaco se
realiza para evitar un deterioro progresivo y significativo en mi salud, que
puede traer complicaciones graves, como la afectación de mi vida, la invalidez
o un serio deterioro de mi calidad de vida.
El médico/a tratante me ha informado y he comprendido
que existe suficiente evidencia médica y una razonable relación
riesgo/beneficio sobre las características de la droga que se me indica, razón
por la cual consiento expresamente a que me sea prescripto esta medicación.
Declaro, además, que he realizado todas las preguntas
referidas a dicha especialidad medicinal, y que las mismas han sido debidamente
respondidas por la Dra /Dr. ……………………………………………….....…, habiendo comprendido los
beneficios, riesgos y ausencia de alternativas disponibles al tratamiento
propuesto, consiento en forma libre y esclarecida la indicación de TOCILIZUMAB.
Se me ha entregado una copia de este consentimiento informado.
Firma y aclaración del paciente o representante legal
Firma
y aclaración del médico
Anexo 6. Lista de verificación
para el uso de tocilizumab
|
Disponibilidad de tocilizumab |
SÍ |
NO |
|
Criterios para considerar el uso de tocilizumab* |
SÍ |
NO |
|
Contraindicaciones para tocilizumab |
SÍ |
NO |
|
Evaluación favorable del riesgo/beneficio por el equipo médico |
SÍ |
NO |
|
Evaluación favorable por parte del comité de ética en investigación local |
SÍ |
NO |
|
Firma del consentimiento informado |
SÍ |
NO |
Nota: para considerar el uso de tocilizumab todos los ítems deben estar marcados como “SÍ”.
Criterios para considerar el uso de
tocilizumab
|
Criterios de elegibilidad: • Pacientes con COVID-19 confirmado
hospitalizados y • Evidencia de neumonía por COVID-19 y • En tratamiento con dexametasona 8 mg/día EV
(o dosis equivalente de corticoides) y • Evolución del cuadro ≤10 días y • Sin contraindicaciones para la
administración de tocilizumab Más una de las siguientes situaciones: 1. Paciente en una UTI: dentro de las 24 h del
requerimiento de soporte respiratorio (ventilación mecánica invasiva,
ventilación no invasiva, cánula nasal de alto flujo con FiO2
>0,4 y flujo >30 l/min). Se debe priorizar a pacientes con
internación reciente en la UTI (<24 h). 2. Paciente en Sala (en algunos centros de
salud de nuestro país, estos pacientes son internados, con frecuencia, en la
UTI para un mejor control) que presenta: - SaO2 ≤92% con FiO2
0,21 más proteína C reactiva ≥75 mg/l - Requerimiento de O2
más
proteína C reactiva ≥75 mg/l En estos casos, se debe priorizar a
pacientes con internación reciente (≤3 días) y con rápido escalamiento del
soporte respiratorio a ventilación no invasiva o cánula nasal de alto flujo,
a pesar del uso de dexametasona. |