Síndrome urémico hemolítico atípico secundario
a la infección por SARS-CoV-2. A propósito de un caso
[Atypical hemolytc uremic syndrome secondary
to SARS-CoV-2 infection. A case report]
David Roa-Alonso,* Alberto Mohedano-Gómez, Francisco Muñoyerro-González, Alberto
Orejas-Gallego
Unidad de Cuidados Intensivos, Hospital
Universitario “Severo Ochoa”, Leganés, Madrid, España
* Correspondencia: roadavid_88@hotmail.com
Los
autores no declaran conflictos de intereses.
Resumen
El síndrome urémico hemolítico atípico es un
trastorno perteneciente al espectro de las microangiopatías trombóticas
desencadenado por una alteración en la regulación de la vía alternativa del
complemento. Presentamos a un hombre de 72 años, con diagnóstico de síndrome
urémico hemolítico atípico secundario a la infección por SARS-CoV-2. Durante su
estancia en la Unidad de Cuidados Intensivos, tuvo anemia hemolítica no
autoinmune, trombocitopenia, insuficiencia renal aguda anúrica que requirió
terapia de reemplazo renal y actividad de ADAMTS 13 dentro de los parámetros
normales. No se pudo iniciar el tratamiento con eculizumab debido a la
evolución rápidamente catastrófica del paciente, cuya
situación clínica progresó hacia la disfunción multiorgánica y el óbito. Conclusión: El síndrome urémico hemolítico atípico es un
cuadro extremadamente raro que requiere un alto nivel de sospecha. No obstante,
se dispone de un tratamiento específico que puede mejorar el pronóstico y
disminuir la mortalidad de los pacientes.
Palabras clave: Síndrome urémico hemolítico atípico; COVID-19;
anemia microangiopática; anemia hemolítica; síndrome de dificultad respiratoria aguda.
Abstract
Atypical hemolytic uremic syndrome is an entity
that belongs to the thrombotic microangiopathy disorders, triggered by an
alteration in the alternative complement pathway. We present the case of a 72-year-old
male patient with a diagnosis of atypical hemolytic uremic syndrome secondary
to SARS-CoV-2 infection. In the Intensive Care Unit, he had autoimmune
hemolytic anemia, thrombocytopenia, acute anuric renal failure requiring
replacement therapy and ADAMTS 13 activity within normal values. Eculizumab
could not be administered due to the sudden evolution towards multiple organ
failure syndrome and death. Conclusion: Atypical hemolytic uremic syndrome is an
extremely rare disorder which requires a high level of suspicion. However, it
can be effectively treated improving the prognosis and reducing mortality of
the patients.
Key words: Atypical hemolytic uremic syndrome; COVID-19;
microangiopathic anemia; hemolytic anemia; acute respiratory distress syndrome.
Introducción
La infección por SARS-CoV-2 afecta, de
manera predominante, al sistema respiratorio y puede causar síndrome de
dificultad respiratoria aguda, aunque, en ocasiones, también puede afectar a
otros órganos y sistemas, como el cardiovascular, gastrointestinal,
hematológico, nervioso y renal. El evento fisiopatológico que desencadena estos procesos tiene sus
raíces en la hiperactivación del sistema inmunitario con tormenta de citocinas
y la activación excesiva de la vía alternativa del complemento, en la forma
atípica,1 que conduce a la
disfunción endotelial y a la subsiguiente microangiopatía trombótica, sustrato
fundamental del síndrome urémico hemolítico atípico (SUHa), con compromiso de
distintos órganos en intensidad variable.2 Esta cascada de procesos puede progresar hacia el síndrome de
disfunción multiorgánica y, finalmente, al óbito.3
Presentación
del caso
Hombre de 72 años con antecedentes de
hipertensión arterial, diabetes mellitus tipo 2 en tratamiento con
antidiabéticos orales y obesidad (índice de masa corporal 35) que acudió al
Servicio de Urgencias por fiebre persistente de dos semanas de evolución y
disnea progresiva. En la radiografía de tórax, se observó el compromiso de
ambos pulmones con un patrón de aumento de la densidad alveolo-intersticial
difuso. Los resultados de los análisis bioquímicos iniciales fueron: creatinina
3,11 mg/dl, urea 122 mg/dl, lactato deshidrogenasa 511 U/l, hemoglobina 9,6
g/dl, plaquetas 231.000/µl y bilirrubina total 0,8 mg/dl. La reacción en cadena
de la polimerasa para SARS-CoV-2 en el aspirado nasofaríngeo resultó positiva y
los antígenos en orina
para Legionella y neumococo fueron negativos. Con diagnóstico de
neumonía adquirida en la comunidad secundaria a la infección por SARS-CoV-2, ingresó en la Unidad de Cuidados Intensivos para soporte
respiratorio.
Durante los primeros días, la tolerancia a las medidas no invasivas con cánulas nasales de alto flujo fue excelente. No obstante, a partir del cuarto día, se produjo un deterioro general y el paciente requirió intubación orotraqueal y conexión a ventilación mecánica invasiva, tenía anemia progresiva (Figura 1), disminución de la cantidad de plaquetas (Figura 2), empeoramiento de la función renal con aumento de creatinina (Figura 3) y urea, y tendencia a la oliguria que requirió terapia continua de reemplazo renal. Además, llamaba la atención la progresiva elevación de las cifras de lactato deshidrogenasa, mayor que lo esperable tratándose de un paciente con COVID-19.
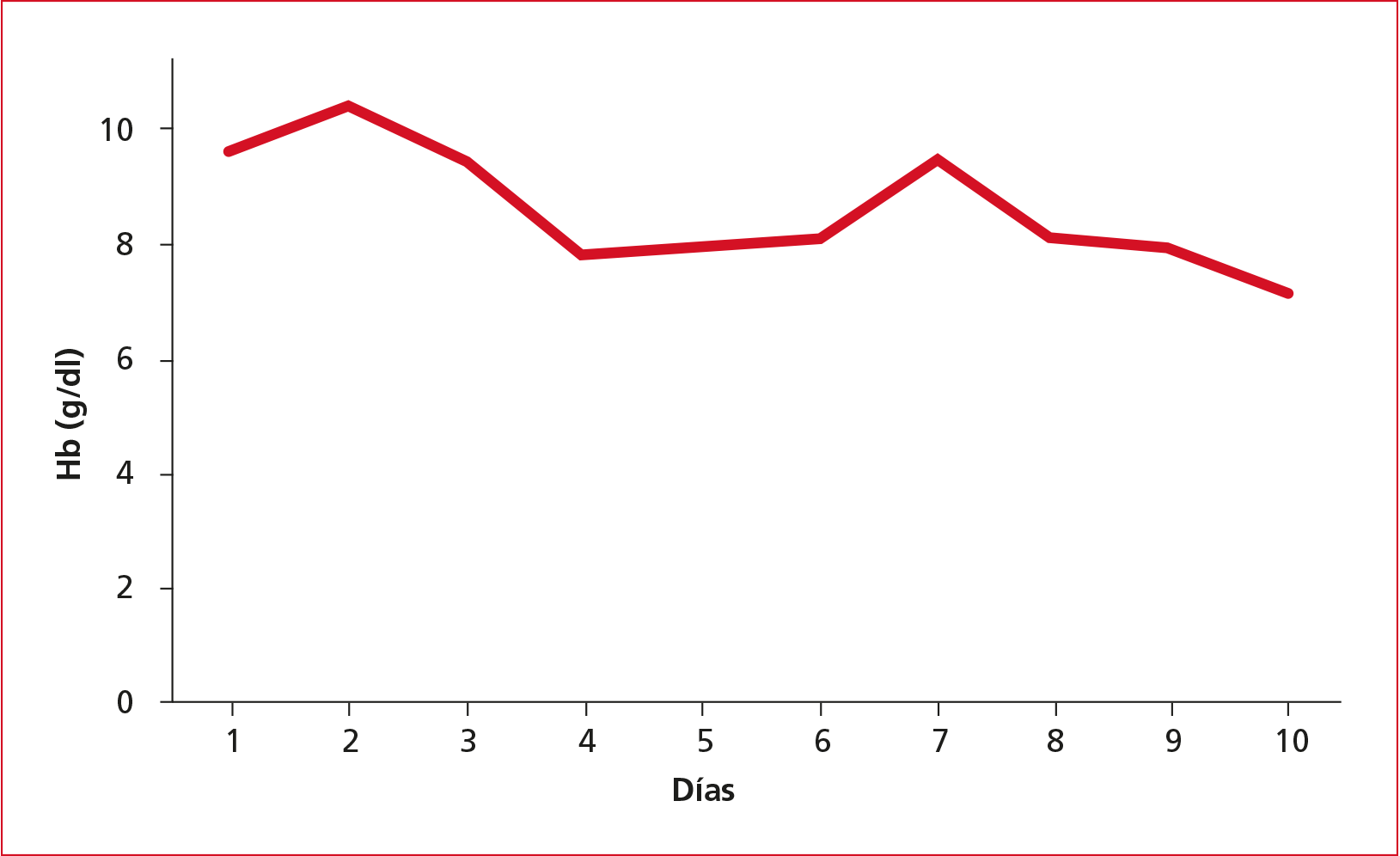
Figura 1. Evolución de las cifras de
hemoglobina (Hb) durante la estancia del paciente en la Unidad de Cuidados
Intensivos.
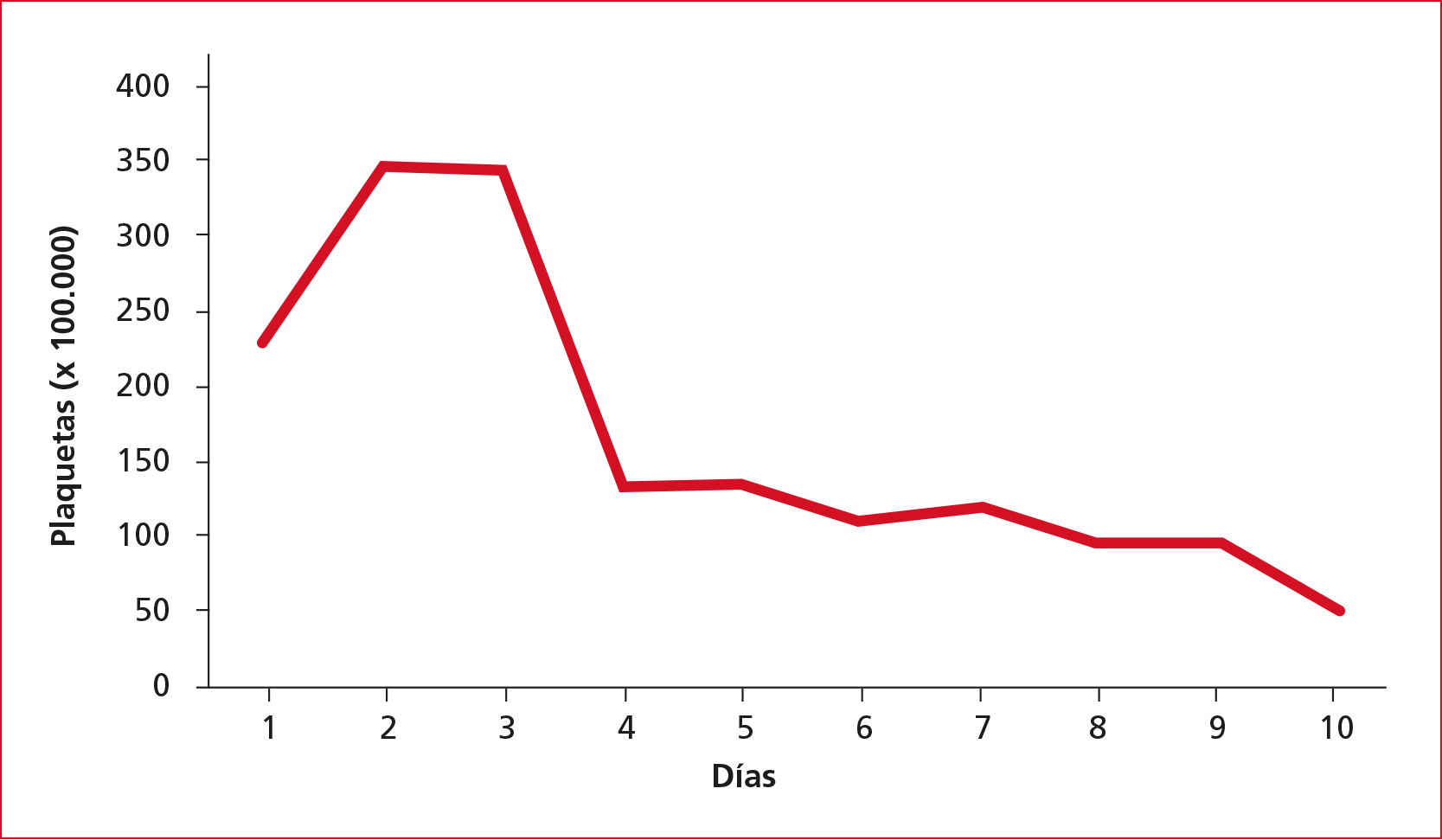
Figura 2. Evolución de la cifra de plaquetas
durante la estancia del paciente en la Unidad de Cuidados Intensivos.
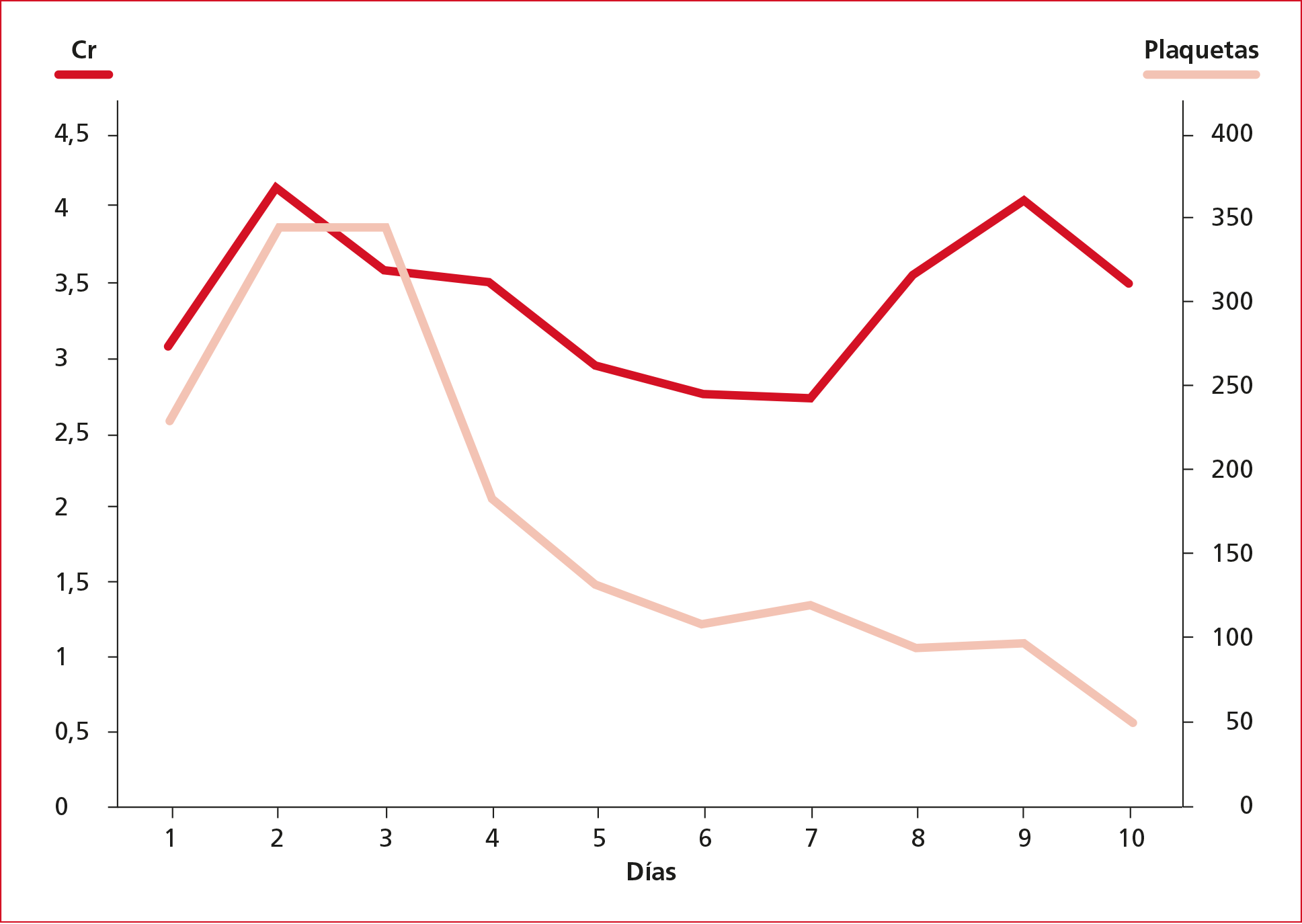
Figura 3. Evolución de las cifras de
creatinina (Cr) y plaquetas del paciente durante la estancia en la Unidad de
Cuidados Intensivos.
Se realizó una angiotomografía
toracoabdominal que descartó focos de sangrado activo o hematomas internos.
De esta forma, el contexto previamente
expuesto de anemia y trombopenia progresivas con empeoramiento del daño renal y
lactato deshidrogenasa excesivamente elevada, sugería la posibilidad de un
proceso microangiopático.
El frotis mostró esquistocitos en sangre periférica en cantidad significativa (5/campo) sin agregados plaquetarios, la haptoglobina estaba baja, 20 mg/dl (normal 30-200 mg/dl) y el test de Coombs fue negativo, por lo que se descartó la autoinmunidad como causa de la hemólisis. Las pruebas de coagulación eran normales. Respecto a la trombocitopenia, los anticuerpos antiheparina fueron negativos y, para descartar púrpura trombocitopénica trombótica (PTT), se solicitó una prueba de ADAMTS13 que resultó del 43% (normal). El estudio del complemento reveló C3 ligeramente disminuido de 75,9 mg/dl (84-164 mg/dl) y C4 de 12,8 mg/dl (10-40 mg/dl). El estudio de crioglobulinas fue negativo (Tabla).
Tabla
Evolución de los parámetros durante la
estancia del paciente en la Unidad de Cuidados Intensivos
|
|
Día 1 |
Día 2 |
Día 3 |
Día 4 |
Día 5 |
Día 6 |
Día 7 |
Día 8 |
Día 9 |
Día 10 |
|
Urea (mg/dl) |
122 |
180 |
256 |
324 |
333 |
346 |
315 |
349 |
371 |
271 |
|
Creatinina (mg/dl) |
3,11 |
4,18 |
3,60 |
3,53 |
2,97 |
2,77 |
2,76 |
3,60 |
4,08 |
3,51 |
|
Hemoglobina (g/dl) |
9,6 |
10,4 |
9,40 |
7,80 |
8,0 |
8,10 |
9,50 |
8,10 |
7,90 |
7,10 |
|
Bilirrubina (mg/dl) |
0,8 |
|
|
|
0,7 |
|
0,40 |
0,8 |
|
1,3 |
|
Plaquetas (x 100.000) |
231 |
346 |
345 |
185 |
133 |
110 |
121 |
97 |
99 |
51 |
|
Lactato deshidrogenasa mg/dl |
511 |
441 |
|
757 |
615 |
621 |
548 |
|
1211 |
1111 |
|
ADAMTS13 (%) |
|
|
|
43 |
|
|
|
|
|
|
|
Haptoglobina (mg/dl) |
|
|
|
|
|
20 |
|
|
|
|
|
Anticuerpos antiheparina |
|
|
|
|
|
Negativo |
|
|
|
|
|
Complemento (mg/dl) |
|
|
|
C3 75,9 C4 12,8 |
|
|
|
|
|
|
|
Crioglobulinas |
|
|
|
|
|
Negativo |
|
|
|
|
Tras descartar otros
procesos, como PTT (la actividad de ADAMTS 13 era normal), púrpura trombocitopénica
idiopática (había anemia y esquistocitos), trombocitopenia inducida por
heparina (no había anticuerpos antiheparina) y coagulación intravascular
diseminada (los tiempos de coagulación eran normales), se consideró el
diagnóstico de SUHa en relación con la infección por SARS-CoV-2. Se prescribió
eculizumab y se lo solicitó al Servicio de Farmacia, pero no fue posible
administrarlo debido a la catastrófica evolución del paciente hacia la
disfunción multiorgánica y el óbito antes de disponer del medicamento.
Discusión
Estamos conscientes de la limitación
inherente a la presentación de un único caso, pero creemos que este sirve como
ilustración y llamada de atención sobre la posibilidad de este proceso en
coincidencia con el del SARS-CoV-2, por su potencial letalidad y la
disponibilidad de un tratamiento exitoso.
La incidencia de lesión renal aguda en
los pacientes con COVID-19 varía en función de las series. Tomando como
referencia la de Cheng et al,4 el 7% de los pacientes hospitalizados desarrolló daño
renal agudo que se asoció con una tasa de mortalidad del 45% respecto de la de
aquellos que no lo tuvieron (7%).5
Al igual que el daño alveolar producido
en el pulmón por acción del SARS-CoV-2, el riñón también sufre las
consecuencias del ataque viral, que se manifiesta con daño tubular y lesión
glomerular, inclusive un daño viral directo por invasión de las células
tubulares.6 Asimismo, se han
observado lesiones de microangiopatía trombótica de tipo SUHa secundarias a una
infección por SARS-CoV-2,5
proceso que nos ocupa en este artículo.
La microangiopatía trombótica es
un síndrome poco frecuente que abarca el espectro de dos entidades bien
diferenciadas: el SUH típico y SUHa, y la PTT.7
La lesión renal en el SUH es secundaria
al daño de la célula endotelial por la toxina Shiga en el caso del SUH típico,
o por otras causas, como tumores, fármacos, embarazo o infecciones virales en
el caso del SUHa. Independientemente del evento precipitante, tanto en el SUH
típico como en el SUHa, la lesión del endotelio provoca engrosamiento e
inflamación vascular, depósito de proteínas en arteriolas y capilares, y
trombos plaquetarios.8
De esta forma, se produce la rotura mecánica de los eritrocitos cuando pasan a
través de los capilares tortuosos y, en los análisis de laboratorio, se
manifiesta con esquistocitos en el frotis de sangre periférica, con un test de
Coombs negativo (hemólisis no autoinmune), haptoglobina disminuida y lactato
deshidrogenasa elevada.
Respecto al componente genético que
predispone al SUHa, la pérdida de la regulación de la actividad del complemento
sobre las superficies celulares debido a mutaciones en los genes que codifican
el factor H, una proteína del plasma que actúa controlando la homeostasis del
sistema del complemento, provoca daño endotelial, inflamación y la trombosis
secundaria.9 Estas mutaciones
se han observado en el 40-60% de los pacientes con SUHa.10
La PTT es consecuencia de la deficiencia
grave de la actividad metaloproteasa ADAMTS13, enzima encargada de fragmentar
los multímeros ultralargos del factor de von Willebrand.11
Después de esta perspectiva global y
breve sobre la microangiopatía trombótica y su espectro, volvamos al tema que
nos ocupa, el SUHa por SARS-CoV-2. Se ha propuesto que el evento
fisiopatológico fundamental en el SUHa (tanto en las formas primarias como en
las secundarias) es la hiperactivación del complemento, como queda expuesto en
el reporte de un paciente infectado por SARS-CoV-2 que sufrió insuficiencia
respiratoria y erupción purpúrica, y tenía depósitos de proteína de la cascada
del complemento dentro de la microvasculatura, como hallazgos tisulares de piel
y pulmones, lo que sugiere la activación sistémica de la vía del complemento
por la COVID-19.12
Así mismo, aunque no es del todo conocido, se han propuesto otros mecanismos
por los que el SARS-CoV-2 puede precipitar el SUHa, como la activación directa
de la vía alternativa del complemento por la proteína de la espícula13 y el daño endotelial directo causado por el virus.14 De esta forma, la agresión sobre el endotelio tisular mediada por
cualquiera de estos mecanismos dispara la cascada de eventos propias del SUHa.
El SUHa se trata con eculizumab, un
anticuerpo monoclonal IgG humanizado recombinante que inhibe la activación del
complemento, mejorando el pronóstico y disminuyendo la morbimortalidad de los
pacientes.15
Conclusiones
El caso presentado pone de manifiesto
una entidad muy poco frecuente en la Unidad de Cuidados Intensivos y, por ello,
difícil de diagnosticar. No obstante, la tríada característica de anemia
hemolítica no inmune, trombopenia e insuficiencia renal aguda, en el contexto
clínico adecuado, nos debe poner en alerta sobre la posibilidad de este cuadro,
el SUHa, ya que se dispone de un tratamiento específico que, aplicado a tiempo,
disminuye de forma importante la morbimortalidad asociada a este síndrome.
Bibliografía
1.
Gill J,
Hebert CA, Colbert GB. COVID-19-associated atypical hemolytic uremic syndrome
and use of eculizumab therapy. J Nephrol 2022; 35(1): 317-321. https://doi.org/10.1007/s40620-021-01125-8
2.
Kurian
CJ, French Z, Kukulich P, et al. Case series: coronavirus disease 2019
infection as a precipitant of atypical hemolytic uremic syndrome: two case
reports. J Med Case Rep 2021; 15(1): 587. https://doi.org/10.1186/s13256-021-03144-2
3.
Mokhtari
T, Hassani F, Ghaffari N, Ebrahimi B, Yarahmadi A, Hassanzadeh G. COVID-19 and
multiorgan failure: A narrative review on potential mechanisms. J Mol
Histol 2020; 51(6): 613-628. https://doi.org/10.1007/s10735-020-09915-3
4.
Cheng
Y, Luo R, Wang X, et al. The
incidence, risk factors, and prognosis of acute kidney injury in adult patients
with coronavirus disease 2019. Clin J Am Soc Nephrol 2020; 15(10): 1394-1402. https://doi.org/10.2215/CJN.04650420
5.
Chan L,
Chaudhary K, Saha A, et al. Acute kidney injury in hospitalized patients with
COVID-19. J Am Soc Nephrol 2020; 32(1): 151-160 . https://doi.org/10.1681/ASN.2020050615
6.
Ronco C, Reis T, Husain-Syed F. Management of acute kidney injury in
patients with COVID-19. Lancet Respir Med 2020; 8(7): 738-742. https://doi.org/10.1016/S2213-2600(20)30229-0
7.
George JN, Nester CM. Syndromes of thrombotic microangiopathy. N Engl J
Med 2014; 371(7): 654-666. https://doi.org/10.1056/NEJMra1312353
8.
Noris M,
Remuzzi G. Atypical hemolytic-uremic syndrome. N Engl J Med 2009; 361:
1676-1687. https://doi.org/10.1056/NEJMra0902814
9.
de
Córdoba SR, de Jorge EG. Translational mini-review series on complement factor
H: genetics and disease associations of human complement factor H. Clin Exp
Immunol 2008; 151(1): 1-13. https://doi.org/10.1111/j.1365-2249.2007.03552.x
10. Sellier-Leclerc AL, Fremeaux-Bacchi V, Dragon-Durey
MA, et al. French Society of Pediatric Nephrology. Differential impact of
complement mutations on clinical characteristics in atypical hemolytic uremic
syndrome. J Am Soc Nephrol 2007; 18(8): 2392-2400. https://doi.org/10.1681/ASN.2006080811
11. Loirat C, Fakhouri F, Ariceta G, et al. An
international consensus approach to the management of atypical hemolytic uremic
syndrome in the children. Pediatr Nephrol. 2016; 31(1): 15-39. https://doi.org/10.1007/s00467-015-3076-8
12. Tulli G. Diagnosis and management of sepsis and septic
shock: an evidence-based review. En: Chiumello D (ed). Practical trends in anesthesia and intensive care
2018. Springer, Cham; 2019. https://doi.org/10.1007/978-3-319-94189-9_9
13. Yu J, Yuan X, Chen H, Chaturvedi S, Braunstein EM,
Brodsky RA. Direct activation of the alternative complement pathway by
SARS-CoV-2 spike proteins is blocked by factor D inhibition. Blood 2020;
136(18): 2080-2089. https://doi.org/10.1182/blood.2020008248
14. Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary
vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J
Med 2020; 383(2): 120-128. https://doi.org/10.1056/NEJMoa2015432
15. Ficha técnica del Centro de Información de Medicamentos de la AEMPS.-CIMA. Madrid,
España: Agencia Española de Medicamentos y Productos Sanitarios
(AEMPS).