Actualización en infecciones intrabdominales. Manejo en la Unidad de
Terapia Intensiva
[Update on intra-abdominal infections. Management in the Intensive Care
Unit]
Cecilia Domínguez, Yesica Lamberto,
Pablo Saúl, Carina Balasini, Paula Juárez, Ana L. González, Darío Godoy, Sonia
Vélez, Eduardo Serra, Analía De Cristofano, Monserrat Lloria, Victoria Sánchez,
Soledad Areso, Leandro Aguirre, Sofia Esposto, María Cecilia García, María
Candela Llerena, Marisol García-Sarubbio, Mariela Velázquez, Marco Flores
Montes, Laura Sabater, Analía Palaoro, Gabriela Sheehan, Cecilia Pereyra, Juan
Videla, Mónica Lares, Wanda Cornistein, Florencia Gil, Belén Guzmán, Juan
Amico, María Flor Sainz-Lastra, Mariela Porcelli, Analía Costa, Silvina Neyro,
Facundo Arguello, Alberto Cremona, Javier Farina, Viviana Chediack,* Miriam Blanco, Eleonora Cunto
Comité de Infectología Crítica, Sociedad Argentina de Terapia
Intensiva, Ciudad Autónoma de Buenos Aires, Argentina
* Correspondencia:
vchediack@hotmail.com
Los autores no declaran conflictos de intereses.
Resumen
Las
infecciones intrabdominales representan una causa importante de
morbimortalidad. Su manejo requiere un enfoque multidisciplinario que involucra
a médicos intensivistas y un equipo quirúrgico. El tratamiento de las
infecciones intrabdominales complicadas implica tanto la terapia
antimicrobiana, como el control quirúrgico del foco. La elección del agente
antimicrobiano debe basarse tanto en la gravedad de la infección como en los
factores de riesgo para patógenos resistentes, la flora local y los
antecedentes individuales. Cuando se presentan con sepsis y shock séptico
aumenta la tasa de mortalidad hasta el 60%. El diagnóstico y el tratamiento
adecuados y precoces son los pilares fundamentales para mejorar los resultados.
Ante la morbimortalidad de este cuadro en la práctica diaria de atención de
pacientes adultos, se decide confeccionar esta actualización sobre
clasificación, diagnóstico y manejo terapéutico. Se realizó una búsqueda
bibliográfica en PubMed, Medline y Cochrane, desde 2000 hasta 2021 y en
consensos de sociedades científicas.
Palabras clave: Infecciones abdominales; candidiasis
intrabdominal; peritonitis secundaria; plastrón apendicular; bolsa de Bogotá.
Abstract
Intra-abdominal
infections represent an important cause of morbidity and mortality. Its
management requires a multidisciplinary approach that involves intensive care physicians
and a surgical team. Treatment of complicated intra-abdominal infections
involves both antimicrobial therapy and surgical control of the focus. The
choice of antimicrobial agents should be based on both the severity of the
infection and the risk factors for resistant pathogens, local flora, and
individual history. When they present with sepsis and septic shock, mortality
increases up to 60%. An adequate and early diagnosis and treatment are the
cornerstone to improve results. Given the importance of this pathology in the
daily practice of adult patient care, it was decided to prepare this update on
classification, diagnosis and therapeutic management. A bibliographic search
was carried out in PubMed, Medline, and Cochrane from 2000 to 2021 and consensuses
of scientific societies.
Keywords: Abdominal infections; intra-abdominal
candidiasis; secondary peritonitis; appendicular plastron; Bogotá bag.
Introducción
Las
infecciones intrabdominales (IIA) representan diversos procesos patológicos
intra- y retroperitoneales, con un amplio espectro de enfermedad que abarca
desde infecciones simples y sin complicaciones hasta infecciones graves con
shock.
La IIA
complicada (IIAc) sigue siendo un problema grave en todo el mundo, ocupa el
primero o segundo lugar entre los focos de sepsis o shock séptico y es la
segunda causa de ingreso en las unidades de terapia intensiva.
Existe una
amplia variedad de entidades clínicas dentro de las IIA. Además de la formación
local de abscesos o la infección de órganos sólidos, puede extenderse al
peritoneo y producir peritonitis.
El
diagnóstico microbiológico no es sencillo, ya que los cultivos no siempre
pueden discriminar fácilmente los verdaderos patógenos de los microorganismos
inocuos.
El mejor
tratamiento antibiótico puede fracasar si el control del foco de la infección
es deficiente o difícil de lograr; por otro lado, el inicio rápido de una
terapia antimicrobiana adecuada ayuda a mejorar los resultados. Representan el
10-15%, lo cual implica una tasa de mortalidad del 10% y el 40%,
respectivamente, que aumenta hasta el 60% en pacientes con comorbilidades, de
edad avanzada o cuando hay bacterias resistentes.
El manejo es
multidisciplinario, y se basa en cuatro pilares principales: reanimación
adecuada en los pacientes sépticos, tratamiento quirúrgico para el control del
foco, diagnóstico y tratamiento antimicrobiano precoces y adecuados.
Por ser una
de las primeras causas de sepsis y de muerte en las unidades de terapia
intensiva, esta actualización tiene por objetivo actualizar el conocimiento de
la clasificación, el diagnóstico y la terapéutica, aportando herramientas que
permitirán al intensivista mejorar la morbimortalidad de los pacientes.
Materiales y Métodos
Se realizó
una búsqueda bibliográfica en PubMed, Medline y Cochrane,
utilizando palabras clave en inglés y español, considerando un intervalo de
tiempo entre 2000 y 2021. Se tuvieron en cuenta revisiones, consensos,
revisiones sistemáticas, estudios aleatorizados y las recomendaciones de la
Sociedad Argentina de Infectología publicadas en 2018.
Definiciones y clasificación
Las IIA se
producen, en general, por perforación o inflamación de la pared intestinal, a
veces, por vía hematógena, inoculación o extensión de procesos supurados por
contigüidad. Comprenden:
a. Los abscesos: intraperitoneales,
de las vísceras abdominales, retroperitoneales y del psoas;
b. Las peritonitis: primarias,
secundarias y terciarias.
- La peritonitis primaria
comprende la peritonitis bacteriana espontánea, la asociada a diálisis
peritoneal y la peritonitis tuberculosa, a diferencia del resto de los procesos
intrabdominales, requiere solo tratamiento médico.
- La peritonitis secundaria
resulta de la pérdida de la integridad del tracto gastrointestinal, es
consecuencia de una perforación (traumática, quirúrgica, espontánea, isquémica)
o la extensión de un proceso supurado.
- La peritonitis terciaria
representa una peritonitis secundaria que dura más tiempo y alberga otros
patógenos (seleccionados y más resistentes).
Tanto las
peritonitis secundarias como las terciarias requieren tratamiento combinado
médico y quirúrgico.
c. Las infecciones de la vía biliar,
del apéndice y la enfermedad diverticular.
Un mismo proceso
puede desencadenar un cuadro leve de rápida resolución con diagnóstico precoz y
tratamiento adecuado, como la apendicitis aguda, hasta un cuadro grave con
shock séptico, como la peritonitis apendicular.
Se clasifican
de acuerdo con: la extensión, el origen de adquisición5,6 y la gravedad (Tabla 1).
Tabla 1
Clasificación de las infecciones
intrabdominales
|
Extensión |
No complicadas |
El proceso infeccioso involucra solo el
órgano de origen, puede progresar a complicada si no se indica el tratamiento
adecuado |
|
Complicadas |
Extensión más allá del órgano, a la cavidad
peritoneal y causa peritonitis difusa o localizada, como los abscesos |
|
|
Origen de adquisición |
Adquirida en la comunidad |
Su comienzo ocurre fuera del ámbito de
cuidado de la salud e implica ausencia de resistencia a antimicrobianos |
|
Asociada a cuidados de la salud |
Puede ocurrir fuera del hospital, pero se da
en pacientes con factores de riesgo (procedimientos invasivos, antecedente de
colonización/infección por gérmenes multirresistentes, cirugía,
hospitalización, hemodiálisis o residencia en institución de cuidados
crónicos en los últimos 12 meses). Las infecciones hospitalarias aparecen
después de 48 h de internación y la mayoría se debe a infecciones
posoperatorias. En estos casos, predominan gérmenes resistentes y levaduras6 |
|
|
Gravedad |
De leve a moderada |
Cuando no cumple criterios de grave |
|
Grave |
Cuando se presenta con sepsis o shock
séptico, APACHE II ≥15 puntos, ácido láctico ≥2 mmol/l |
La definición de sepsis fue revisada recientemente y define a una
disfunción orgánica que pone en peligro la vida y es causa de una respuesta desregulada
del huésped a la infección. El shock se define como un subconjunto de sepsis
donde las anomalías circulatorias, metabólicas y celulares se asocian con mayor
riesgo de muerte y se identifica mediante el requerimiento de agentes
vasopresores para mantener una presión arterial media de 65 mmHg o más, un
nivel de lactato sérico >2 mmol/l sin hipovolemia.7
Microbiología de las IIA comunitarias e
intrahospitalarias (Tabla 2, Figura 1)
Diagnóstico microbiológico
No está
indicado el cultivo del material quirúrgico intraoperatorio para las IIA de
leves a moderadas, porque los esquemas empíricos contemplan los gérmenes
involucrados, sí se recomienda
para las infecciones graves, de origen hospitalario, enfermos críticos y en
inmunodeprimidos en quienes es muy importante identificar los microorganismos y
la sensibilidad antibiótica para adecuar el tratamiento empírico inicial.5-8
Los
hemocultivos no se recomiendan de forma rutinaria para pacientes con IIA de la
comunidad leve o moderada. Se deben realizar hemocultivos en pacientes con
IIAc o intrahospitalaria grave, en particular aquellos con sepsis concomitante
o inmunocompromiso, para confirmar si hay bacteriemia.9
Tabla 2
Microbiología de las infecciones
intrabdominales
|
|
|
IIA adquirida en la comunidad (%) |
IIA intrahospitalaria (%) |
|
Bacteriología (%) |
|
|
|
|
Bacilos gramnegativos aerobios 58,6% |
Escherichia coli |
36 |
35-36 |
|
Klebsiella pneumoniae |
8,6 |
7-9% |
|
|
Enterobacter |
2,3 |
1,2-1,9 |
|
|
Pseudomonas aeruginosa |
6,2 |
6,7-7,1 |
|
|
Cocos grampositivos 39,4% |
Enterococcus spp |
26,1 |
25,1-26,2 |
|
Streptococcus spp |
6,6 |
5,5 |
|
|
Staphylococcus spp |
10,4 |
9,1-9,8 |
|
|
Anaerobios 11,7% |
Bacteroides fragilis |
6,9 |
3,5-4,8 |
|
Clostridium |
0,5-1,1 |
0,2-1,3 |
|
|
Prevotella |
0,5 |
0,2 |
|
|
Hongos 13% |
Candida spp |
13 |
12,8-14,3 |
IIA = infección intrabdominal.
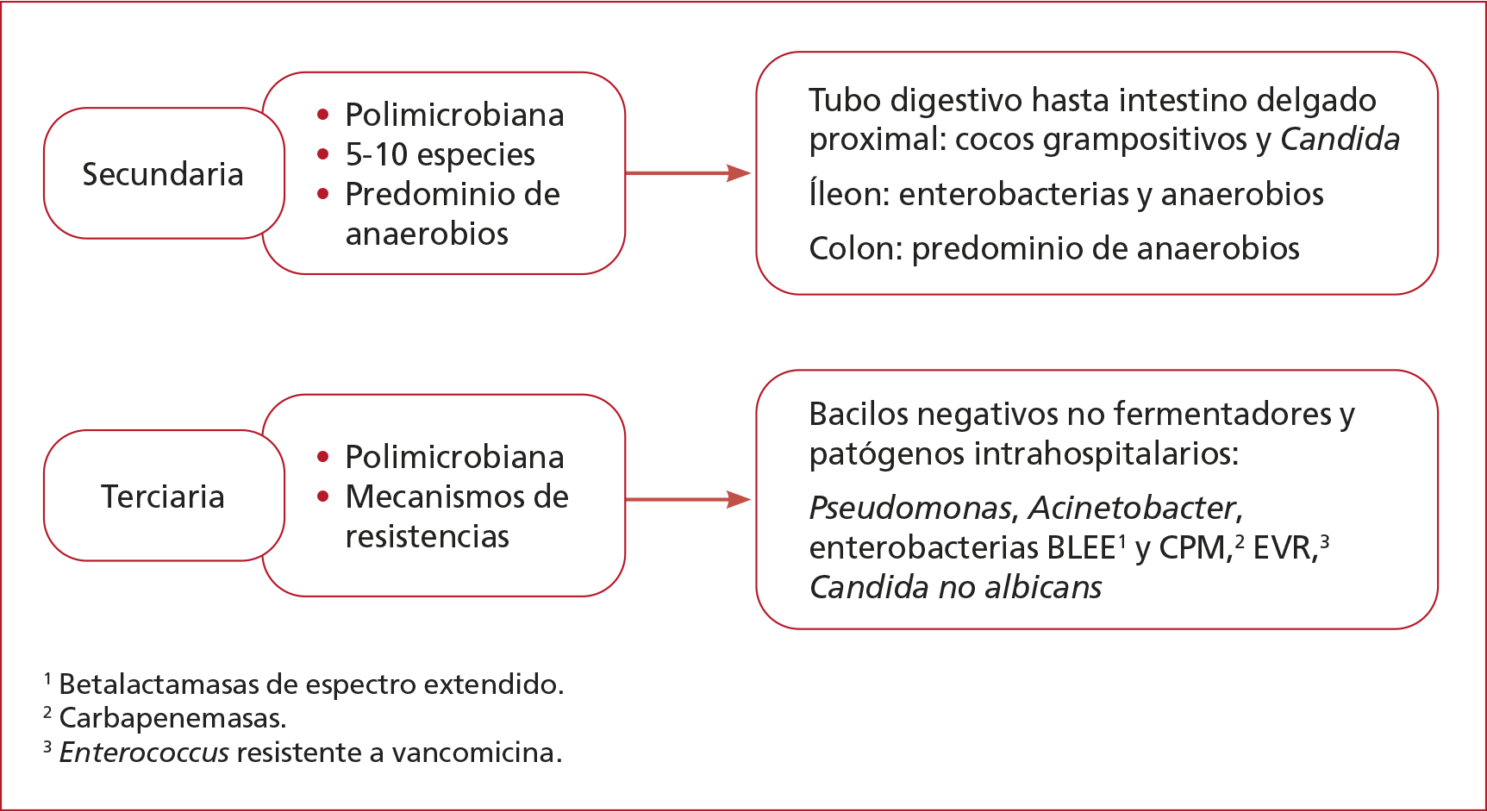
Figura 1. Microbiología según el origen.
Manejo de las IIA
Los
principios del manejo de las IIA incluyen cuatro pilares básicos: diagnóstico
precoz por medio de la evaluación clínica y los estudios por imágenes, control
quirúrgico del foco, tratamiento antimicrobiano, reanimación adecuada según los
lineamientos de la Surviving Sepsis Campaign (Figura 2).10
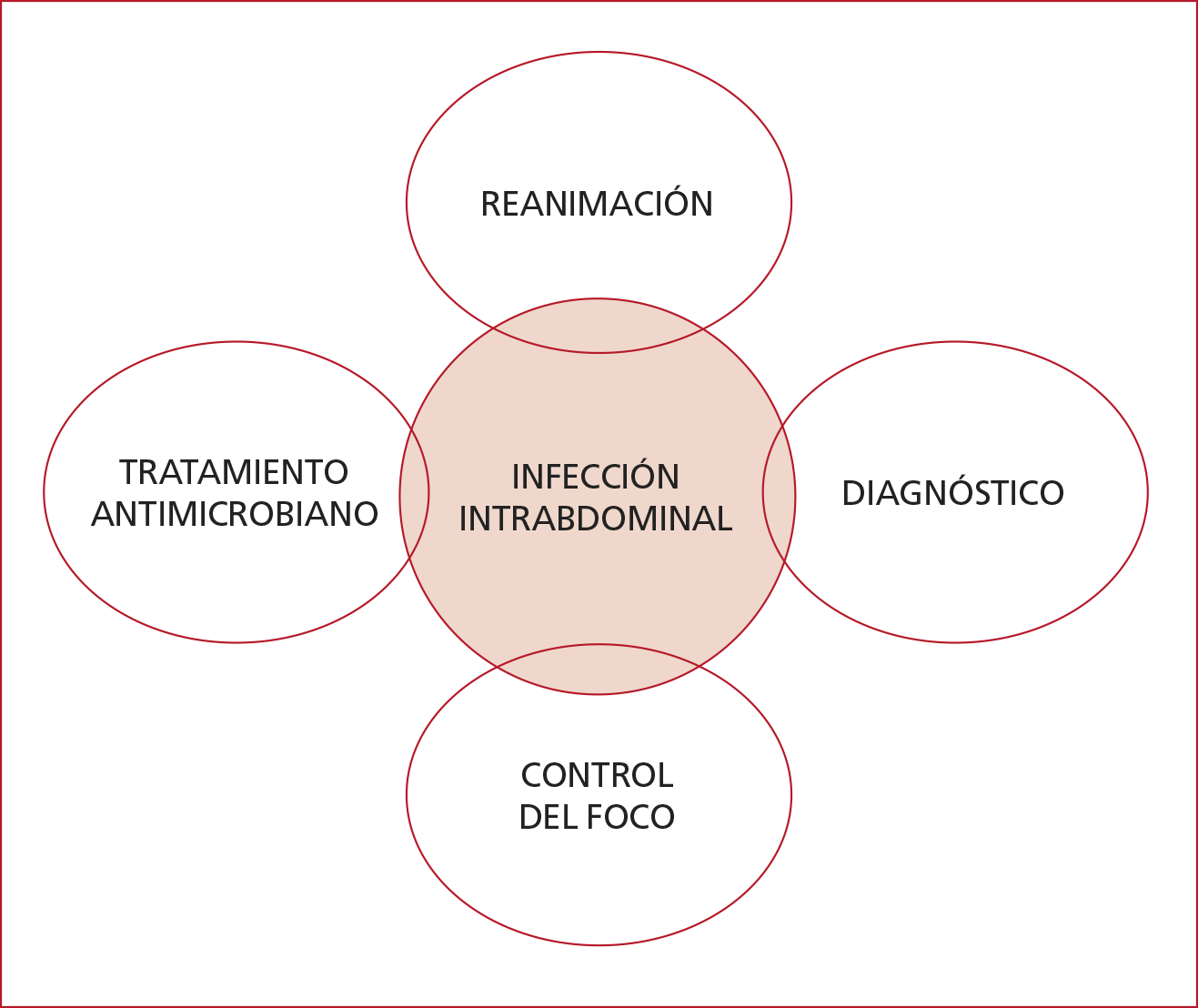
Figura 2. Manejo de las infecciones intrabdominales.
Reanimación
Reconocimiento
precoz de signos de sepsis/shock séptico y reanimación adecuada siguiendo los
lineamientos de la Surviving Sepsis Campaign.
Diagnóstico
- Estudios por imágenes: para
determinar el origen probable y la extensión; para ello, la tomografía computarizada
es el estudio de elección.5-11 Si bien la sensibilidad y especificidad
de la ecografía son menores, se considera un buen estudio inicial,
especialmente cuando no se dispone de tomografía computarizada. Teniendo en
cuenta la facilidad de acceso al equipo de ultrasonido y el hecho de que no
emite radiación ionizante, se recomienda para pacientes con sospecha de IIA.
La resonancia
magnética nuclear no está disponible, de forma rutinaria, en el entorno de
emergencia de la mayoría de los hospitales. Se ha propuesto su uso en
embarazadas con dolor abdominal cuando la ecografía no es concluyente.12 Si está indicada una laparotomía
inmediata, como en los pacientes sépticos, no debe retrasarse mientras se
espera para realizar una tomografía computarizada. Las imágenes pueden ser
innecesarias en pacientes con signos claros de peritonitis difusa.13
Laboratorio
Los análisis
de rutina son: hemograma, hepatograma, urea, creatinina, amilasemia, gasometría
arterial, coagulograma, y concentración de lactato si se sospecha shock séptico.
Se recomienda determinar la procalcitonina como complemento diagnóstico
para pacientes con presunta IIA.
Control del foco
Debe
realizarse de inmediato en pacientes con sepsis y shock séptico. La mayoría de
los pacientes con IIAc requiere el control quirúrgico del foco, el retraso se
asocia con una tasa de mortalidad más alta. El objetivo es restaurar la anatomía
y el normal funcionamiento.14
El control de
la fuente de infección se puede lograr utilizando técnicas tanto quirúrgicas
como no quirúrgicas. La cirugía sigue siendo la estrategia terapéutica más
viable para el manejo de las infecciones en pacientes críticos.1
Los
procedimientos intervencionistas no quirúrgicos incluyen el drenaje percutáneo
de abscesos. Cuando es guiado por ecografía y tomografía en pacientes
seleccionados es seguro y eficaz. La causa principal del fracaso es el
diagnóstico erróneo respecto de la magnitud, la extensión, la complejidad y la
ubicación del absceso.
La cirugía es
la medida terapéutica más importante para controlar las infecciones
quirúrgicas. Los objetivos principales de la intervención quirúrgica
incluyen a) determinar la causa de la infección y b) controlar su
origen. En pacientes con IIA, el control de la fuente quirúrgica implica
la resección o sutura de una víscera enferma o perforada (perforación
diverticular, gastroduodenal), la extirpación del órgano infectado (apéndice,
vesícula biliar), el desbridamiento del tejido necrótico, la resección del
intestino isquémico y la reparación/resección de perforaciones traumáticas con
anastomosis primaria o creación de ostomas.
La
intervención quirúrgica o percutánea también ofrece la oportunidad de tomar muestra
para tinción de Gram y cultivos, esto es particularmente útil en las IIAc.1
Terapia antimicrobiana
Es posible
que los pacientes con IIA no complicadas tratadas quirúrgicamente no requieran
antibióticos en el posoperatorio cuando la operación es eficaz como sucede en
las apendicitis agudas no complicadas o la colecistitis.17 Las IIAc requieren continuar el
tratamiento para prevenir la diseminación y disminuir las complicaciones
tardías. Los lineamientos de la Surviving Sepsis Campaign indican el
inicio precoz del tratamiento antibiótico (dentro de la primera hora),
especialmente en aquellos pacientes con signos de sepsis.
Tratamiento antimicrobiano.
principios generales
El
tratamiento empírico de las IIA debe contemplar el uso juicioso de agentes
antimicrobianos para maximizar la utilidad y la eficacia terapéutica, y
disminuir el riesgo de selección de patógenos resistentes. Implica conocer la
microbiología y las tasas de resistencia locales.
Los regímenes
empíricos para las IIA deben incluir actividad antimicrobiana contra
enterobacterias, estreptococos y anaerobios (principalmente Bacteroides
fragilis).
Para las
infecciones leves o moderadas de la comunidad, se debe favorecer el uso de
agentes antimicrobianos de espectros más estrechos, y fármacos de más amplio
espectro para las infecciones graves de la comunidad o asociadas a cuidados de
la salud (Figura 3). El principal problema lo plantean las enterobacterias
productoras de betalactamasas de espectro extendido (BLEE) que son prevalentes
en el ámbito nosocomial, pero también circulan en la comunidad.18 La elección de una terapia empírica inadecuada
aumenta los efectos adversos y las muertes. Los principales factores de riesgo
para BLEE se detallan en la Tabla 3.

Figura 3. Tratamiento empírico inicial.
Tabla 3
Factores de riesgo para enterobacterias productoras de BLEE
|
Hospitalización |
>15 días de internación Internación en centro de salud (últimos 90 días) |
|
Comorbilidad |
Trasplante Insuficiencia renal crónica Cirrosis Diabetes mellitus Infección urinaria recurrente Obstrucción biliar Corticoides |
|
Procedimientos invasivos previos |
Fibroendoscopia digestiva alta terapéutica, cirugías reciente (últimos 90 días) |
|
Tratamiento antibiótico (últimos 3 meses) |
Betalactámicos/inhibidores de betalactamasas Cefalosporinas de tercera generación Quinolonas Aminoglucósidos |
Las de origen
nosocomial requieren esquemas más complejos que contemplen distintos
patrones de resistencia. Es importante prestar especial atención a los factores
de riesgo de infección por Enterococcus resistente a vancomicina (Tabla
4), Candida (Tabla 5) o bacilos gramnegativos no fermentadores: Pseudomonas
y Acinetobacter, enterobacterias portadoras de BLEE y productoras de
carbapenemasas (Tabla 6).19
Tabla 4
Factores de
riesgo de infección por Enterococcus
|
Infección nosocomial |
|
Peritonitis y abscesos posoperatorios |
|
Tratamiento de rescate de infección intrabdominal complicada |
|
Uso previo de cefalosporinas de tercera generación |
|
Inmunosupresión/trasplante de órgano sólido |
Tabla 5
Factores de
riesgo de infección por Candida
|
Tratamiento antibiótico prolongado |
|
Dificultad para controlar el foco |
|
Tinción de Gram/cultivos de líquido abdominal con levaduras |
|
Infección intrabdominal nosocomial |
|
Puntajes predictivos altos: Puntaje Candida ≥3 Puntaje de Sevilla ≥12 |
|
Dehiscencia de anastomosis |
|
Cirugía gastroduodenal (especialmente si la evolución es tórpida) |
Tabla 6
Tratamiento empírico de la infección
intrabdominal nosocomial
|
|
Posoperatoria (incluye posendoscopia biliar) |
Recidivante/persistente (terciaria)4 |
|
De elección |
Piperacilina-tazobactam Carbapenémico (imipenem o meropenem)1 |
Meropenem o imipenem ±vancomicina2 ±daptomicina o
linezolid3 ± equinocandinas4 |
|
Alternativas |
Aztreonam + metronidazol (alergia abetalactámicos) Tigeciclina + ceftazidima Tigeciclina + cefepima |
Tigeciclina + ceftazidima o cefepima o aztreonam Tigeciclina + colistina ± amikacina (sospecha de
Enterobacterias productoras de carbapenemasa, bacilos gramnegativos no
fermentadores multirresistentes) |
1 Riesgo de betalactamasas de espectro
extendido, internación en Terapia Intensiva >48 h, pancreatitis aguda grave
con necrosis infectada.
2 Alto riesgo de infección por S. aureus
resistente a meticilina.
3 Enterococos resistentes a vancomicina: solo en
trasplante hepático con infección intrabdominal de origen hepatobiliar,
colonizado con enterococos resistentes a vancomicina.
4 Agregar agente antifúngico si hay alta
sospecha de Candida en el líquido peritoneal.
En pacientes
con IIA de origen comunitario, la cobertura empírica inicial para Staphylococcus
aureus resistente a meticilina generalmente no está justificada, incluso en
enfermos colonizados.
No es
necesaria la cobertura de Enterococcus spp adquirido en la comunidad, a
menos que se recupere de la sangre o sea el único aislado recuperado en el
cultivo del sitio infectado.
No se
recomienda la cobertura empírica de enterococos resistente a vancomicina,
excepto para pacientes que tienen un riesgo muy alto de infección por este germen.
En estos casos, se incluye un agente con actividad para este patrón de
resistencia en el régimen empírico (como tigeciclina, linezolid o daptomicina).20
El uso de
colistina o la combinación ceftolozano-tazobactam asociada a metronidazol para
la cobertura anaerobia puede tener funciones específicas en las IIA causadas
por flora que incluye Pseudomonas aeruginosa resistente a otros
antibióticos o microorganismos productores de BLEE, siempre que se confirme la
sensibilidad a estos agentes.
La
combinación ceftazidima-avibactam tiene actividad contra muchas enterobacterias
productoras de carbapenemasa de tipo Klebsiella pneumoniae carbapenemasa.
También debe reservarse para los aislados solo sensibles a esta.21
La presencia
de metalobetalactamasas siempre implica un desafío en el tratamiento antibiótico, dada la escasez de
opciones terapéuticas. Se deben explorar alternativas según los patrones de
sensibilidad de cada institución, con combinaciones, como ceftazidima-avibactam
+ aztreonam + metronidazol (Tabla 7).
Tabla 7
Manejo de los microorganismos resistentes a
múltiples fármacos
|
Resistencia |
Recomendación |
Alternativa |
|
Enterococos resistentes a vancomicina |
Agregar tigeciclina |
Linezolid Daptomicina |
|
Pseudomonas resistentes a
múltiples
fármacos NO KCP/MBL |
Agregar colistina |
Ceftazolano- tazobactam + metronidazol |
|
KPC |
Ceftazidima-avibactam + metronidazol |
Meropenem1 + colistina Tigeciclina + amikacina Colistina + amikacina |
|
MBL |
Ceftazidima-avibactam + metronidazol +
aztreonam |
|
1 Según la concentración inhibitoria mínima a
meropenem: >16 µg/ml, evaluar otras alternativas.
KPC = carbapenemasa, MBL = metalobetalactamasas.
Tratamiento empírico inicial
Un
tratamiento inicial inadecuado se asocia con estancias hospitalarias más prolongadas, tasas más altas de abscesos posoperatorios y de
reoperación, y aumento de las muertes. La elección del tratamiento
antimicrobiano empírico
inicial depende de cuatro factores fundamentales (Figura 4):
1. Gravedad
Se define IIAc grave si hay uno
o más de los siguientes: sepsis, shock séptico, lactato ≥2 mmol/l, APACHE II
>15 puntos.
2. Probables patógenos/factores de
riesgo de resistencia antibiótica
Deben contemplarse los factores
de riesgo para patógenos resistentes: enterobacterias portadoras de BLEE y
carbapenemasa, Pseudomonas aeruginosa, Enterococcus y Candida (Tabla
7).
3. Origen anatómico
probable/identificado de la lesión.
Origen probable o identificado
de la lesión: 60% de origen colónico: apendicular y diverticular, con
variabilidad geográfica.
4. Lugar de adquisición: comunidad/
nosocomial
Origen en la comunidad o
intrahospitalario
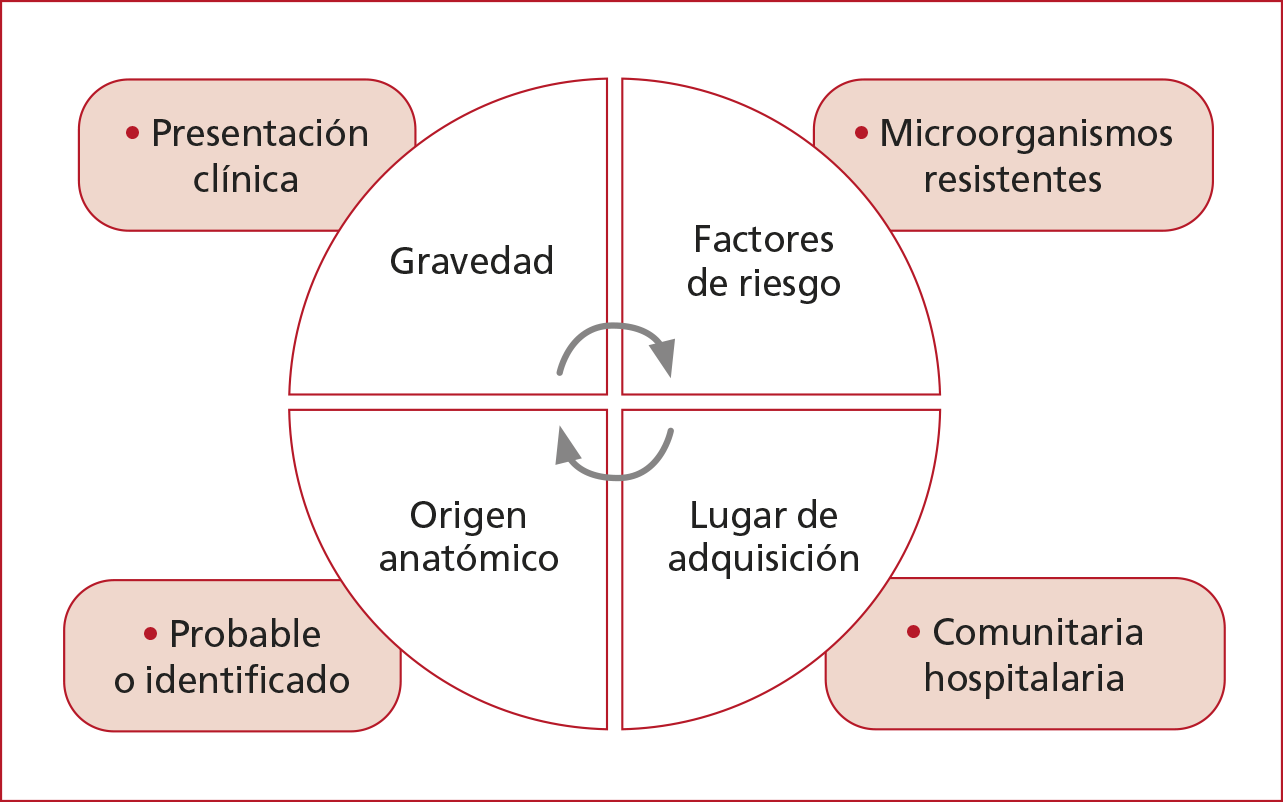
Figura 4. Factores para la elección del tratamiento antimicrobiano.
Control quirúrgico del foco
Comprende
todas las medidas para eliminar la fuente de infección, controlar la
diseminación peritoneal, y restaurar la función anatómica y fisiológica
lo antes posible, mediante
la resección o sutura de vísceras perforadas, isquémicas, la extracción del
órgano infectado (apéndice, vesícula biliar), el desbridamiento del tejido
necrótico, el drenaje de cavidades purulentas, la descompresión abdominal
(Figura 5).22 El control inicial inadecuado del foco aumenta
la tasa de mortalidad a 28 días del 26,7% al 42,9%.
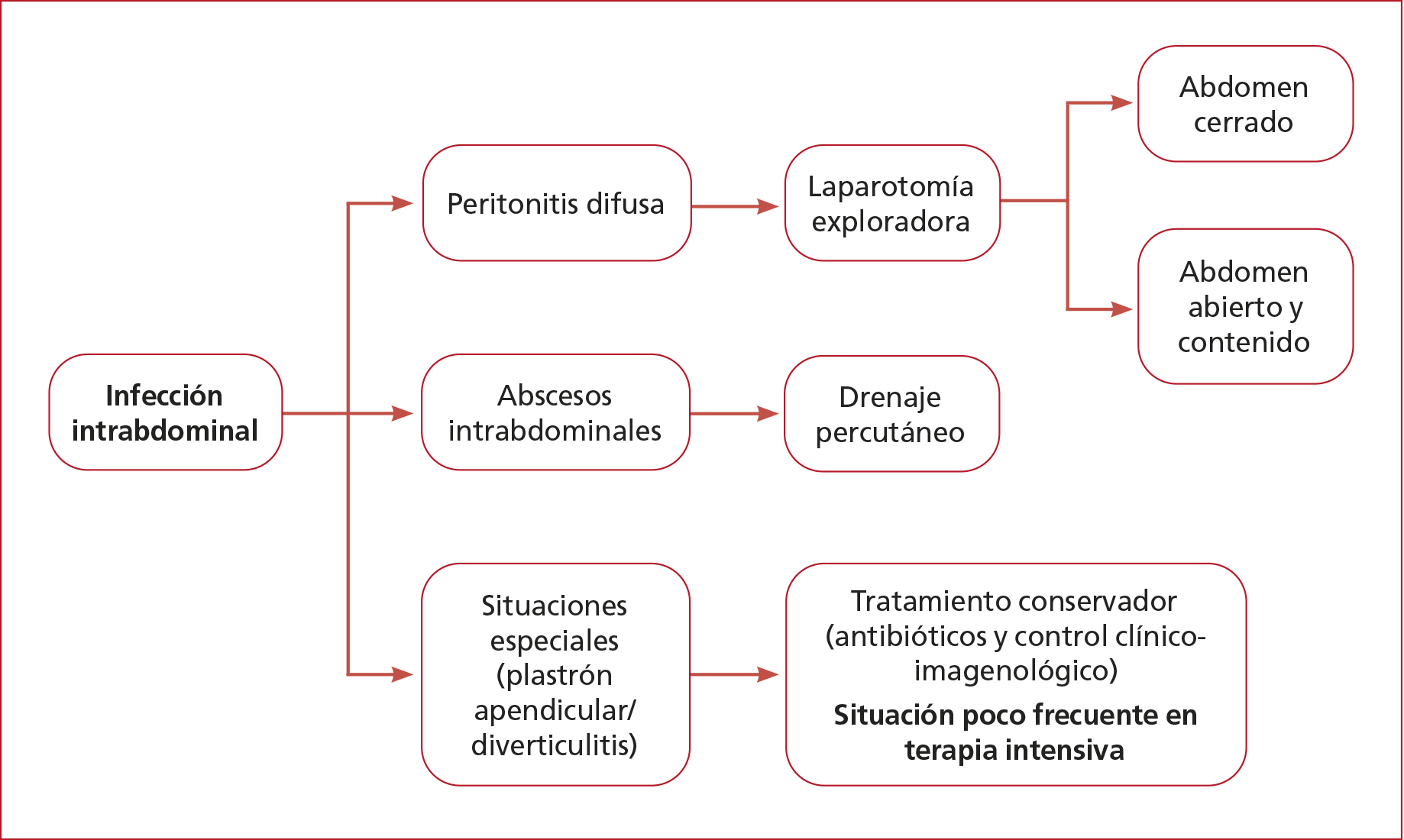
Figura 5. Control quirúrgico del foco.
Manejo de la pared abdominal después de
la laparotomía
Existen tres
estrategias para el manejo de la sepsis abdominal luego de una laparotomía
inicial:
a. Abdomen abierto y contenido.
b. Laparotomía a demanda: se realiza
solo cuando la condición del paciente lo requiere.
c. Laparotomía programada: se
realiza cada 36-48 h para evaluación, drenaje y lavado hasta la resolución de
la peritonitis en curso.
La estrategia
de laparotomía a demanda implica una menor tasa de uso de recursos y de costos
médicos que la programada, y no hay evidencia de una tasa de mortalidad o
morbilidad más alta, por lo que es la recomendada.
El abdomen
abierto facilita la exploración y el control posterior de su contenido y
previene el síndrome compartimental (Tabla 8). Las técnicas que se utilizan son
la bolsa de Bogotá y el sistema de presión negativa. Las ventajas de la primera
es que es económica y se cuenta con más experiencia. A favor del sistema de
aspiración al vacío es que produce un eficiente drenaje de líquidos y favorece
la granulación.23
Tabla 8
Indicaciones de abdomen abierto y contenido
|
Cirugía de control de daño (inestabilidad hemodinámica, acidosis, coagulopatía, dificultad de control del foco, pancreatitis aguda grave) |
|
Sepsis abdominal grave |
|
Dificultad en el cierre de la pared abdominal |
|
Fascitis necrotizante de pared abdominal |
|
Síndrome compartimental abdominal (presión intrabdominal >20 mmHg y disfunción orgánica) o alto riesgo (reanimación con grandes cantidades de fluidos), contenido intrabdominal aumentado: ascitis, neumoperitoneo, hemoperitoneo |
|
Cirugía definitiva/cierre de anastomosis diferida |
|
Dudas de viabilidad intestinal (isquemia intestinal) |
Se recomienda
el cierre de la herida abdominal dentro de los 4-7 días para disminuir
complicaciones (fístulas, evisceraciones, retracciones).
Cada día que
se deja un abdomen abierto aumenta el riesgo de fístula intestinal. Cuando
el cierre no es posible en la laparotomía inicial debido a un edema visceral,
se usa un dispositivo de cierre temporal basado en presión negativa para el
cierre fascial secundario progresivo.
El abdomen
abierto combinado con la terapia de presión negativa es un concepto diferente y
más reciente del tratamiento de la sepsis abdominal. El uso de un
dispositivo de presión negativa (comercial) reduce la mortalidad.24,25
Duración del tratamiento
La duración
del tratamiento antimicrobiano ha sido objeto de un amplio debate y debe ser específica
para cada cuadro clínico.
En los
pacientes con IIA sin complicaciones, como apendicitis o colecistitis no
complicadas que han sido sometidos al tratamiento definitivo del foco de
infección, no es necesaria la terapia antimicrobiana posoperatoria.17-26
Para las IIAc
con adecuado control del foco, un ciclo corto de tratamiento de 3-5 días
resultó tan eficaz como los esquemas más prolongados.27-29
Si no hay
mejoría luego de 5-7 días,
se debe revaluar al paciente mediante examen clínico, estudios por imágenes y
parámetros de laboratorio para descartar un foco de infección no controlada,
peritonitis terciaria y fracaso del tratamiento antimicrobiano.
El
tratamiento antibiótico se puede suspender a las 24 h8 en caso de: perforaciones intestinales
por trauma que se reparan dentro de las 12 h, gastroduodenales (cuando el
paciente no recibe tratamiento con antiácidos y no tiene una neoplasia) y de
intestino delgado proximal reparadas dentro de las 24 h, y las apendicitis y
colecistitis no complicadas.
Algunos
cuadros específicos requieren prolongar el agente antimicrobiano (Tabla 9).30-32
La duración
de la terapia antimicrobiana para las infecciones nosocomiales complicadas no
está definida y debe evaluarse en cada caso, al igual que para las cirugías en
las que el control del foco fue subóptimo.
Tabla 9
Duración del tratamiento antimicrobiano
|
24 horas |
|
- Lesión intestinal por trauma penetrante de <12 h de evolución - Perforación gastroduodenal o de intestino delgado proximal de <24 h sin tratamiento antiácido, sin neoplasia - Apendicitis o colecistitis sin evidencia de gangrena, perforación o absceso con cirugía precoz y efectiva (adecuado control del foco) |
|
4-7días (promedio 5 días) |
|
Infección con adecuado control del foco |
|
Situaciones que requieren prolongar el tratamiento (8-10 días o más) |
|
- Control del foco subóptimo (p. ej., pancreatitis, absceso hepático, pileflebitis, cirugía de control de daño) - Pacientes con apendicitis no complicada tratados sin cirugía, se recomienda 10 días de antibióticos - En drenajes percutáneos, hasta que la colección se encuentre efectivamente drenada (evaluar cada caso) |
Factores de riesgo para el fracaso del control
quirúrgico del foco en IIA
Entre los
factores pronósticos más importantes de la infección grave se destacan la
adecuación y precocidad del tratamiento antibiótico. Estudios retrospectivos
han demostrado que el espacio de tiempo en el que el tratamiento antibiótico
podría ser eficaz para contener la IIA antes de que la progresión local y
sistémica condicione la biodisponibilidad del antibiótico y el éxito
terapéutico, puede ser limitado. Se ha observado una mejor evolución en
aquellos pacientes en los que el tratamiento empírico fue activo frente a los
patógenos que crecieron en las muestras de la intervención. El 13-16% de los
pacientes recibe un tratamiento antibiótico inadecuado y la tasa de fracaso
terapéutico por resistencia al tratamiento empírico es del 11% en la IIA de la
comunidad y de alrededor del 30% en las IIA de origen nosocomial.33,34
Otros
factores de riesgo relacionados con el fracaso del control quirúrgico del foco
se enumeran en la Tabla 10.
Tabla 10
Factores de riesgo para el fracaso del control del foco de una infección intrabdominal
|
Tratamiento antibiótico inadecuado |
Factores de riesgo para: - Enterococcus - Pseudomonas aeruginosa - Enterobacterias BLEE, KPC - Candida spp |
|
Gravedad |
Shock séptico/sepsis Apache II ≥15 |
|
Retraso en la cirugía |
>24 horas |
|
Comorbilidad |
Inmunodepresión Neoplasia Desnutrición/hipoalbuminemia Diabetes mellitus Insuficiencia renal crónica Enfermedad pulmonar crónica Cirrosis hepática |
|
Edad |
>65 años |
|
Control de foco |
Control del foco dificultoso o peritonitis fecal |
Candidiasis intrabdominal
La candidiasis
invasiva y su forma intrabdominal representa una importante causa de
morbilidad, con una tasa de mortalidad descrita del 27-40%.35,36 La peritonitis candidiásica
posoperatoria tiene una prevalencia del 1,3 al 2,2%, con un aumento de la
frecuencia en pacientes con factores de riesgo, como edad avanzada, uso previo
de antibioticoterapia de amplio espectro, quimioterapia o radioterapia asociada
a neoplasias y cirugías más agresivas. El mayor riesgo se asocia con cirugías
digestivas altas (gastroduodenales) que se presenta en un 20-30% de los casos.
Provoca el 45-70% de las peritonitis nosocomiales de pacientes graves en
terapia intensiva (Tabla 11). Actualmente se observa un aumento de incidencia
asociado a la cirugía bariátrica.37
El riesgo de
desarrollar candidiasis invasiva es particularmente alto en los pacientes
sometidos a cirugía que presentan perforación gastroduodenal recurrente,
dehiscencia de la anastomosis, pancreatitis necrotizante aguda.38
Tabla 11
Candida intrabdominal según el foco
|
Apendicitis perforada |
3,5% |
|
Perforación gastroduodenal espontánea |
20-32% |
|
Peritonitis nosocomial |
45% |
Etiología
Candida
albicans es la especie
más frecuente (60-70%). En los últimos años, aumentaron las especies no albicans
con mayor resistencia a azoles y su distribución es regional. En Latinoamérica,
predominan Candida tropicalis y parapsilosis, en general,
sensibles a fluconazol. En los Estados Unidos y España, Candida glabrata
es relativamente común, la sensibilidad es dependiente de la dosis o resistente
a fluconazol.39
Diagnóstico
El
diagnóstico suele ser dificultoso, con frecuencia, presuntivo basado en
factores de riesgo, mala evolución clínica, puntajes y algoritmos predictivos,
la fiebre persistente durante el tratamiento con antibióticos de amplio
espectro.
Los
hemocultivos tienen una sensibilidad aproximada del 15-20% y en el líquido
abdominal es del 50-60%. Los métodos actuales para la detección
(manano-antimanano, reacción en cadena de la polimerasa, Septifast, T2 Candida
Panel), si bien tienen una elevada sensibilidad y especificidad, se cuenta
con poca experiencia para recomendar su uso de rutina. El 1,2-beta-d-glucano
arroja resultados falsos positivos en pacientes sometidos a hemodiálisis,
tratamiento con gammaglobulina, albúmina y piperacilina-tazobactam.40
Los puntajes
diagnósticos si bien se utilizan en las terapias intensivas, poseen un alto
valor predictivo negativo, pero un bajo valor predictivo positivo y su uso no
está ampliamente validado.41
El
diagnóstico de la candidiasis invasiva requiere una combinación entre las
pruebas diagnósticas, los factores de riesgo del paciente, aunque el cultivo
directo sigue siendo el patrón de referencia.
Tratamiento de la candidiasis intrabdominal
La
candidiasis intrabdominal es una complicación frecuente en pacientes con
peritonitis terciarias y en aquellos expuestos a tratamientos antibióticos
previos. El control quirúrgico del foco es una de las medidas más importantes,
el tratamiento antifúngico aislado tiene poca efectividad. El inicio del
tratamiento está indicado si se aíslan levaduras en el examen directo del
líquido peritoneal o en los hemocultivos, y lleva a una reducción de la tasa de
mortalidad. La recomendación es administrar una equinocandina si el paciente
está grave, tiene sepsis o shock séptico, disfunción multiorgánica, exposición
previa a azoles o la frecuencia de Candida no albicans es alta en
la unidad de terapia intensiva. En los pacientes sin estos signos de gravedad,
se puede iniciar un tratamiento con azoles.42
Las
equinocandinas son fármacos fungicidas, con amplia cobertura sobre especies de Candida
albicans y no albicans, y con buena tolerancia. Puede desescalarse a
fluconazol luego de 5-7 días de tratamiento intravenoso si hay mejoría clínica,
hemocultivos negativos y Candida sensible. La duración del tratamiento
es de 14 días desde la mejoría clínica y los hemocultivos negativos.
El
tratamiento empírico basado en puntajes es controversial y ampliamente
utilizado en la práctica diaria. Puede ser considerado en pacientes con
factores de riesgo y mala evolución clínica, cuando hay hemocultivos negativos
o aun no hay levaduras en el examen directo de líquido peritoneal.43
Con respecto
al tratamiento preventivo, actualmente no existe evidencia que apoye su
indicación en pacientes de alto riesgo después de la cirugía.
Biomarcadores en la IIA
Se han
probado varios marcadores como factores predictivos tempranos de complicaciones
en la IIA posterior a una cirugía, la procalcitonina y la proteína C reactiva
son los más estudiados.
La proteína C
reactiva alcanza su punto máximo en el posoperatorio, pero no muestra descenso
en la primera semana y no diferencia en niveles según la evolución.44
El papel de
la procalcitonina no está definido para este objetivo, aunque hay datos que
apoyan su utilidad para evaluar la respuesta a la terapia con antibióticos, lo
que la transforma en una herramienta útil para el seguimiento de los pacientes
con IIA y así determinar la duración del tratamiento.45-47 Por otro lado, puede ser negativa en
caso de infecciones localizadas.
Conclusiones
Las IIAc
requieren un abordaje multidisciplinario médico y
quirúrgico. Cuando se asocian a sepsis abdominal, la morbimortalidad sigue siendo
elevada. El reconocimiento temprano y la terapia basada en protocolos pueden
mejorar los resultados.
Los puntos
clave para un mejor pronóstico son el control adecuado del foco y el
tratamiento antimicrobiano apropiado y precoz.
La técnica de
abdomen abierto es una opción útil para el manejo posterior de los pacientes
con sepsis abdominal con revaluación diaria y monitoreo de las complicaciones.
A pesar del
avance en las técnicas quirúrgicas, la asociación de biomarcadores para el
seguimiento mejora el tratamiento de estos pacientes, la poca disponibilidad de
nuevos antibióticos y el rápido aumento de los fenómenos de resistencia lo
transforman en un desafío continuo para su manejo.
Puntos clave
|
• |
Es fundamental el control quirúrgico adecuado del foco (disminuye un 50%
la tasa de mortalidad). |
|
• |
Los antibióticos deben ser seleccionados sobre la base de la gravedad de
la enfermedad y los factores de riesgo. |
|
• |
Abdomen abierto y contenido es una opción frecuente en terapia
intensiva. |
|
• |
Laparotomía a demanda o
programada: decisión individualizada. |
|
• |
Duración del
antibiótico 4-7 días (buen control del foco). |
|
• |
Pacientes posoperatorios con evolución tórpida y factores de riesgo:
considerar tratamiento antifúngico empírico. |
|
• |
Trabajo en conjunto con el equipo quirúrgico. |
Bibliografía
1.
Sakr
Y, Jaschinski U, Wittebole X, et al. Sepsis
in intensive care unit patients: worldwide data from the intensive care over
nations audit. Open Forum Infect Dis 2018; 5(12): ofy313. https://doi.org/10.1093/ofid/ofy313
2.
Montravers
P, Blot S, Dimopoulos G, et al. Therapeutic management of peritonitis: a
comprehensive guide for intensivists. Intensive Care Med 2016; 42(8):
1234-1247. https://doi.org/10.1007/s00134-016-4307-6
3.
Blot S,
Antonelli M, Arvaniti K, et al. Epidemiology of intra-abdominal infection and sepsis in critically
ill patients: “AbSeS”, a
multinational observational cohort study and ESICM Trials Group Project. Intensive Care Med 2019;
45(12): 1703-1717. https://doi.org/10.1007/s00134-019-05819-3
4.
Sartelli
M, Coccolini F, Kluger Y, et al. WSES/GAIS/SIS-E/WSIS/AAST
global clinical pathways for patients with intra-abdominal infections. World J
Emerg Surg 2021;16(1): 49. https://doi.org/10.1186/s13017-021-00387-8
5.
Solomkin
J, Mazuski J, Bradley J, et al. Diagnosis
and management of complicated intra-abdominal infection in adults and children:
guidelines by the Surgical Infection Society and the Infectious Diseases
Society of America. Surg
Infect (Larchmt) 2010; 11(1): 79-109. https://doi.org/10.1089/sur.2009.9930
6.
Clara
L, Rodríguez V, Saúl P, Domínguez C,
Esteban M. Infecciones intraabdominales. Puesta al día y recomendaciones de la sociedad argentina
de infectología. Medicina (Buenos Aires)
2018; 78: 417-426. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0025-76802018000800006
7.
Hotchkiss
R, Moldawer L, Opal S, Reinhart K, Turnbull I, Vincent J. Sepsis and septic
shock. Nat Rev Dis Primers 2016 2 : 16045. https://doi.org/10.1038/nrdp.2016.45
8.
Mazuski
J, Tessier J, May A, et al. The Surgical Infection Society Revised Guidelines
on the Management of Intra-Abdominal Infection. Surg Infect (Larchmt) 2017;
18(1): 1-76. https://doi.org/10.1089/sur.2016.261
9.
Xiuwen W, Ji W, Peige W, et al. Diagnosis and
management of intraabdominal infection: Guidelines by the Chinese Society of
Surgical Infection and Intensive Care and the Chinese College of
Gastrointestinal Fistula Surgeons. Clin Infect Dis 2020; 71(Suppl 4): S337-S362. https://doi.org/10.1093/cid/ciaa1513
10. Pereyra C.
Infecciones intraabdominales. En: Sociedad Argentina de Terapia Intensiva. Terapia Intensiva, 5ª.ed. Buenos Aires: Editorial Panamericana; 2015: 844-850.
11. Pinto L, Pereira J, Cunha R, Pinto P, Sirlin C. CT
evaluation of appendicitis and its complications: imaging techniques and key
diagnostic findings. AJR Am J Roentgenol 2005; 185(2): 406-417. https://doi.org/10.2214/ajr.185.2.01850406
12. Duke E, Kalb B, Arif-Tiwari H, et al. A systematic
review and meta-analysis of diagnostic performance of MRI for evaluation of
acute appendicitis. AJR Am J Roentgenol 2016; 206(3): 508-517. https://doi.org/10.2214/AJR.15.14544
13. De Waele J. Early source control in sepsis.
Langenbecks Arch Surg 2010; 395(5): 489-494. https://doi.org/10.1007/s00423-010-0650-1
14. Cecconi M, Evans L, Levy M, Rhodes A. Sepsis and
septic shock. Lancet 2018; 392(10141): 75-87. https://doi.org/10.1016/S0140-6736(18)30696-2
15.
Sartelli
M, Catena F, Abu-Zidan F, et al. Management of intra-abdominal infections: recommendations by the WSES 2016 consensus conference. World J Emerg Surg 2017; 12: 22. https://doi.org/10.1186/s13017-017-0132-7
16. Azzarello G, Lanteri R, Rapisarda C, et al. Ultrasound-guided percutaneous treatment of abdominal
collections. Chir Ital 2009; 61(3): 337-340. PMID: 19694236
17. Gomi H,
Solomkin J, Takada T, et al. TG13 antimicrobial therapy for acute cholangitis and
cholecystitis. J Hepatobiliary Pancreat Sci 2013; 20(1): 60-70. https://doi.org/10.1007/s00534-012-0572-0
18. Sartelli
M, Weber D, Ruppé E, et al. Antimicrobials: a global alliance for optimizing their
rational use in intra-abdominal infections (AGORA).World J Emerg Surg 2016; 11:
33. https://doi.org/10.1186/s13017-016-0089-y
19. Sartelli M, Chichom-Mefire A, Labricciosa F,
Hardcastle T, Abu-Zidan F, Adesunkanmi A. The management of intra-abdominal
infections from a global perspective: 2017 WSES guidelines for management of
intraabdominal infections. World J Emerg Surg 2017; 12: 29. https://doi.org/10.1186/s13017-017-0141-6
20. Driscoll T, Crank C. Vancomycin-resistant enterococcal
infections: Epidemiology, clinical manifestations, and optimal management.
Infect Drug Resist 2015; 8: 217-230. https://doi.org/10.2147/IDR.S54125
21. Golan Y. Empiric therapy for hospital-acquired,
Gram-negative complicated intra-abdominal infection and complicated urinary
tract infections: a systematic literature review of current and emerging
treatment options. BMC Infect Dis 2015; 15: 313. https://doi.org/10.1186/s12879-015-1054-1
22. Perrone G,
Sartelli M, Giuffrida M, et al. Management
of intra-abdominal-infections: 2017 World Society of Emergency Surgery
guidelines summary focused on remote areas and low-income nations. Int J Infect
Dis 2020; 99: 140-148. https://doi.org/10.1016/j.ijid.2020.07.046
23. Montori G, Allievi N, Coccolini F, et al. Negative
pressure wound therapy versus modified Barker Vacuum Pack as temporary
abdominal closure technique for open abdomen management: a four-year
experience. BMC Surg 2017; 17(1): 86. https://doi.org/10.1186/s12893-017-0281-3
24. Piccoli M, Agresta
F, Grazia M, Amabile D, Marchi D, “Complex abdominal wall study” Italian
Collaborative Group. “Complex
abdominal wall” management: evidence-based guidelines of the Italian
Consensus Conference. Updates Surg 2019; 71 (2): 255-272. https://doi.org/10.1007/s13304-018-0577-6
25. Kirkpatrick A, Roberts D, Faris P, et al. Active
negative pressure peritoneal therapy after abbreviated laparotomy. The
Intraperitoneal Vacuum Randomized Controlled Trial. Ann Surg 2015; 262(1): 38-46. https://doi.org/10.1097/SLA.0000000000001095
26. Andersen BR, Kallehave FL, Andersen HK. Antibiotics
versus placebo for prevention of postoperative infection after appendicectomy.
Cochrane Database Syst Rev 2005; (3): CD001439. https://doi.org/10.1002/14651858.CD001439.pub2
27. Sawyer R, Claridge J, Nathens A, et al. Trial of
short-course antimicrobial therapy for intraabdominal infection. N Engl J Med 2015; 372(21): 1996-2005. https://doi.org/10.1056/NEJMoa1411162
28. Smith S, Rumbaugh K, May A. Evaluation of short course
of antimicrobial therapy for complicated intraabdominal infections in
critically ill surgical patients. Surg Infect (Larchmt) 2017;18(6): 742-750. https://doi.org/10.1089/sur.2017.011
29. Sartelli M, Catena F, Ansaloni L, Coccolini F, Di
Saverio S, Griffiths E. Duration of antimicrobial therapy in treating
complicated intra-abdominal infections: a comprehensive review. Surg
Infect (Larchmt) 2016; 17(1): 9-12. https://doi.org/10.1089/sur.2015.130
30. Lipovestky F, Ramos A, Cueto G, et al. Pancreatitis
aguda. Su
manejo en Cuidados Intensivos. RATI 2016; 33(1). Disponible
en: https://www.sati.org.ar/images/guias/461-2105-1-PB.pdf
31. Liu C, Gervais D, Hahn P, et al. Percutaneous liver
abscess drainage: do multiple abscesses or multiloculated abscesses prevent
drainage or affect outcome? J Vasc Interv Radiol 2009; 20(8): 1059-1065. https://doi.org/10.1016/j.jvir.2009.04.062
32. Flum D. Acute Appendicitis - Appendectomy or the “Antibiotics First” Strategy. N
Engl J Med 2015; 372: 1937-1943. https://doi.org/10.1056/NEJMcp1215006
33.
García-Lamberechts E, González-del Castillo J, Hormigo-Sánchez A, et al. Factors predicting failure in empirical antibiotic treatment. An Sist Sanit Navar 2017; 40(1): 119-130. https://doi.org/10.23938/ASSN.0011
34. Guirao X, Arias
J, Badía J, et al. [Recommendations in the empiric anti-infective agents of intra-abdominal
infection]. Rev
Esp Quimioter 2009; 22(3): 151-172. [En español] PMID: 19662549
35. Bassetti M, Righi E, Ansaldi F, et al. A multicenter
multinational study of abdominal candidiasis: epidemiology, outcomes and
predictors of mortality. Intensive Care Med 2015; 41(9): 1601-1610. https://doi.org/10.1007/s00134-015-3866-2
36. Dupont H, Paugam-Burtz C, Muller-Serieys C, et al. Predictive factors of
mortality due to polymicrobial peritonitis with Candida isolation in peritoneal
fluid in critically ill patients. Arch Surg 2002; 137(12): 13416; discussion1347. https://doi.org/10.1001/archsurg.137.12.1341
37. Zappella
N, Desmard M, Chochillon C, et al. Positive
peritoneal fluid fungal cultures in postoperative peritonitis after bariatric
surgery. Clin Microbiol Infect 2015; 21(9): 853.e1-3. https://doi.org/10.1016/j.cmi.2015.05.024
38. Sandven P, Ovist H, Skoylund E, Giercksky K, NORGAS
Group, Norwegian Yeast Study Group. Significance of Candida recovered from
intraoperative specimens in patients with intra-abdominal perforations. Crit Care
Med 2002; 30(3): 541-547. https://doi.org/10.1097/00003246-200203000-00008
39. Úbeda A, Loza Vázquez A,
León Gil C. Peritonitis
candidiásica. Enferm Infecc Microbiol Clin 2010; 28(Supl2): 42-48. https://doi.org/10.1016/S0213-005X(10)70029-X
40. Bassetti M, Marchetti M, Chakrabarti A, et al. A
research agenda on the management of intra-abdominal candidiasis: results from
a consensus of multinational experts. Intensive Care Med 2013; 39(12):
2092-2106. https://doi.org/10.1007/s00134-013-3109-3
41. Ostrosky-Zeichner L, Al-Obaidi M.
Invasive fungal infections in the Intensive Care Unit. Infect Dis Clin North Am 2017; 31(3): 475-487. https://doi.org/10.1016/j.idc.2017.05.005
42. Eggimanna P, Ostrosky-Zeichner L. Early antifungal
intervention strategies in ICU patients. Curr Opin Crit Care 2010; 16(5): 465-469. https://doi.org/10.1097/MCC.0b013e32833e0487
43. Pappas P,
Kauffman C, Andes D, et al. Clinical
Practice Guideline for the Management of Candidiasis: 2016 Update by the
Infectious Diseases Society of America. Clin Infect Dis 2016; 62(4): e1-50. https://doi.org/10.1093/cid/civ933
44. Tschaikowsky K, Hedwig-Geissing M, Schmidt J, Braun G.
Lipopolysaccharide-binding protein for monitoring of postoperative sepsis:
Complemental to C-reactive protein or redundant? PLoS One 2011; 6(8): e23615. https://doi.org/10.1371/journal.pone.0023615
45. Parlato M, Philippart F, Rouquette A, et al. Captain
Study Group Circulating biomarkers may be unable to detect infection at the
early phase of sepsis in ICU patients: the CAPTAIN prospective multicenter
cohort study. Intensive Care Med 2018; 44(7): 1061-1070. https://doi.org/10.1007/s00134-018-5228-3
46. Heyland D, Johnson A, Reynolds S, Muscedere J.
Procalcitonin for reduced antibiotic exposure in the critical care setting: a
systematic review and an economic evaluation. Crit Care Med 2011; 39(7): 1792-1799. https://doi.org/10.1097/CCM.0b013e31821201a5
47. Jong E,
van Oers J, Beishuizen A, et al. Efficacy
and safety of procalcitonin guidance in reducing the duration of antibiotic
treatment in critically ill patients: a randomised, controlled, open-label
trial. Lancet Infect Dis 2016; 16(7): 819-827. https://doi.org/10.1016/S1473-3099(16)00053-02016