Índices
neutrófilo/linfocito y plaqueta/linfocito en
pacientes con enfermedad cerebrovascular aguda. Evaluación
de la utilidad para predecir transformación hemorrágica
[Neutrophil-to-lymphocyte
and platelet-to-lymphocyte ratios in patients with acute ischemic stroke. Assessment of usefulness to
predict hemorrhagic transformation]
Alfredo Aguirre-Enríquez,1 Jocelyn Cruz-Pérez,2 Graciela Cárdenas-Hernández3*
1 Servicio de Terapia Intensiva Neurológica (Fellow),
Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez, Ciudad
de México, México
2 Servicio de Terapia Intensiva Neurológica, Instituto
Nacional de Neurología y Neurocirugía Manuel Velasco Suárez, Ciudad de México,
México
3 Servicio de Neurología, Instituto Nacional de
Neurología y Neurocirugía Manuel Velasco Suárez, Ciudad de México, México
* Correspondencia: gcardenas@innn.edu.mx
Los
autores no declaran conflictos de intereses.
Resumen
Objetivo:
Asociar los índices neutrófilo/linfocito y
plaqueta/linfocito con la transformación hemorrágica en pacientes neurocríticos
con enfermedad cerebrovascular isquémica aguda. Diseño: Estudio observacional retrospectivo, analítico,
transversal. Ámbito:
Unidad de Terapia Intensiva Neurológica del
Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez, Ciudad
de México, México. Pacientes:
Adultos >18 años con ictusisquémico agudo,
hospitalizados entre el1 de enero de 2021 y el 31 de diciembre de 2021,
seleccionados por muestreo no probabilístico por conveniencia. Intervención: Identificación de la transformación hemorrágica en
un estudio de neuroimagen, determinación del estado funcional y la mortalidad a
los 30 y 90 días. El criterio de valoración primario fue la transformación
hemorrágica relacionada con los índices neutrófilo/linfocitoy
plaqueta/linfocito, y con la escala de Rankin modificada a 30 y 90 días. Resultados: Se incluyeron 188 pacientes. La prevalencia de
transformación hemorrágica fue del 12,8%. La mortalidad en transformación
hemorrágica a 30 días fue del 16,7%. El índice neutrófilo/linfocito promedio
fue de 5,81 (DE ± 6,29) y un valor >4,67 predijo la transformación
hemorrágica. El índice neutrófilo/linfocito >3,46 predijo un valor 5-6 en la
escala de Rankin modificada a 90 días. El índice plaqueta/linfocito promedio
fue de 192 (DE ± 150), sin alcanzar capacidad predictiva. La glucemia >140
mg/dl se asoció con transformación hemorrágica. Conclusiones: El índice neutrófilo/linfocito tuvo una asociación
directamente proporcional con el incremento del riesgo de transformación
hemorrágica y con peores resultados funcionales a 90 días. No se halló esta
asociación con el índice plaqueta/linfocito.
Palabras clave: Infarto cerebral; hemorragia cerebral; daño por
reperfusión; neutrófilo; linfocito; plaqueta.
Abstract
Objective: To associate the neutrophil-to-lymphocyte ratio and
platelet-to-lymphocyte ratio with hemorrhagic transformation in neurocritical
patients with acute ischemic stroke. Design: Retrospective, analytical, observational,
cross-sectional study. Scope: Neurological Intensive Care Unit, National
Neurological and Neurosurgical “Manuel Velasco Suarez” Institute, Mexico City,
Mexico. Patients: Adults >18 years with acute ischemic stroke,
hospitalized from January 1, 2021 to December 31, 2021, selected by non-probabilistic
convenience sampling. Intervention:
Identification of hemorrhagic transformation in a
neuroimaging study, functional status and mortality evaluation at 30 and 90
days. The primary endpoint was hemorrhagic transformation related to neutrophil-to-lymphocyte
ratio and platelet-to-lymphocyte ratio and with modified Rankin scale at 30 and
90 days. Results: 188 patients were included. The prevalence of
hemorrhagic transformation was 12.8%. Mortality in hemorrhagic transformation
at 30 days was 16.7%. The mean neutrophile-to-lymphocyte ratio was 5.81 (SD ±
6.29) and a value >4.67 predicted hemorrhagic transformation.
Neutrophil-to-lymphocyte ratio >3.46 predicted a modified Rankin scale of
5-6 at 90 days. The mean platelet-to-lymphocyte ratio was 192 (SD ± 150),
without predictive capacity. Glycemia>140 mg/dL was associated with
hemorrhagic transformation. Conclusions:
A directly proportional association was observed
between neutrophil-to-lymphocyte ratio and increased risk of hemorrhagic
transformation and worse functional results at 90 days. Platelet-to-lymphocyte
ratio showed no association.
Keywords: Ischemic stroke; cerebral hemorrhage; reperfusion
injury; neutrophil; lymphocyte; platelet.
Introducción
La enfermedad
cerebrovascular (ECV) aguda de tipo isquémico es un importante problema de
salud pública en el mundo, debido a las altas tasas de morbilidad y mortalidad
asociadas.1,2 Representa aproximadamente el 85%
de las causas dentro del espectro de la ECV,3,4 y se define como la pérdida o
interrupción súbita del flujo sanguíneo en un territorio del sistema nervioso
central (cerebro, médula espinal o retina) que ocasiona un infarto focal en la
zona anatómica afectada y se manifiesta clínicamente como un déficit reciente
en una función neurológica.5
En México,
según el reporte del Boletín Epidemiológico Nacional, la frecuencia de ECV fue
de 41.288 casos en 2021 y se incrementó a 52.181 en 2022.6 La complicación más grave del ictus
isquémico es la transformación hemorrágica (TH), la cual puede ser inducida por
la evolución natural de la enfermedad o presentarse como complicación de la
terapia de reperfusión. La TH se presenta entre el 10-40% de los casos y
condiciona un incremento de la mortalidad.4,7,8
Las dos
principales clasificaciones utilizadas para evaluar la TH se basan en criterios
clínicos y radiológicos. De acuerdo conlos criterios clínicos, la TH puede ser
sintomática o asintomática. Para evitar sesgos en las definiciones, el European
Cooperative Acute Stroke Study (ECASS II) requiere que, para que la TH sea
considerada sintomática, además de la hemorragia, debe haber un deterioro
neurológico concurrente de >4 puntos en la escala NIHSS (National Institutes
of Health Stroke Scale).8 La clasificación radiológica más
empleada es la del ECASS, la cual emplea la tomografía de cráneo simple y
divide la gravedad de la TH en dos: Infarto Hemorrágico (IH) y Hemorragia
Parenquimatosa (HP), cada una de las cuales se subdivide,a su vez, en dos categorías.8,9 Los grados más graves señalan
peores resultados funcionales y un incremento de la mortalidad. De esta manera,
la hemorragia parenquimatosa II se asocia con deterioro neurológico (cociente
de probabilidades [odds ratio, OR] 32,3) e incremento de la mortalidad
al tercer mes (OR 18).10 Otro sistema de clasificación
desarrollado con el objetivo de incrementar el acuerdo intraobservadore
interobservador es la clasificación de hemorragia de Heidelberg.4
Algunos de
los principales factores de riesgo asociados con TH son: la edad, la crisis
hipertensiva en el momento del ictus isquémico, la fibrilación auricular, la
hiperglucemia, la fiebre, la gravedad del infarto, evaluada mediante la escala
NIHSS. En este sentido, los puntajes de la NIHSS de entre 5 y 10 indican un
riesgo del 1,6% de TH, mientras que el riesgo se incrementa hasta el 6,8% con
valores >21.11 De igual forma, el puntaje ASPECTS (Alberta
Stroke Program Early CT Score) <5 se relaciona con un aumento del riesgo
de TH, lo mismo que una colateralidad vascular disminuida.7 Estas variables han sido incluidas en algunas
escalas que permiten inferir el riesgo de TH con diferente poder predictivo.12
El proceso
inflamatorio es fundamental en la patogenia y se relaciona con la rotura de la
barrera hematoencefálica y el daño relacionado con la reperfusión.13 En este contexto, varios estudios clínicos han
evaluado la utilidad de los marcadores inflamatorios, como los índices
neutrófilo/linfocito (INL) y plaqueta/linfocito (IPL) en pacientes con ECV
isquémica y TH, y en la mayoría de los estudios, se halló una correlación
positiva, es decir, mientras más altos son el INL o el IPL, mayor es la
probabilidad de TH.14-19 Para predecir la TH, el mejor valor predictivo
reportado del INL varía entre ≥3,89 y ≥10,59, mientras que, para el IPL, es de
157 para el IH y de 146 para la HP, respectivamente, sobre la base de la
clasificación del ECASS.14-19 En
el estudio de Zhang et al, el INL alcanzó un OR de 1,53 (IC95% 1,21-1,92; p
<0,05) para predecir la TH en pacientes con ictus isquémico, mientras que el
OR fue de 1,10 (IC95% 1,05-1,15; p <0,05) para predecir el incremento de la
mortalidad a los tres meses.19
Basados en
los resultados de estas investigaciones que incluyeron principalmente a una
población asiática, el objetivo de este estudio fue evaluar la utilidad del INL
y el IPL medidos al ingreso, como factores predictivos de TH en una población
adulta con ECV isquémica aguda,en una unidad de cuidados intensivos de un
centro neurológico de referencia de la Ciudad de México. Además, se
determinaron la prevalencia de TH y los valores promedios de INL e IPL, así
como su relación con el resultado funcional.
Pacientes y Métodos
Diseño del estudio
Estudio
observacional, analítico, retrospectivo, transversal, llevado a cabo en la
Unidad de Cuidados Intensivos Neurocríticos del Instituto Nacional de
Neurología y Neurocirugía. Se trata de un hospital de tercer nivel en la Ciudad
de México que cuenta con 126 camas censables y tres principales áreas de
hospitalización: Neurología, Neurocirugía y Psiquiatría. La Unidad de Cuidados
Intensivos Neurocríticos tiene nueve camas que cuentan con equipos de monitoreo
hemodinámico multiparamétrico, monitorización de la presión intracraneal
invasiva y no invasiva, Doppler transcraneal, electroencefalograma continuo,
monitorización de la saturación de oxígeno del bulbo yugular, monitorización de
la oxigenación por espectroscopia (near-infrared spectroscopy, NIRS).
Población del estudio
Se incluyó a pacientes >18 años con ECV
isquémica aguda, hospitalizados entre el 1 de enero de 2021 y el 31 de
diciembre de 2021. Los criterios de inclusión fueron: a) citometría hemática al ingresar, b)
estudio de neuroimágenes al ingresar, con registro del puntaje ASPECTS, c)
estudio de neuroimagen (tomografía o resonancia magnética) en las siguientes 48
horas, d) registro de la condición funcionalmediante la escala de Rankin
modificada (ERm) a los 30 y 90 días.
Se creó una
base de datos a partir de las historias clínicas revisadas que incluyó
información sociodemográfica, clínica, marcadores biométricos y diversas
escalas pronósticas de pacientes neurocríticos [APACHE II, ASPECTS, NIHSS,
ECASS]. Se calcularon el INL y el IPL sobre la base de los resultados de la
primera biometría hemática obtenida al ingresar en la institución. Se indicó trombólisis, trombectomía mecánica o
ningún tratamiento (manejo conservador).
Se definió TH
a la presencia de sangre dentro del área del infarto registrada en los estudios
de neuroimágenes. Se empleó la escala ECASS II para clasificar la TH mediante
tomografía de cráneo. Esta escala se divide en: a) infarto hemorrágico 1:
sangrado petequial pequeño, a lo largo de los márgenes del infarto; b) infarto
hemorrágico 2: sangrado petequial
confluente dentro del infarto; c) hemorragia parenquimatosa 1: hematoma en
<30% del área del infarto; d) hemorragia parenquimatosa 2: hematoma en
>30% del área del infarto.8 Se incluyeron todos los tipos de
TH, independientemente de si era sintomática o asintomática.
El resultado
funcional a los 30 o 90 días se informó mediante la ERm.
Análisis estadístico
Las variables
cuantitativas se analizaron con la prueba de la t de Student, y sus
equivalentes no paramétricos, con la prueba de Wilcoxon para muestras
independientes. Las variables cualitativas se analizaron con las pruebas de la
ji al cuadrado de Pearson (c2), cuando fue necesario se usó la prueba exacta de
Fisher. Debido a que los valores del INL y el IPL presentaron una distribución
no gaussiana, se realizó una conversión logarítmica para facilitar el análisis.
Se emplearon métodos multivariados con regresión logística binaria para la
estimación ajustada de riesgos y poder analizar las asociaciones establecidas
en los objetivos primarios y secundarios, entre las variables de estudio. Estos
se reportaron como razón de momios ajustada. Se construyeron curvas ROC (receiver
operating characteristic curves) y el mejor punto de corte se estableció
con el método de Youden; además, se reportó el área bajo la curva. Para todos
los análisis se consideraron significativos los valores inferiores o iguales a
un alfa del 5% (p ≤0,05). Todos los análisis y gráficos se realizaron con el
programa R (R Foundation for Statistical Computing, RGUI), versión 4.2.2
(2022).
Consideraciones éticas
Este estudio
fue aprobado por el comité de investigación y ética del Instituto Nacional de
Neurología y Neurocirugía (protocolo número 77/22) y se llevó a cabo bajo los
estándares de la Declaración de Helsinki de 1964 y todas las regulaciones
mexicanas: Ley General de Salud en materia de investigación en salud (título V,
capítulo único, arts. 96-103) y la Norma Oficial Mexicana NOM-012-SSA3-2012.
Resultados
Luego de
aplicar los criterios de inclusión y exclusión, se incluyó a 188 pacientes con
ECV isquémica. Las principales variables sociodemográficas y clínicas se
describen a continuación y
se resumen en la Tabla.
Tabla
Variables clínico-demográficas de los
pacientes del estudio
|
|
Sin transformación hemorrágica |
Con transformación hemorrágica |
p |
|
n = 163 |
n = 24 |
||
|
Edad, años (X ± DE) |
64.6 ± 15.8 |
63.7 ± 16.6) |
0,82 |
|
Sexo masculino, % |
90 (55,2%) |
13 (54,2%) |
1 |
|
IMC, kg/m2(X ± DE) |
27,4 ± 3,2 |
27,8 (± 2,8) |
0,56 |
|
Normal |
28 (20,6%) |
2 (10%) |
|
|
Sobrepeso |
74 (54,4%) |
14 (70%) |
|
|
Obesidad |
34 (25%) |
4 (20%) |
|
|
Comorbilidades |
|
|
|
|
Hipertensión arterial |
88 (54%) |
14 (58,3%) |
0,86 |
|
Diabetes mellitus |
38 (23,3%) |
7 (29,2%) |
0,71 |
|
Etiología |
|
|
0,88 |
|
Aterotrombótica |
68 (42%) |
11 (45,8%) |
|
|
Cardioembólica |
65 (40,1%) |
11 (45,8%) |
|
|
Disección arterial |
15 (9,3%) |
1 (4,2%) |
|
|
Vasculitis |
12 (8,6%) |
1 (4,2%) |
|
|
Territorio |
|
|
0,48 |
|
ACA |
6 (3,7%) |
2 (8,3%) |
|
|
ACM |
133 (81,6%) |
19 (79,2%) |
|
|
Circulación posterior |
24 (14,7%) |
3 (12,5%) |
|
|
Reperfusión |
|
|
0,31 |
|
Trombectomía |
6 (3,7%) |
1 (4,2%) |
|
|
Trombólisis |
78 (47,9%) |
15 (62,5%) |
|
|
Ninguna |
79 (48,5%) |
8 (33,3%) |
|
|
APACHE II (X ± DE) |
10,3 ± 2,3 |
10,4 (± 2,2) |
0,93 |
|
Presión arterial sistólica, mmHg(X ± DE) |
136 ± 22,7 |
140 (± 19) |
0,34 |
|
Presión arterial diastólica, mmHg(X ± DE) |
78,6 ± 11,9 |
75,8 (± 12,3) |
0,3 |
|
Presión arterial media, mmHg(X ± DE) |
97,7 ± 13,7 |
97,2 (± 11,5) |
0,85 |
|
Glucemia, mg/dl (X ± DE) |
138 ± 36,9 |
152 (± 74,7) |
0,77 |
|
INL (X ± DE) |
5,59 ± 5,44 |
7,3 (± 10,4) |
0,19 |
|
INL (M - RIC) |
4,16 (2,39-7,02) |
5,5 (3,53-6,76) |
|
|
IPL (X ± DE) |
182 ± 107 |
259 (± 313) |
0,58 |
|
IPL (M - RIC) |
159 (107-226) |
159 (120-213) |
|
ACA = arteria cerebral anterior; ACM = arteria cerebral media; APACHE II = Acute Physiology and Chronic Health Disease Classification System II; DE = desviación estándar; IMC = índice de masa corporal; INL = índice neutrófilo/linfocito; IPL = índice plaqueta/linfocito; M = mediana; RIC = rango intercuartílico; X = promedio.
Características generales
En la
población incluida, había un ligero predominio del sexo masculino (55,1%,
n=103), la edad promedio era de 64.4 ± 15.9 años. El índice de masa corporal promedio era de 27,5 ± 3,18 kg/m2. Más de la mitad de los pacientes tenía hipertensión arterial como
principal comorbilidad (54,5%), mientras que una cuarta parte tenía
antecedentes de diabetes mellitus (24,1%). La presión arterial sistólica
promedio era de 136,4 ± 22,2 mmHg; la presión arterial diastólica, de 78,3 ±
12,0 mmHg; y la presión arterial media, 97,6 ±
13,4 mmHg, mientras que la glucemia promedio era de 140 ± 43,4 mg/dl.
Características de la ECV
El 81,3% (152
pacientes) tenía compromiso en el territorio de la arteria cerebral media,
seguido de eventos de la circulación posterior (14,4%; n = 27) y de la arteria
cerebral anterior 4,3% (n = 8).
Las
principales etiologías eran aterotrombótica (42,5%) y cardioembólica (40,9%),
mientras que la disección arterial (8,6%) y la vasculitis (8,1%) resultaron
menos frecuentes.
El puntaje de
la escala NIHSS al ingresar fue 13 (rango intercuartílico 9-18); sin embargo,
hubo casos desde un mínimo de 2 puntos hasta un máximo de 31
puntos.
Se obtuvieron
puntajes ASPECTS en todos los niveles, aunque predominaron aquellos >7; el
más frecuente fue 8. Los puntajes ≤7 representaron el 39,8% (n = 74) en el
grupo general.
En cuanto al
tratamiento, casi la mitad fue sometida a trombólisis (49,7%, n = 93), al 3,7%
(n = 7) se le realizó una trombectomía; y un 46,5% (n = 87) recibió tratamiento
conservador.
La TH de la
ECV fue del 12,8% (n = 24) en la población general. Al dividirla en subgrupos
por tratamiento, las tasas fueron: 14,3% (n = 1/7) para trombectomía, 16,1% (n
= 15/93) para trombólisis y 9,2% (n = 8/87) en el grupo que recibió solo
tratamiento clínico; sin embargo, no hubo diferencias estadísticas entre estos
(p = 0,31).
En conjunto,
aproximadamente el 16% los pacientes sometidos a tratamiento activo
(trombectomía + trombólisis, n = 100) tuvo TH comparado con el 9,2% de aquellos
que recibieron un tratamiento conservador (p = 0,24).
INL e IPL como factores predictivos de TH
La
distribución de los valores de ambos índices (INL e IPL) fue extremadamente
asimétrica y con una amplia variabilidad entre los pacientes, por lo que se
usaron análisis no paramétricos por esta condición. La transformación
logarítmica de los valores corrigió el sesgo de distribución, pero añadió
dificultades en la interpretación de los valores.
En el
análisis bivariado, el INL en el grupo sin TH (n = 163) (X = 5,59; ± desviación
estándar [DE] 5,44) versus el grupo con TH (n = 24) (X = 7,30; ± DE 10,4) no
alcanzó una diferencia estadística (p= 0,19). Los hallazgos fueron similares
para el IPL: grupo sin TH (X = 182; ± DE 107) versus grupo con TH (X = 259; ±
DE 313), sin diferencias estadísticas (p= 0,58). Considerando que la TH es un
fenómeno sobre el que pueden influir otros factores, se realizó un análisis
multivariado donde no se observaron diferencias estadísticamente significativas
entre ambos grupos. Se destaca la tendencia observada de los pacientes con
hiperglucemia (mg/dl) en quienes se
observa por cada punto de incremento por sobre el promedio (140 mg/dl), el
riesgo de TH aumenta aproximadamente 1% (p = 0,08). Otros factores que se
evaluaron y mostraron tendencia a incrementar el riesgo de TH fueron el índice
de masa corporal con sobrepeso y obesidad, la trombólisis, el puntaje ASPECTS
<7, mientras que la ECV por disección arterial o vasculitis, el ictus en
territorio de la arteria cerebral media y de circulación posterior mostraron
una tendencia hacia un menor riesgo de TH. Además,el INL y algo menos
consistente el IPL tuvieron una discreta tendencia hacia un mayor riesgo; sin
embargo, ninguno de estos parámetros alcanzó significancia estadística.
TH y desenlace clínico funcional
La TH de la
ECV tuvo una fuerte asociación con malos desenlaces (ERm 5-6) a los 30 días de
hospitalización. El 13% deaquellos sin TH tuvo un mal desenlace (ERm 5-6)(n =
21/162; ERm 5 = 15; ERm 6 = 6), mientras el 45,8% de quienes sí tuvieron una TH presentaron un mal
desenlace [n = 11/24; ERm 5 = 7, ERm 6 = 4, (p <0,001)] (Figura 1).
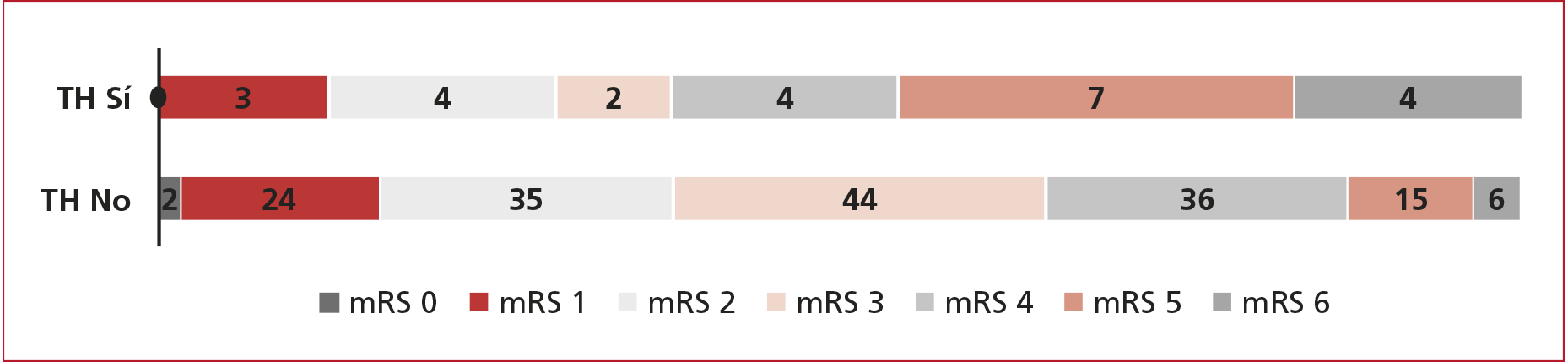
Figura 1. Distribución de los puntajes de la escala de Rankin modificada (modified Rankin scale, mRS) según la transformación hemorrágica a los 30 días.
Para el día
90, predominó el grupo con ERm 3 (24,7%) entre aquellos sin TH, seguido de ERm
4 (21%) y ERm 2 (20,4%). Mientras que, en el grupo con TH, predominaron
aquellos con ERm 5 (25%), seguido de ERm 6, con un incremento importante en
este subgrupo, llegó
hasta el 20,8% y, en menor proporción,ERm 2 y ERm 3 con un 16,7% (Figura 2).
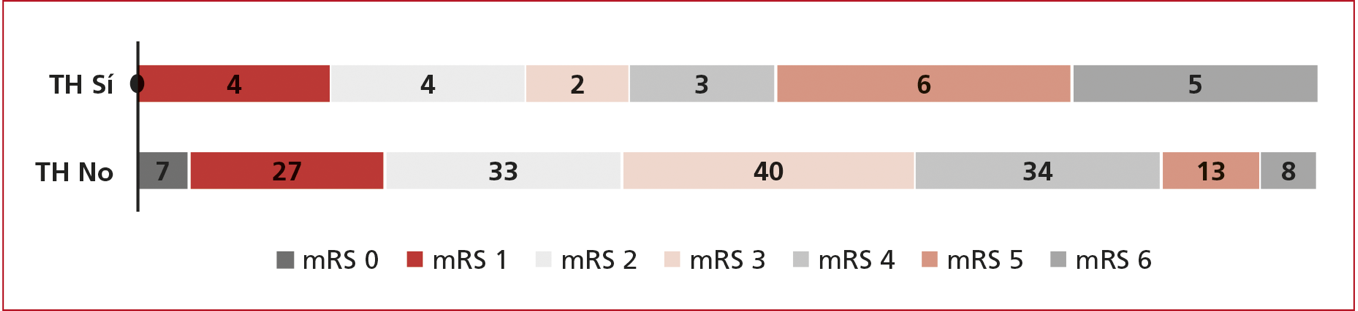
Figura 2. Distribución de los puntajes de la escala de Rankin modificada (modified Rankin scale, mRS) según la transformación hemorrágica-enfermedad cerebrovascular a los 90 días.
Predicción de la TH y desenlace clínico funcional
La capacidad
predictiva del INL con el modelo multivariado alcanzó una especificidad del 63,2% (IC95% 55,8-71,2%); una
sensibilidad del 66,7% (IC95% 45,8-83,3%), un área bajo la curva de 0,671. El
valor del INL ≥4,67 se correspondió con el mejor punto de corte (sin ajuste)
para predecir la TH (Figura 3).
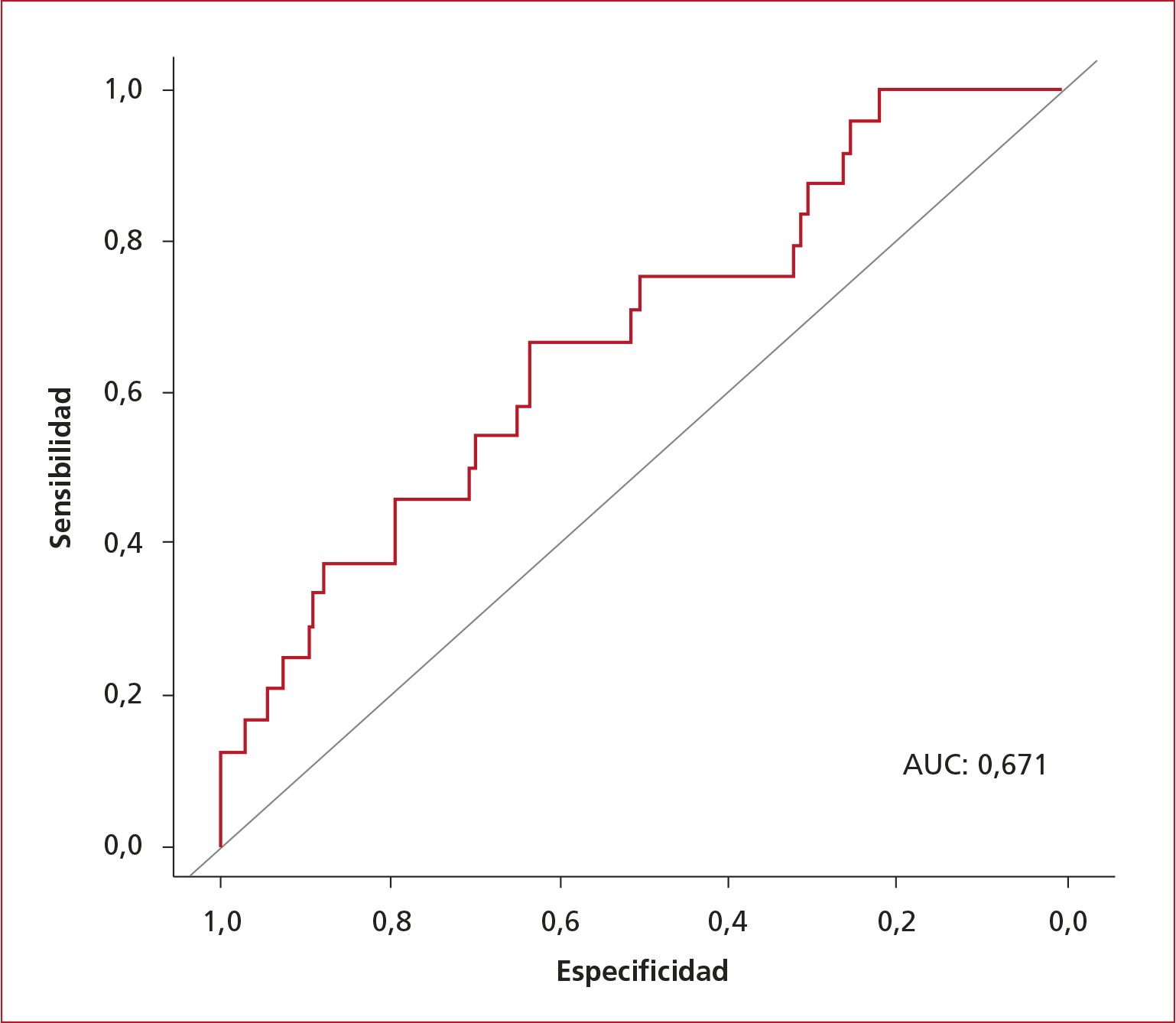
Figura 3. Área bajo la curva (area under the curve, AUC) del índice neutrófilo/linfocito para predecir la transformación hemorrágica.
Además, el
logINL tuvo una fuerte asociación con un mal desenlace a los 90 días (ERm5 y
ERm6), con un OR de 2,45 (IC95% 1,45-4,32; p = 0,001). El área bajo la curva
para esta predicción en el modelo ajustado, multivariado fue de 0,74, con una
especificidad del 66,7% (IC95% 59-75%) y una sensibilidad del 75% (IC95%
59-88%). Los valores mayores a logINL de 1,24 (equivalentes a INL ≥3,46) fueron
adecuados como puntos de corte para predecir malos resultados funcionales.
Por otro
lado, el IPL no logró determinar la capacidad predictiva para la TH ni para
predecir el desenlace funcional.
Finalmente,
al analizar otros resultados, no se halló una correlación entre el tiempo de
hospitalización (días) y los índices citométricos estudiados. Para el INL
medido al ingresar, la correlación fue prácticamente nula (r = 0,08; p = 0,25),
inclusive usando valores con transformación logarítmica, la prueba no
paramétrica (Spearman) arrojó resultados similares (rho = 0,16; p = 0,03). Con
respecto al IPL, el resultado fue análogo al encontrado para el INL, la
correlación fue de r = 0,08 (p = 0,26) y de rho = 0,11 (p = 0,13).
Discusión
La ECV es una
de las principales causas de morbilidad y muerte en el mundo, lo que genera un
gran costo para todos los sistemas de salud y reduce la calidad de vida de los
enfermos que la padecen.
A pesar de
los avances en el tratamiento de la reperfusión de la ECV, las complicaciones
que ocurren en el período agudo, como la TH, incrementan la mortalidad y
condicionan peores resultados clínicos funcionales en los sobrevivientes.7 Esta premisa también se comprobó en este estudio, ya que los peores
resultados funcionales y la muerte fueron más frecuentes en quienes
desarrollaron TH comparados con los que no (45,8% vs. 13%) (p <0,001).
Las variables
demográficas descritas en nuestro estudio son similares a las publicadas en
otras investigaciones que analizaron la utilidad de los índices citométricos
como factores predictivos en pacientes con ECV.14-19
La TH en la
muestra general de este estudio fue del 12,8%, incluidos todos los subtipos
(sintomáticos y asintomáticos). Aproximadamente el 46,5% de los enfermos llegó
fuera de ventana terapéutica y,por lo tanto, no fueron candidatos para la
terapia de reperfusión, mientras que únicamente el 3,7% fue sometido a
trombectomía mecánica.
Estos valores
son inferiores a los comunicados en el estudio de Honig et al, en el cual, la
TH fue del 32% frente al 20% en los no trombolizados.8 Se sabe que la trombólisis incrementa el
riesgo de TH del subtipo 2 de hemorragia parenquimatosa (OR 5,55; IC95%
4,01-7,70, p <0,0001) (6,8% vs. 1,3%).20
Este
porcentaje más alto de TH observado en la población asiática se corresponde con
la mayor proporción de TH asociada a trombólisis en la región este de Asia.21
Uno de los
estudios más grandes que evaluó la utilidad del INL y el IPL como factores predictivos de TH fue el
metanálisis de Zhang et al, con 3726 enfermos, en el que se estableció un OR de
1,53 para el INL como factor predictivo de TH.19
En el estudio
de Yang et al que evaluó también ambos índices citométricos como factores
predictivos de TH, el área bajo la curva del IPL fue de 0,72 (IC95% 0,64-0,80;
p <0,001), mientras que, para el INL, fue de 0,67 (IC95% 0,58-0,76; p
<0,001).17 Este último hallazgo para el INL es muy
similar al obtenido en nuestro estudio. Además, en ese estudio, los autores
informaron que el IPL se asoció con un incremento de la TH en todos los
subtipos de ictus de etiología aterosclerótica (OR 1,699; IC95% 1,29-3,21; p
<0,001), así como el incremento de la tasa de mortalidad intrahospitalaria
por TH (OR 1,04; IC95% 1,006-1,007; p 0,02).17 Estos últimos hallazgos contrastan con los de
nuestro estudio, donde el IPL no logró significancia estadística en ninguna
categoría.
Con respecto
al valor de corte para predecir la TH, en estudios previos, se han comunicado
valores que varían entre ≥3,89 y ≥10,59 para el INL.14-19 En nuestro estudio, el valor
promedio de INL fue de 5,59 ± 5,44 que, a pesar de estar dentro del rango de lo
informado en los estudios descritos, no alcanzó una significancia estadística
(p= 0,19).
Para el caso
del IPL, el valor promedio en el grupo con TH fue de 259 ± 313 y tampoco
alcanzó una significancia estadística (p= 0,58); sin embargo, fue ampliamente
diferente del reportado por otros autores, cuyo valor de corte con capacidad
predictiva para TH fue de 157.15,17
En este
estudio, se evaluó la asociación entre el INL y el IPL con la TH en la ECV, y
se logró establecer que los valores mayores de INL e IPL se relacionaban con un
riesgo más alto de TH (pese a no alcanzar significancia estadística, se observó
una tendencia directamente proporcional). La falta de significancia probablemente
se deba a que la muestra fue insuficiente o muy heterogénea. Por otra parte, el
INL sí se relacionó de manera importante y con buena capacidad para predecir un
pobre resultado funcional (ERm 5-6) a los 90 días, pero el IPL no logró
alcanzar esta capacidad predictiva.
Otro punto
importante es que el INL y el IPL también se han empleado para predecir el
éxito de las terapias de reperfusión. En un ensayo retrospectivo que incluyó a
282 enfermos sometidos a trombectomía mecánica, los valores de INL e IPL fueron
más altos en aquellos que no lograron una reperfusión exitosa (TICI 0-2a). Para
el INL el valor de corte fue de 6,2 y alcanzó un área bajo la curva de 0,63 (IC95% 0,54-0,72; p
<0,001), mientras que, para IPL, el valor de corte fue de 103,6, con un área
bajo la curva de 0,65 (IC95% 0,57-0,73; p <0,001).19 Estas variables no se analizaron en nuestro
estudio, pero representan otras posibles utilidades de estos índices
citométricos.
Las
principales ventajas de nuestro estudio son la inclusión para el análisis de
múltiples variables que podrían interferir con la asociación estadística.
Además, se analizó la relación entre los índices citométricos con los
resultados funcionales, y se logró hallar una asociación para el INL. Esto
permite que las variables estudiadas, fáciles de obtener y no costosas, puedan
ser evaluadas en otros estudios para confirmar los resultados o encontrar otras
probables asociaciones.
Entre las
desventajas, se destaca el tamaño pequeño y la heterogeneidad de la muestra.
Esto limita la generalización de los resultados y su validez externa, por lo
que, antes de implementar estos hallazgos en la práctica clínica, se requiere
un análisis adicional con una muestra de mayor tamaño y con menor
heterogeneidad. Además, su diseño retrospectivo también disminuye la calidad de
la evidencia.
Conclusiones
Se observó que la prevalencia de TH en enfermos
con ECV aguda es inferior a la comunicada en otras series internacionales; sin
embargo, es mayor en el grupo de los sometidos a trombólisis. Además, el INL
tiene una asociación directamente proporcional con el incremento del riesgo de
TH y con un pobre resultado funcional a los 90 días. Por otra parte, no se
logró demostrar la capacidad del IPL para predecir la TH ni los resultados
funcionales. Otro factor de riesgo asociado con la TH fue la hiperglucemia.
En pro de
reducir los sesgos estadísticos del estudio, se requiere replicar este análisis
en una muestra de mayor tamaño para mejorar su validez externa.
Agradecimiento
A todos los
profesionales que colaboraron con la ejecución de este estudio, al equipo de
Terapia Intensiva Neurológica del Instituto Nacional de Neurología Manuel
Velasco Suárez de la Ciudad de México.
Bibliografía
1. Campbell BCV, Khatri P. Stroke. Lancet
[Internet] 2020; 396(10244):129-142. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S014067362031179X
2. Phipps MS, Cronin CA. Management of acute ischemic
stroke. BMJ
[Internet] 2020;368:l6983. Disponible en: https://www.bmj.com/lookup/doi/10.1136/bmj.l6983
3.
European
Stroke Organization. Guidelines for management of ischaemic stroke and
transient ischaemic attack. Cerebrovasc Dis 2008; 25: 457-507. https://doi.org/10.1159/000131083
4.
Powers WJ,
Rabinstein AA, Ackerson T, et al. Guidelines for the early management of
patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the
early management of acute ischemic stroke a guideline for healthcare
professionals from the American Heart Association/American Stroke A. Stroke
2019; 50: 344-418. https://doi.org/10.1161/STR.0000000000000211
5.
Campbell
BCV, De Silva DA, Macleod MR, et al. Ischaemic
stroke.Nat Rev Dis Prim [Internet] 2019;5(1).Disponible en: http://dx.doi.org/10.1038/s41572-019-0118-8
6. Sistema
Nacional de Vigilancia Epidemiológica. Histórico Boletines epidemiológicos.
México. Secretaría de Salud. Dirección Nacional de Epidemiología. 2021.
Disponible en: https://www.gob.mx/salud/acciones-y-programas/historico-boletin-epidemiologico
7.
Hong JM,
Kim DS, Kim M. Hemorrhagic transformation after ischemic stroke: Mechanisms and
management. Front Neurol 2021;12:703258. https://doi.org/10.3389/fneur.2021.703258
8.
Honig A,
Percy J, Sepehry AA, Gomez AG, Field TS, Benavente OR. Hemorrhagic
transformation in acute ischemic stroke: A quantitative systematic review. J
Clin Med 2022;11(5): 1162. https://doi.org/10.3390/jcm11051162
9.
MarcellLászló
J, Hortobágyi T. Hemorrhagic transformation of ischemic stroke. Vasc Dis Therap
2017; 2:1-25. https://doi.org/10.15761/VDT.1000130
10. Hacke W,Kaste M,Fieschi C, et al. Randomised
double-blind placebo-controlled trial of thrombolytic therapy with intravenous
alteplase in acute ischaemic stroke (ECASS II). Second European-Australasian
Acute Stroke Study Investigators.Lancet 1998; 352: 1245-1251. https://doi.org/10.1016/s0140-6736(98)08020-9
11. Yaghi S, Willey JZ, Cucchiara B, Goldstein JN,
Gonzales NR, Khatri P, Kim LJ, Mayer SA, Sheth KN, Schwamm LH; American Heart
Association Stroke Council; Council on Cardiovascular and Stroke Nursing;
Council on Clinical Cardiology; and Council on Quality of Care and Outcomes
Research. Treatment and Outcome of Hemorrhagic Transformation After Intravenous
Alteplase in Acute Ischemic Stroke: A Scientific Statement for Healthcare
Professionals From the American Heart Association/American Stroke Association. Stroke2017;48(12):e343-e361.
https://doi.org/10.1161/STR.0000000000000152
12. Marsh EB, Llinas RH, Schneider ALC, et al. Predicting
hemorrhagic transformation of acute ischemic stroke: Prospective validation of
the HeRS score. Medicine (Baltimore) 2016;95(2):1-8. https://doi.org/10.1097/MD.0000000000002430
13. Spronk E, Sykes G, Falcione S, et al. Hemorrhagic
transformation in ischemic stroke and the role of inflammation. Front Neurol
2021;12: 661955. https://doi.org/10.3389/fneur.2021.661955
14. Song M, Graubard BI, Rabkin CS, Engels EA. Neutrophil-to-lymphocyte ratio and mortality in the
United States general population.Sci Rep [Internet] 2021;11(1):1-9. Disponible
en: https://doi.org/10.1038/s41598-020-79431-7
15. Lee SH, UkJang M, Kim Y, et al. The
neutrophil-to-lymphocyte and platelet-to-lymphocyte ratios predict reperfusion
and prognosis after endovascular treatment of acute ischemic stroke. J Pers Med
2021;11(8): 696. https://doi.org/10.3390/jpm11080696
16. Pikija S, Sztriha LK, Killer-Oberpfalzer M, et al.
Neutrophil to lymphocyte ratio predicts intracranial hemorrhage after
endovascular thrombectomy in acute ischemic stroke. J Neuroinflammation
2018;15(1): 319. https://doi.org/10.1186/s12974-018-1359-2
17. Yang Y, Xie D, Zhang Y. Increased
platelet-to-lymphocyte ratio is an independent predictor of hemorrhagic
transformation and in-hospital mortality among acute ischemic stroke with
large-artery atherosclerosis patients. Int J Gen Med 2021;14:7545–7555. https://doi.org/10.2147/IJGM.S329398
18. Świtońska
M, Piekuś-Słomka N, Słomka A, Sokal P, Zėkanowska E, Lattanzi S. Neutrophil-to-lymphocyte ratio
and symptomatic hemorrhagic transformation in ischemic stroke patients
undergoing revascularization. Brain Sci 2020;10(11):1-9. https://doi.org/10.3390/brainsci10110771
19. Zhang R, Wu X, Hu W, et al. Neutrophil-to-lymphocyte
ratio predicts hemorrhagic transformation in ischemic stroke: A meta-analysis.
Brain Behav 2019;9(9):e01382. https://doi.org/10.1002/brb3.1382
20. Emberson J, Lees KR,Lyden P, et al. Effect of
treatment delay, age, and stroke severity on the effects of intravenous
thrombolysis with alteplase for acute ischaemic stroke: A meta-analysis of
individual patient data from randomised trials. Lancet 2014; 384: 1929-1935. https://doi.org/10.1016/S0140-6736(14)60584-5
21. JiaW,Liao X, Pan Y, et al.Thrombolytic-related
asymptomatic hemorrhagic transformation does not deteriorate clinical outcome:
Data from TIMS in China. PLoSOne
2015; 10(11): e0142381. https://doi.org/10.1371/journal.pone.014238