Implementación de la ventilación mecánica protectora
en pacientes con síndrome de dificultad respiratoria aguda. Revisión
narrativa
[Implementation
of protective mechanical ventilation in patients with acute respiratory
distress syndrome. Narrative
review]
Magdalena Botto,1# Juan Manuel Carballo,2,3# María Eugenia Dotta,2,4# María Lucía Giménez,5# Norberto Tiribelli2,3,#*
1 Hospital Interzonal General de Agudos
Vicente López y Planes,
Gral. Rodríguez, Buenos Aires, Argentina
2 Complejo Médico de la Policía Federal
Argentina “Churruca Visca”, Ciudad Autónoma de Buenos Aires, Argentina
3 Hospital General de Agudos Donación
Francisco Santojanni, Ciudad Autónoma de Buenos Aires, Argentina
4 Hospital Interzonal General de Agudos
Pedro Fiorito, Buenos Aires, Argentina
5 Sanatorio de la Trinidad Mitre, Ciudad
Autónoma de Buenos Aires, Argentina
# Capítulo de Kinesiología Intensivista,
Sociedad Argentina de Terapia Intensiva, Ciudad Autónoma de Buenos Aires,
Argentina
* Correspondencia: nortiribelli@gmail.com
Los
autores no declaran conflictos de intereses.
Resumen
La ventilación mecánica
protectora reduce la mortalidad en pacientes con síndrome de dificultad
respiratoria aguda. Sin embargo, estudios epidemiológicos muestran que muchos
no reciben el tratamiento ni el monitoreo ventilatorio adecuados. En esta
revisión narrativa, se analizan estudios que evaluaron estrategias de
ventilación mecánica en pacientes con síndrome de dificultad respiratoria
aguda, con el objetivo de describir los aspectos más relevantes del manejo de
la ventilación mecánica durante la fase inicial del síndrome. El chequeo del
respirador y el ensamblado de las interfaces permiten corregir el volumen
compresible, acondicionar el gas inspirado y minimizar el espacio muerto
instrumental. La elección del modo ventilatorio, del volumen corriente y de la
frecuencia respiratoria iniciales permite asegurar una correcta ventilación por
minuto. La PEEP y la FiO2 son las variables más relevantes para
mantener una adecuada oxigenación. El monitoreo de la mecánica respiratoria,
del intercambio gaseoso y de la sincronía paciente-respirador permite evaluar
la respuesta a intervenciones terapéuticas, detectar complicaciones y efectuar
correcciones. La elección del momento adecuado para iniciar la transición desde
la ventilación controlada hacia la fase de soporte ventilatorio parcial y el
inicio de la desconexión es un desafío importante para disminuir los riesgos
relacionados con la ventilación mecánica prolongada. El manejo de la
ventilación mecánica en pacientes con síndrome de dificultad respiratoria aguda
puede ser un factor determinante de su evolución. Los conceptos y las
herramientas descritos en los protocolos publicados son clave para favorecer
una ventilación mecánica segura, eficaz, y mejorar los resultados de los
pacientes con este síndrome.
Palabras
clave: Síndrome de
dificultad respiratoria aguda; ventilación mecánica; volumen corriente;
frecuencia respiratoria; fracción inspirada de oxígeno; presión positiva de fin
de espiración; monitoreo respiratorio; sincronía paciente-respirador;
desconexión de la ventilación mecánica.
Abstract
Protective
mechanical ventilation has been shown to reduce mortality in patients with
acute respiratory distress syndrome. However, epidemiological studies show that
many patients do not receive adequate treatment or ventilation monitoring. We
conducted a narrative review and analyzed the studies that evaluated mechanical
ventilation strategies in patients with acute respiratory distress syndrome,
with the aim of describing the most relevant aspects of mechanical ventilation
management during the initial phase of acute respiratory distress syndrome. The
ventilator check and the interfaces assembly allow correcting the compressible
volume, conditioning the inspired gas, and minimizing the instrumental dead
space. The selection of the ventilation mode, the initial tidal volume and
respiratory rate allows to ensure correct minute ventilation. The PEEP and FiO2 are the most relevant
variables to maintain adequate oxygenation. Monitoring respiratory mechanics,
gas exchange, and patient-ventilator synchrony makes it possible to assess the
response to therapeutic interventions, detect complications, and make
corrections. Choosing the right moment to start the transition from controlled
ventilation to the phase of partial ventilatory support and the initiation of
weaning is a major challenge to reduce the risks associated with prolonged
mechanical ventilation. The management of mechanical ventilation in patients
with acute respiratory distress syndrome may be a determinant of their
evolution. The concepts and tools described in the published protocols are key
to promoting safe and effective mechanical ventilation and improving the
results of patients with acute respiratory distress syndrome.
Keywords: Acute respiratory distress
syndrome; mechanical ventilation; tidal volume; respiratory rate; fraction of
inspired oxygen; positive end-expiratory pressure; respiratory monitoring;
patient-ventilator synchrony; weaning from mechanical ventilation.
1. Introducción
Desde la
descripción del síndrome de dificultad respiratoria aguda (SDRA) en 1967, la
ventilación mecánica (VM) ha sido el tratamiento de soporte fundamental para
los pacientes.1
La evidencia
de que la VM puede provocar daño per se a través de distintos
mecanismos, independientemente del compromiso pulmonar ocasionado por la
enfermedad de origen, ha llevado al desarrollo de estrategias de VM
“protectoras”.2-6
Así, se ha
comprobado que el ajuste de algunos parámetros de la VM, como la reducción del
volumen corriente (VC) y la limitación de la presión meseta (PM), tienen un
efecto positivo sobre la tasa de mortalidad, los días libres de VM y los días
libres de fallas orgánicas no pulmonares.7
Más
recientemente, se ha demostrado que otras variables también tienen una fuerte
asociación con la tasa de mortalidad, como la ventilación de espacio muerto,8 la presión de distensión (driving pressure)
(PD) y la potencia mecánica;9,10 mientras que el efecto de otros parámetros,
como la presión positiva de fin de espiración (positive end-expiratory
pressure, PEEP) sigue siendo objeto de discusión y debate.11
La
transferencia de la información publicada en los ensayos clínicos a su
aplicación en la práctica clínica puede tener demoras importantes.12 Desde la publicación del estudio de la ARDS
Network,7 se dispone de protocolos de puesta en práctica
de la VM protectora de los estudios más importantes. Sin embargo y, pese a la
creciente evidencia que sustenta el uso de la VM protectora en los pacientes
con SDRA, muchos no reciben el tratamiento ni el monitoreo ventilatorio
adecuados.13
El objetivo
de esta revisión narrativa es describir, analizar y resumir los protocolos de
implementación de la VM protectora en pacientes con SDRA que se han utilizado
en los ensayos clínicos más relevantes, para facilitar su difusión y aplicación
en la práctica asistencial.
Para ello, se
revisaron los estudios prospectivos, aleatorizados y controlados que evaluaron
estrategias de VM protectora en pacientes con SDRA según las definiciones de la
American-European Consensus Conference on ARDS y la Berlin Definition,14,15 y se analizaron los siguientes
aspectos:
• Preparación de las interfaces
paciente-respirador y del respirador mecánico.
• Programación inicial de las variables
ventilatorias.
• Monitoreo de la VM.
• Modificaciones en la programación
inicial de la VM basadas en el intercambio gaseoso (ventilación y oxigenación)
y en la mecánica respiratoria.
• Criterios para iniciar la transición
desde la fase inicial (soporte ventilatorio total) hacia la fase de soporte
ventilatorio parcial e inicio de la desconexión.
En esta
revisión, nos hemos centrado en el análisis y la descripción de la programación
de la VM durante la fase inicial del síndrome. No se incluye, en forma
detallada, el uso de otras herramientas coadyuvantes, como la posición prona,
la analgesia, la sedación y los bloqueantes neuromusculares, ni tampoco las
estrategias utilizadas durante la fase de desconexión de la VM.
2. Preparación inicial de las
interfaces paciente-respirador y del respirador mecánico
2.1. Chequeo inicial del respirador
Antes de
conectar al paciente al respirador, es necesario comprobar y asegurar su
correcto funcionamiento y calibración (funcionalidad técnica, fugas internas,
transductores de presión, celda/sensor de oxígeno, transductores de flujo,
válvula de seguridad, módulos de batería), así como la integridad del circuito
ventilatorio (estanqueidad/hermetismo, resistencia y distensibilidad de las
tubuladuras). Esto permite garantizar la operación adecuada del respirador
mecánico, haciendo confiables la programación de sus parámetros y el monitoreo
de los valores medidos y de los gráficos.16
Para una
correcta calibración se debe seguir la secuencia de pasos establecidas por el
fabricante y, si el equipo lo requiere, contar con elementos específicos
adicionales (pulmones de prueba, tubuladuras especiales).17 De preferencia, la comprobación del
circuito ventilatorio debe realizarse con todas las interfaces correctamente
colocadas, tal como van a ser utilizadas (circuito ventilatorio, filtros,
sistema cerrado de aspiración, humidificador, aerocámara, etc.) evitando
utilizar elementos innecesarios, sobre todo aquellos que puedan aumentar el
espacio muerto instrumental o generar fugas.18
Si el
respirador lo permite, es importante programar el tipo de humidificación para
la calibración adecuada del sensor de flujo espiratorio, de modo que garantice
la precisión de la espirometría y de la entrega del gas.19
2.2. Circuito respiratorio
Se prefiere
utilizar circuitos de baja distensibilidad (hasta 2,5 ml/cmH2O) para minimizar el volumen de compresión. Si la distensibilidad del
circuito es alta, el volumen de compresión puede ser elevado y
alcanzar hasta 19 ± 6% del VC,18 y aumentar el margen de error en el
cálculo del VC corregido.
Siempre es
recomendable, si el respirador lo permite, compensar el VC por el volumen de
compresión, de manera que el equipo de VM corrija automáticamente el VC
suministrado. De este modo, se evita que el volumen que se pierde en la
distensión de las tubuladuras reduzca la entrega efectiva del VC programado.
En caso de
que el respirador no compense el volumen de compresión, puede calcularse según
la siguiente fórmula:18
Volumen de compresión = Distensibilidad del circuito x (presión
inspiratoria pico - PEEP)
A su vez, el VC corregido es:18
VC corregido = VC calculado para el paciente + Volumen de
compresión
2.2.1. Humidificación
Habitualmente,
al comienzo de la VM, se emplean humidificadores pasivos (heat and moisture
exchangers, HME), porque son más económicos y su uso es más simple. Sin embargo, en
el contexto de una estrategia ventilatoria de bajo VC, su rendimiento técnico
puede verse afectado. A su vez, la contribución al espacio muerto instrumental
puede impactar en la ventilación alveolar efectiva. Es recomendable seguir las
especificaciones técnicas del fabricante sobre el uso del HME.20
La
humidificación activa puede garantizar un óptimo acondicionamiento del gas y
disminuir la ventilación por minuto requerida, mejorando el pH y la presión
arterial de dióxido de carbono (PaCO2). El impacto del cambio de
humidificación pasiva por activa es mayor cuando los valores de PaCO2 son más altos y cuando se utilizan VC <6 ml/kg.21-23
Con la
humidificación activa, se sugiere el uso de circuitos con alambre caliente para
minimizar la condensación en el circuito y los filtros, o circuitos con trampas
de agua para facilitar su drenaje.24
En caso de
modificar el tipo de humidificación empleada, es conveniente realizar un
chequeo del circuito con la nueva interfaz que se utilizará.
2.2.2. Filtros bacterianos y virales
El empleo de
filtros bacterianos/virales constituye una indicación en todos los pacientes
que requieren VM a través de una vía aérea artificial, con el objetivo de
remover partículas tanto de los gases inspirados como espirados. Se deben usar
siguiendo las recomendaciones del fabricante.25,26
Si se emplea
un HME, se sugiere usar un filtro en la salida de la rama inspiratoria y otro
en la salida espiratoria del respirador (entre este y la rama espiratoria del
circuito).
En caso de
utilizar humidificadores pasivos con filtro (heat and moisture exchanger
filter, HMEF), se recomienda igualmente usar filtro inspiratorio para
proteger el circuito de impurezas que puedan tener los gases medicinales.26
Si se opta
por la humidificación activa, se sugiere usar un filtro en la rama inspiratoria
y en la rama espiratoria del circuito. Algunos equipos de VM calientan el
filtro espiratorio para minimizar la condensación. Si el equipo de VM dispone
de esa opción, es conveniente activarla durante el chequeo inicial. Si no
cuenta con esa posibilidad, hay que controlar, con frecuencia, si hay
condensación en el filtro espiratorio para evitar su obstrucción.26
En la Figura
1, se muestran diferentes opciones de configuración de la interfaz
paciente-respirador, según el tipo de humidificadores, circuitos y filtros
utilizados.
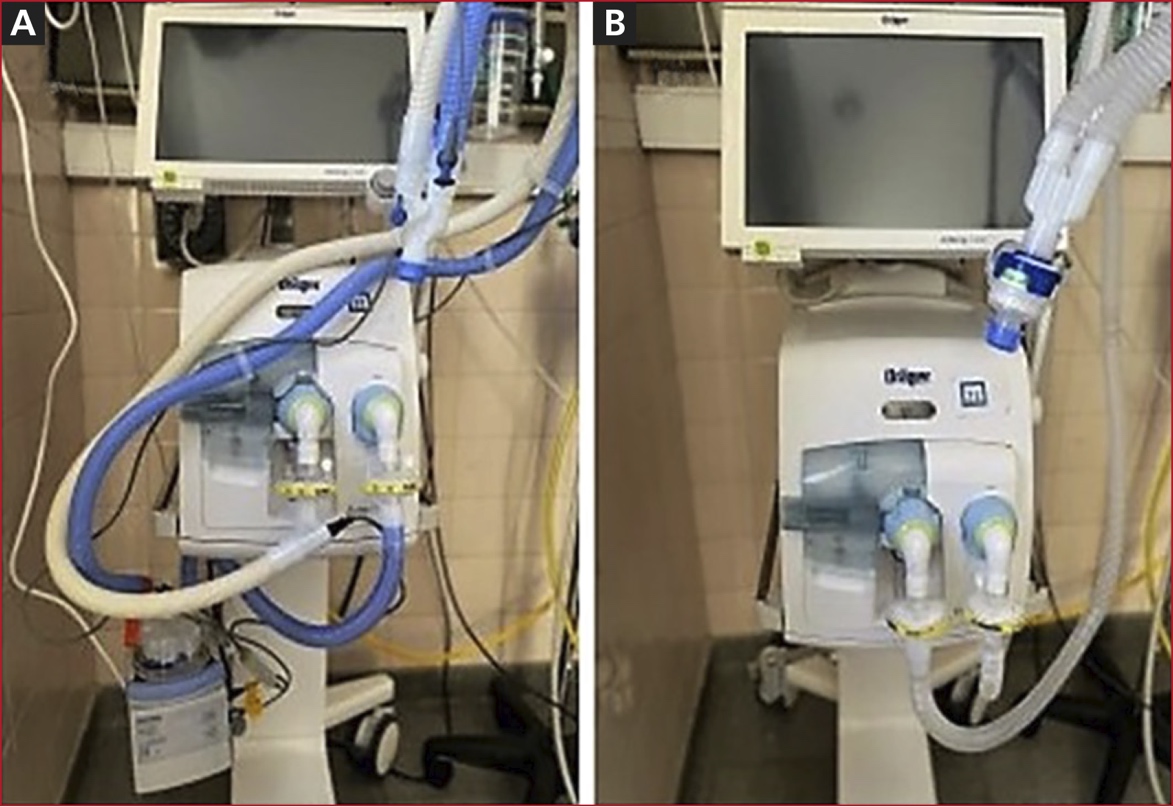
Figura 1. Circuitos respiratorios. A. Circuito respiratorio con humidificador activo, tubuladuras con alambre caliente y filtros bacterianos/virales. B. Circuito respiratorio extensible, con humidificador pasivo y filtros bacterianos/virales.
2.2.3. Sistemas cerrados de aspiración
Para el
manejo de las secreciones bronquiales en los pacientes con VM, los sistemas
cerrados de aspiración brindan ventajas respecto de los sistemas de aspiración
abiertos en cuanto a la bioseguridad y al impacto en el volumen pulmonar.27,28
Aunque no se
ha demostrado que los sistemas cerrados de aspiración reduzcan la incidencia de
neumonía asociada a la VM, se recomienda su uso para disminuir la exposición de
los profesionales de la salud y minimizar la aerosolización de partículas
asociada a la apertura del circuito del respirador.27,29,30
Si
consideramos el volumen pulmonar y la oxigenación durante la aspiración de
secreciones, el empleo de sistemas cerrados de aspiración disminuye el
desreclutamiento y la caída de la saturación de oxígeno (SatO2), en comparación con la aspiración abierta.28,31 Por lo tanto, para el manejo de los
pacientes con SDRA ventilados con una estrategia de protección pulmonar, se
sugiere el uso de rutina de sistemas cerrados de aspiración.
2.2.4. Espacio muerto instrumental
Es
conveniente evitar el uso de interfaces que generen un aumento innecesario o
prescindible del espacio muerto instrumental: catéteres o tubos extensibles,
HME o HMEF de volumen interno excesivo (>60 ml) y conectores. En la Figura
2, se muestran las interfaces y su contribución al espacio muerto instrumental.
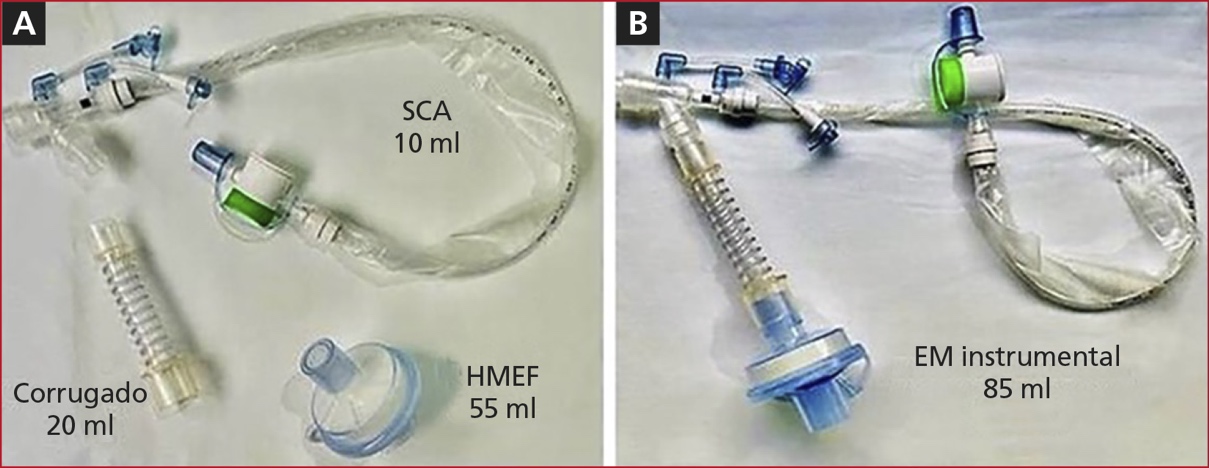
Figura 2. Interfaces y espacio muerto instrumental. A. Interfaces con sus respectivos aportes de espacio muerto instrumental (en mililitros). B. Interfaces conectadas en serie con el aporte total al espacio muerto instrumental.
SCA = sistema cerrado de aspiración; HMEF = heat and moisture exchanger filter; EM = espacio muerto.
El espacio
muerto instrumental debe minimizarse cuando se usa ventilación protectora,
especialmente cuando la frecuencia respiratoria (FR) es >25 respiraciones
por minuto (rpm) o cuando el VC es ≤6 ml/kg de peso corporal
predicho (PCP). Esto mejora la ventilación alveolar, lo cual aumenta la
eliminación de dióxido de carbono (CO2). Si se optara por mantener constante
la PaCO2, la reducción del espacio muerto
instrumental permite una reducción del VC, la FR o la PM y la PD.32
3. Programación inicial de las
variables ventilatorias
3.1. Selección del modo ventilatorio
Las
estrategias de VM protectora pueden implementarse con distintos modos
ventilatorios.
En la fase
inicial de la VM, la mayoría de los estudios emplean ventilación mandatoria
continua controlada por volumen (volume-controlled continuous mandatory
ventilation, VC-CMV),33-36 mientras que otros utilizan ventilación
mandatoria continua controlada por presión (pressure-controlled continuous
mandatory ventilation, PC-CMV),37-40 o ambos de forma indistinta.41
La selección
de VC-CMV como modo de inicio de la VM ofrece la ventaja de limitar el VC entregado
y controlar el volumen respiratorio por minuto. Además, permite al operador la
programación y el control de algunos parámetros ventilatorios asociados al
desarrollo de lesión pulmonar inducida por la VM (ventilator-induced lung
injury, VILI), como el VC, el flujo, la FR y, además, facilita el monitoreo
de la mecánica del sistema respiratorio.10,42,43
Así mismo, en
comparación con la PC-CMV y otros modos controlados por presión, cuando el
paciente dispara el respirador, el modo VC-CMV puede ser más eficaz para
disminuir el trabajo respiratorio en el contexto de ventilación protectora con
VC bajo.44
Si bien los
modos en los que la variable de control es la presión se desarrollaron para
proteger a los pacientes de presiones excesivas en la vía aérea, el monitoreo
de la mecánica respiratoria suele requerir mayores conocimientos para
garantizar mediciones confiables.45
Además, la
aparición de respiración espontánea en los modos controlados por presión, como
PC-CMV, ventilación controlada por volumen regulada por presión (pressure-regulated
volume control) y ventilación con liberación de presión en la vía aérea (airway
pressure release ventilation), permite que el VC entregado sea variable, lo
que puede exponer al parénquima pulmonar a tensión (stress) y
deformación (strain) excesivas por aumento de la presión transpulmonar
(PTP) y del VC.45-49
En algunos
estudios, se ha reportado que el uso de ventilación con liberación de presión
en la vía aérea, en los pacientes con SDRA podría brindar beneficios en la
oxigenación y la mecánica respiratoria, y disminuir el tiempo de VM y la
estancia en terapia intensiva. Sin embargo, su implementación requiere mayores
conocimientos y habilidades en el manejo de la VM y no hay evidencia de
beneficios en la mortalidad comparada con una estrategia ventilatoria
convencional de bajo VC en modo VC-CMV.50
En la Tabla
1, se resumen los modos ventilatorios utilizados en los estudios más relevantes
de VM en pacientes con SDRA.
Tabla 1
Modos ventilatorios utilizados en los estudios de ventilación mecánica en pacientes con síndrome de dificultad respiratoria aguda
|
Estudio |
Grupo de tratamiento |
Grupo de control |
|
Amato et al, 199837 |
PC-CMV |
VC-CMV |
|
ARDS Network, 20007 |
VC-CMV |
VC-CMV |
|
Brower et al, 200433 |
VC-CMV |
VC-CMV |
|
Mercat et al, 200834 |
VC-CMV |
VC-CMV |
|
Meade et al, 200838 |
PC-CMV |
VC-CMV |
|
Kacmarek et al, 201639 |
PC-CMV |
VC-CMV |
|
Cavalcanti et al, 201735 |
VC-CMV |
VC-CMV |
|
Constantin et al, 201936 |
VC-CMV |
VC-CMV |
|
Hodgson et al, 201940 |
PC-CMV |
VC-CMV |
|
Beitler et al, 201941 |
VC-CMV o PC-CMV |
VC-CMV o PC-CMV |
PC-CMV (pressure-controlled continuous mandatory ventilation) = ventilación mandatoria continua controlada por presión; VC-CMV (volume-controlled continuous mandatory ventilation) = ventilación mandatoria continua controlada por volumen.
3.2. Programación del VC y la FR
La reducción
del VC es el pilar sobre el que se basan las estrategias de protección
pulmonar. El primer estudio aleatorizado y controlado que mostró una reducción
de la mortalidad con el empleo de bajo VC fue publicado por Amato, en 1998.37 En 2000, la ARDS Network de los National
Institutes of Health publicó un estudio multicéntrico con 861 pacientes que
sufrían una lesión pulmonar aguda y SDRA. Se demostró que ajustando el VC a 6
ml/kg (rango 4-8 ml/kg) y limitando la PM (por debajo de 30 cmH2O) disminuía significativamente la mortalidad en comparación con un grupo
de control (ventilado a 12 ml/kg).7
El protocolo
de la ARDS Network introdujo algunas prácticas que muchos de los estudios
subsiguientes tomaron como referencia para la programación de la VM.33,34,38,51
Con el
objetivo de mantener un intercambio gaseoso adecuado, la ventilación por minuto
(VC y FR) se debe ajustar para obtener un pH de entre 7,30 y 7,45.7
El estudio de
la ARDS Network incorporó el concepto de programar el VC según el PCP (que
depende fundamentalmente del sexo y la talla) como una manera de ajustar dicha
variable al tamaño del pulmón normal.7
El VC se
programa de la siguiente manera:7,18
Se mide en
centímetros la talla del paciente de la cabeza hasta el talón del pie en un
plano horizontal. Este valor se utiliza para calcular el PCP (en kg), según las
fórmulas:7,18
[(talla en cm – 152,4) x 0,91] + 50 para los hombres, y
[(talla en cm – 152,4) x 0,91] + 45,5 para las mujeres
Obtenido el valor del PCP del paciente, se multiplica por la cantidad de
ml/kg que se haya decidido para programar el VC (6 ml/kg, inicialmente).7,18
Ejemplo: si
el paciente es un hombre que mide 170 cm, su PCP será de 66 kg. Para iniciar
una estrategia de VM protectora se multiplica el PCP (66 kg) por 6 ml/kg. El VC
resultante por programar es de 396 ml.
Se recomienda
utilizar como referencia el VC inspirado, porque el VC espirado puede tener
algunas variaciones ciclo a ciclo, sobre todo, en el caso de la ventilación
asistida.
Si bien se ha
generalizado que 6 ml/kg es el estándar de VC para la protección pulmonar, la
mayoría de los estudios permiten un rango de VC de entre 4 y 8 ml/kg dentro de
los grupos de protección pulmonar, según el intercambio gaseoso y la mecánica
respiratoria.33,34,37,38,51
Una vez
programado el VC, se debe programar la FR. Desde la publicación de la ARDS
Network,7 los protocolos admiten un rango de FR
de 6 a 35 rpm.33,34,38,51
Asumiendo que
el paciente tiene un pH y una PaCO2 estables antes de bajar el VC, la FR
inicial debe ser la necesaria para mantener el volumen respiratorio por minuto
programado previamente.7,33,34,38,51
Ejemplo: si
el paciente tenía un VC de 500 ml y una FR de 20 rpm, y el VC debe bajarse a
400 ml, la FR debe aumentarse a 25 rpm para mantener la misma ventilación por
minuto (10 l/min, en este caso).
Hay que
considerar que, al reducir el VC, aumenta la ventilación de espacio muerto, por
lo que es esperable que la PaCO2 se incremente ligeramente para el
mismo volumen respiratorio por minuto.
Al aumentar
la FR, hay que ajustar la duración del tiempo inspiratorio (Ti) para evitar el
atrapamiento aéreo que puede producirse a FR elevadas. El Ti total (tiempo de
flujo inspiratorio más tiempo de pausa inspiratoria) debería ajustarse entre
0,6 y 1,2 segundos, con flujo inspiratorio de 50-70 l/min, y una relación entre
los tiempos inspiratorio y espiratorio de entre 1:1 a 1:3. Es necesario tener
en cuenta que, en el modo VC-CMV, el VC, la magnitud del flujo inspiratorio, la
morfología de la curva de flujo y la programación de una pausa inspiratoria
pueden modificar el Ti resultante, según el respirador mecánico disponible o su
configuración.
Si se
requieren FR elevadas, es probable que el tiempo espiratorio resultante no
permita exhalar el volumen entregado debido al recorte necesario del tiempo
espiratorio, generando atrapamiento aéreo.
La aplicación
de pausa inspiratoria es un recurso que ha demostrado tener beneficios sobre la
remoción de CO2. Se ha comprobado que programar una
pausa del 20% del Ti baja significativamente los niveles de CO2 en pacientes ventilados con estrategia de bajo VC,52-54 al disminuir la fracción de espacio
muerto por aumento del tiempo para la distribución y difusión de los gases. En
los estudios citados, no se han comunicado niveles significativos de PEEP
intrínseca (PEEPi) con la aplicación de pausa, aunque se sugiere que sea
debidamente monitoreada por los efectos nocivos que este fenómeno puede
provocar.52-54
En la Tabla
2, se detallan los valores de VC, FR, pH y PaCO2 el día 1 de los grupos de intervención en los estudios de VM protectora
en pacientes con SDRA.
Tabla 2
Valores de volumen corriente, frecuencia respiratoria, pH y presión arterial de dióxido de carbono el día 1 en los grupos de intervención
|
Estudio |
FR (rpm) |
VC (ml) |
pH |
PaCO2 (mmHg) |
|
ARDS Network, 20007 |
29 ± 7 |
6,2 ± 0,9 |
7,38 ± 0,08 |
40 ± 10 |
|
Brower et al, 200433 |
29 ± 7 |
6,1 ± 0,8 |
7,40 ± 0,1 |
41 ± 11 |
|
Mercat et al, 200834 |
28,2 ± 5,4 |
6,1 ± 0,3 |
7,34 ± 0,10 |
44 ± 8 |
|
Meade et al, 200838 |
25,2 ± 6,6 |
6,8 ± 1,4 |
7,33 ± 0,1 |
45,5 ± 12 |
|
Kacmarek et al, 01639 |
28,9 ± 5,6 |
5,6 ± 1,1 |
7,30 ± 0,1 |
57,2 ± 16,6 |
|
Cavalcanti et al, 01735 |
30,4 (29,9-30,9)* |
5,6 (5,5-5,7)* |
7,29 (7,28-7,30)* |
52,3 (50,9-53,7)* |
|
Constantin et al, 201936 |
22 ± 5a 27 ± 5b |
7,3 ± 1,1a 6,3 ± 1,0b |
7,39 ± 0,09a 7,35 ± 0,10b |
38 ± 10a 44 ± 10b |
|
Hodgson et al, 201940 |
25 ± 5,7 |
5,8 ± 1,4 |
7,28 ± 0,09 |
57,3 ± 15,2 |
Los valores se expresan como media y desviación estándar, salvo aclaración.
*media e intervalo de confianza. aSíndrome de dificultad respiratoria aguda focal. bSíndrome de dificultad respiratoria aguda difuso.
FR = frecuencia respiratoria; rpm = respiraciones por minuto; VC = volumen corriente; PaCO2 = presión arterial de dióxido de carbono.
Una vez
programado el VC y la FR, se debe evaluar el efecto de la programación del VC
sobre la mecánica respiratoria (fundamentalmente PM y PD) y sobre el
intercambio gaseoso (mediante un estado ácido-base).18 Sobre la base de los resultados del monitoreo,
se evaluará la necesidad de realizar ajustes posteriores (véase más
adelante).
Está
demostrado que, en los pulmones con SDRA, la superficie de pulmón disponible
para el intercambio gaseoso se reduce y esto se ve reflejado en la caída de la
distensibilidad. Este fenómeno, conocido como pulmón de bebé o baby lung,
implica que la relación entre el PCP y el tamaño pulmonar correspondiente se
pierda.55 En esta situación, entonces, podría ocurrir
que un VC de 6 ml/kg del PCP resulte excesivo, sometiendo al tejido pulmonar a
mecanismos de lesión, incluso durante una ventilación considerada protectora.56 Por ello, algunos autores postulan que una
estrategia de ventilación protectora podría plantearse desde un objetivo
primario de PD, en lugar del ajuste estricto del VC, dado que limitar el valor
de la PD sería una forma de ajustar el VC al tamaño funcional del pulmón.57-59 Sin embargo, otros investigadores
han demostrado que la correlación entre volumen pulmonar y la distensibilidad
del sistema respiratorio es de moderada a baja, lo cual desafía la aplicación
de este concepto.60
A diferencia
de estudios previos, que adoptaban FR cercanas a lo normal e hipercapnia
permisiva como parte de su estrategia,61-64 el estudio de la ARDS Network y otros
posteriores utilizaron FR más elevadas para tratar de compensar la reducción
del VC y evitar el desarrollo de hipercapnia y acidosis severa.7,33,34,38,51 Por
lo general, el uso de un bajo VC no debería tener consecuencias significativas
sobre el pH y la PaCO2 si la FR se programa de manera
adecuada. Es un error frecuente considerar que la hipercapnia es una
consecuencia necesaria de usar un bajo VC. Dichos valores, en muchos estudios,
son normales.7,33,34
El pH o la
PaCO2 pueden alterarse si la ventilación por
minuto inicial es muy alta (de manera que no podamos aumentar lo suficiente la
FR sin generar atrapamiento aéreo), si hay que bajar el VC a menos de 6 ml/kg o
si el paciente tiene acidosis metabólica. Además, el impacto sobre el pH puede
ser menor si la reducción del VC es progresiva. En el estudio original de la
ARDS Network, la reducción del VC se hacía a lo largo de 4 horas, en pasos de 1
ml/kg.
De todos
modos, en algunos estudios, se han tolerado niveles de pH de hasta 7,15,40 con valores de PaCO2 hasta de 80 mmHg en los pacientes y no se han reportado consecuencias
clínicas importantes.37
La
hipercapnia, entonces, puede resultar de una programación inadecuada de la VM,
pero no hay que olvidar que puede producirse por la fisiopatología y la
gravedad de la enfermedad.65
3.3. Programación de la fracción inspirada de
oxígeno y la PEEP
Desde la
descripción del SDRA, las variables más importantes dentro la programación de
la VM para tratar de mantener una oxigenación adecuada han sido la fracción
inspirada de oxígeno (FiO2) y la PEEP.1
Un nivel de
PEEP adecuado, además de mejorar el intercambio gaseoso, podría tener el valor
agregado de optimizar la mecánica respiratoria y disminuir el desarrollo de
VILI.66
Varios
estudios han evaluado el efecto del nivel de la PEEP sobre la evolución de los
pacientes con SDRA. Si bien algunos de ellos han demostrado que la PEEP elevada
puede mejorar la oxigenación y disminuir el uso de tratamientos para la
hipoxemia refractaria y la duración de la VM,34,38 su efecto sobre la mortalidad es
controvertido.67
Ninguna
publicación, de manera individual, ha comunicado beneficios sobre la mortalidad
con el uso de una PEEP alta comparada con niveles moderados o bajos. Un estudio
más reciente ha reportado peores resultados con una PEEP alta.35 Sin embargo, algunos metanálisis sugieren
beneficios sobre la mortalidad de una PEEP alta en los pacientes más graves.68,69
Para la
programación de la VM, los objetivos de oxigenación considerados aceptables en
la mayoría de los estudios son bastante similares:
Presión arterial de oxígeno (PaO2) = 55-80 mmHg,7,34,38,39 55-120 mmHg51
SatO2 = 88-95%,7,34,38,39 88-98%51
Las programaciones de la PEEP y la FiO2 sugeridas en los estudios son diversas y responden a distintas
estrategias. A continuación, describiremos las utilizadas en los estudios más
relevantes.
3.3.1. Ajuste de la PEEP por tablas de PEEP/FiO2
Estas
estrategias utilizan una tabla prediseñada para ajustar los valores de la PEEP
y la FiO2 a un determinado objetivo de PaO2 y SatO2.
Las tablas
fueron diseñadas basadas en la práctica habitual de aumentar la FiO2 y la PEEP de forma escalonada, ante la presencia de hipoxemia. De este
modo, a cada nivel de FiO2 le corresponde un determinado valor de
PEEP, y ambas variables se van aumentando o disminuyendo hasta alcanzar el
objetivo deseado, de manera secuencial.
Se han
descrito tablas de PEEP/FiO2 con valores de PEEP bajos7 o elevados (Tablas 3 y 4).33,38
Tabla 3
Combinaciones
de la tabla de PEEP/FiO2 baja
|
FiO2 |
0,3 |
0,4 |
0,4 |
0,5 |
0,5 |
0,6 |
0,7 |
0,7 |
0,7 |
0,8 |
0,9 |
0,9 |
0,9 |
1 |
|
PEEP |
5 |
5 |
8 |
8 |
10 |
10 |
10 |
12 |
14 |
14 |
14 |
16 |
18 |
18-24 |
FiO2 = fracción inspirada de oxígeno; PEEP (positive end-expiratory pressure) = presión positiva de fin de espiración.
Tabla 4
Combinaciones
de la tabla de PEEP/FiO2 alta
|
FiO2 |
0,3 |
0,3 |
0,4 |
0,4 |
0,5 |
0,5 |
0,5-0,8 |
0,8 |
0,9 |
1 |
|
PEEP |
12 |
14 |
14 |
16 |
16 |
18 |
20 |
22 |
22 |
22-24 |
FiO2 = fracción inspirada de oxígeno; PEEP (positive end-expiratory pressure) = presión positiva de fin de espiración.
En el inicio
del protocolo, los valores de PEEP, FiO2 o de ambas deben ser ajustados para el objetivo de oxigenación elegido
(PaO2 = 55-80 mmHg, SatO2 = 88-95%). Primero, se debe programar la FiO2 necesaria para obtener los valores de oxigenación deseados. Luego, se
debe colocar el menor valor de PEEP que acompaña a esa FiO2 en la tabla. Transcurridos de 5 a 15 minutos, si el valor de oxigenación
está en el rango objetivo se mantienen los valores. Si está por debajo del
objetivo, se debe aumentar progresivamente la PEEP o la FiO2 (desplazándose hacia la derecha en la tabla). Por el contrario, si la
oxigenación está por encima del objetivo, se debe reducir la PEEP o la FiO2 (desplazándose hacia la izquierda en la tabla).18
Si la PEEP se
aumenta en algún paso, se debe reevaluar el efecto sobre la mecánica
respiratoria (en especial el valor de la PM). Si este supera los límites
preestablecidos, se debería considerar disminuir el VC utilizado.
Las
investigaciones publicadas no dan a conocer cuánto tiempo deben mantenerse los
valores de PEEP y FiO2 para esta estrategia, pero estimulan a
bajarlos si la oxigenación es >80 mmHg o la SatO2 es >95%. Como sugerencia, habría que mantenerlos hasta obtener una
relación PaO2/FiO2 estable por, al menos, 24 horas, para luego comenzar su descenso
reevaluando la oxigenación y la posibilidad de seguir progresando
(desplazándose hacia la izquierda de la tabla) o la necesidad de colocar
nuevamente la FiO2 y la PEEP de manera creciente.
Estas tablas
fueron elaboradas por consenso de expertos en el diseño de estudios
multicéntricos para tratar de homogeneizar los tratamientos. Si bien han sido
criticadas por carecer de un sustento fisiológico claro, reflejan la práctica
clínica habitual de muchos centros. Por otro lado, el ajuste de la PEEP por
tablas de PEEP/FiO2 tiene correlación con el reclutamiento
del pulmón.70
3.3.2. Ajuste de la PEEP por maniobra de
reclutamiento alveolar + tabla de PEEP/FiO2
Una maniobra
de reclutamiento alveolar (MRA) es un aumento sostenido de la presión con el
objetivo de abrir la pequeña vía aérea y los alvéolos colapsados para luego
aplicar un nivel de PEEP que permita sostenerlos abiertos.
Las MRA
utilizan niveles altos de presión en la vía aérea para superar las presiones de
apertura y alcanzar los valores de una capacidad residual funcional normal.
Luego, se pueden reducir al mínimo los valores de PEEP necesarios para
estabilizar el volumen pulmonar de fin de espiración.71
En el Lung
Open Ventilation Study (LOVS), publicado en 2008, utiliza una estrategia de
ajuste de la PEEP con la tabla de PEEP/FiO2, pero antes de esta, se realiza una MRA.38
Se han
descrito numerosas MRA. Las más utilizadas son la aplicación de presión
positiva continua en la vía aérea (continuous positive airway pressure,
CPAP)38 o los niveles crecientes de PEEP, de manera
escalonada, en modo PC-CMV.35
Antes de
efectuar una MRA y, para evitar el desarrollo de complicaciones, se debe
asegurar que el paciente no presente esfuerzos respiratorios (con adecuada
analgesia, sedación y eventualmente bloqueantes neuromusculares), que esté
hemodinámicamente estable, con adecuado volumen intravascular, y que tenga un
adecuado monitoreo (mínimamente SatO2, presión arterial,
electrocardiograma).
• MRA en CPAP: se coloca al paciente en
modo CPAP, con PEEP de 35-40 cmH2O y con FiO2 a 1. Se mantiene la programación por 40 segundos.37,38
• MRA en PC-CMV: se coloca al paciente en
PC-CMV (presión inspiratoria 15 cmH2O, FR 10-15 ciclos/min, relación
tiempos inspiratorio y espiratorio 1:1, Ti 2-3 segundos, FiO2 1, PEEP 20 cmH2O). Se aumenta el nivel de PEEP en
escalones de 5 cmH2O, a 25, 30 y 35 cmH2O (presión máxima 50 cmH2O), manteniendo, al menos, 1 minuto
cada nivel.35
Finalizada la
MRA, se reinicia la ventilación con una PEEP de 20-25 cmH2O en el modo correspondiente (VC-CMV o PC-CMV), manteniendo un VC de 6
ml/kg de PCP. A continuación, se comenzará a bajar la PEEP y la FiO2 según la tabla, hasta alcanzar el objetivo de oxigenación. La tabla
propuesta por este estudio es ligeramente diferente de la de la ARDS Network,
pero mantiene el mismo concepto de modificación secuencial de FiO2 y PEEP.38
Se debe
suspender la MRA o disminuir los valores de PEEP en caso de hipotensión
arterial (presión arterial media <60 mmHg), sospecha de barotrauma o PM
>40 cmH2O.38
El uso de MRA
es controvertido. Si bien mejoran la oxigenación, sus efectos son de corta
duración y están asociadas a complicaciones (hipotensión, barotrauma).72 Un metanálisis reciente sugiere que las MRA
prolongadas asociadas a una PEEP alta podrían aumentar la mortalidad.9 Aunque no se recomienda su uso de rutina, se
las ha empleado en algunos estudios durante el ajuste de la PEEP, como se ha
descrito.37,38
3.3.3. Ajuste de la PEEP por máximo reclutamiento o
por estudio Express
En el estudio
Express, la estrategia para ajustar la PEEP en el grupo experimental se basa en
el concepto de incrementar el reclutamiento alveolar mientras se evita la
hiperinflación excesiva, limitando la PM y utilizando VC bajos.34
Para lograr
este objetivo, los autores proponen utilizar el modo VC-CMV, con un VC de 6
ml/kg de PCP. Con estos parámetros, se programa el máximo nivel de PEEP que
permita alcanzar valores de PM de entre 28 y 30 cmH2O, medida con una pausa inspiratoria de 0,2-0,5 segundos. La PEEP es
ajustada de manera independiente sobre la base de la PM, sin tener en cuenta su
efecto en la oxigenación.34
Se selecciona
la FiO2 necesaria para alcanzar objetivos de
PaO2 o SatO2 similares a los de la ARDS Network.7,34
En los
pacientes con restricción pulmonar severa, si fuera necesario, la PEEP se puede
reducir a un mínimo de 5 cmH2O para mantener la PM <30 cmH2O. Si, a pesar de esto, continúa >32 cmH2O, se debe reducir el VC de a 1 ml/kg.
Los autores
sugieren mantener esta programación hasta el día 4, momento en el que, si están
dadas las condiciones clínicas y de oxigenación, puede iniciarse la etapa de
desconexión.34
En este
estudio, no se encontraron diferencias estadísticamente significativas con la
tasa de mortalidad del grupo de control, pero, en un análisis posterior, se
observó una tendencia a la reducción de la mortalidad en los pacientes más
graves, mientras que, en los más leves, ocurrió lo contrario. Por ello, esta
estrategia podría ser beneficiosa en casos de SDRA moderado o grave.34
En la Figura
3, se muestra un ejemplo de ajuste de la PEEP según lo propuesto en el estudio
Express.34
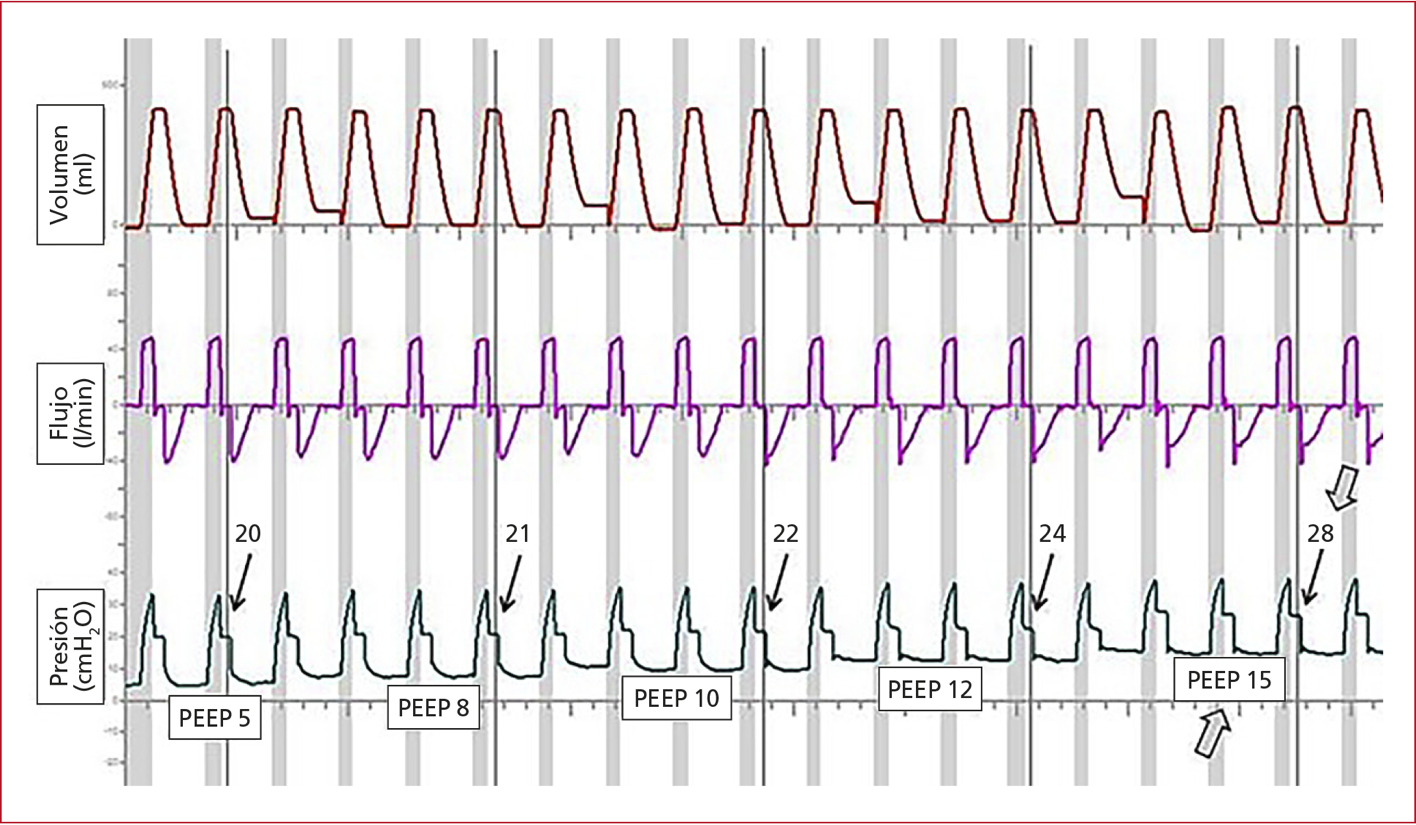
Figura 3. Ajuste de la presión positiva al final de la espiración según lo propuesto en el estudio Express.34 En modo de ventilación mandatoria continua controlada por volumen, con un volumen corriente de 6 ml/kg de peso corporal predicho, se programa el máximo nivel de PEEP que permita alcanzar valores de presión meseta entre 28 y 30 cmH2O, medida con una pausa inspiratoria de 0,2-0,5 segundos. Las flechas grises indican el nivel óptimo de PEEP seleccionado a través de este método.
3.3.4. Ajuste de la PEEP según la
distensibilidad del sistema respiratorio
En este
método, que ha sido utilizado en varios ensayos clínicos,35,39 el ajuste de la PEEP tiene como
objetivo optimizar la mecánica respiratoria. Se programa el nivel de PEEP que
mantiene la mayor distensibilidad del sistema respiratorio (DSR).
Clásicamente,
se ha descrito a la curva presión-volumen del sistema respiratorio de los
pacientes con SDRA con una forma sinusoidal. La curva muestra un punto de
inflexión inferior por debajo del cual hay predominio de colapso y un punto de
inflexión superior a partir del cual hay predominio de sobredistensión. Entre
ambos, hay una región que sufre un menor cambio de presión ante una mayor
diferencia de volumen (mayor DSR), donde se equilibrarían los fenómenos de
reclutamiento y sobredistensión alveolar. En este rango, podría ser menor el
riesgo de VILI (Figura 4).
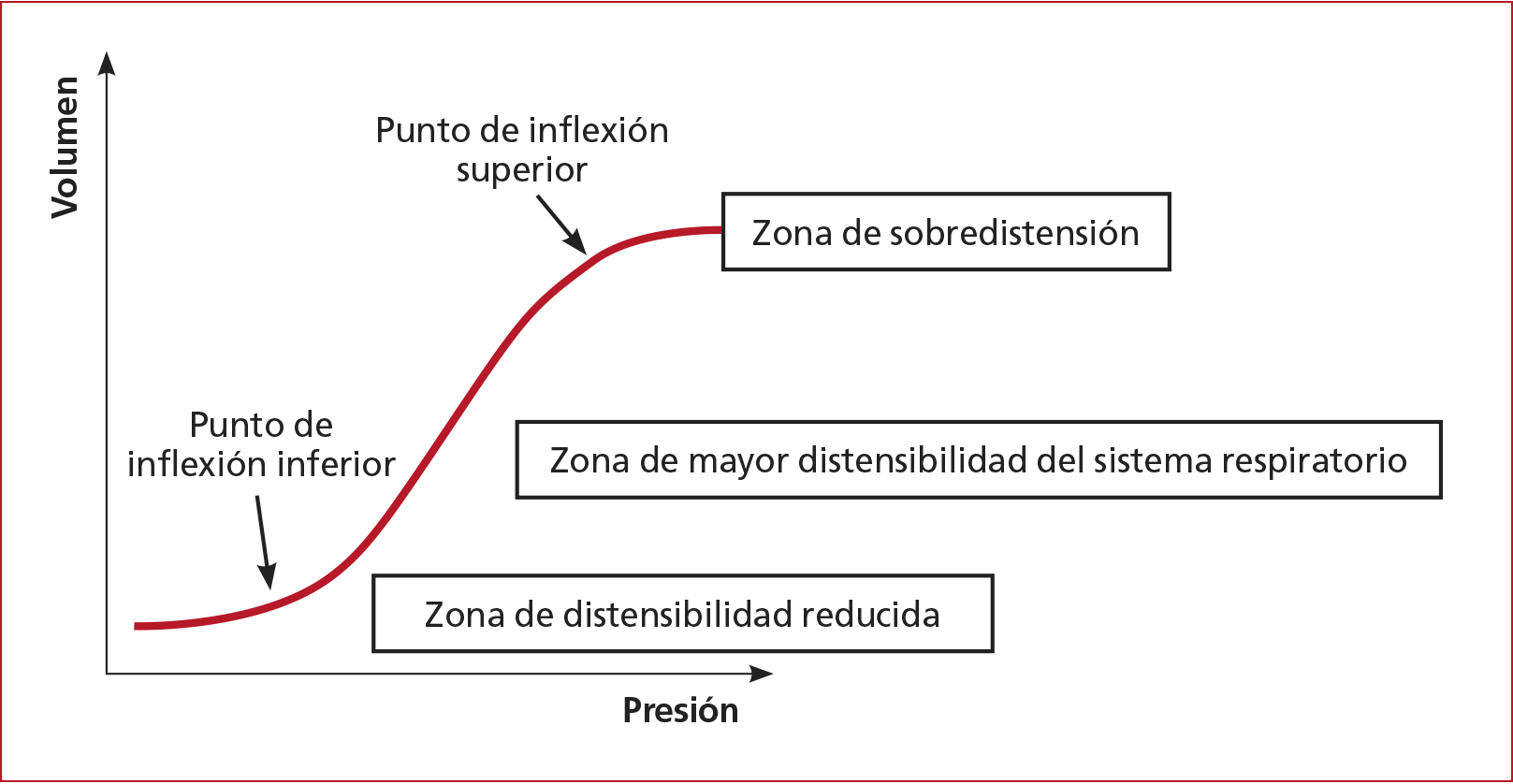
Figura 4. Curva presión/volumen del sistema respiratorio. Se señalan el punto de inflexión inferior, asociado con el comienzo del reclutamiento alveolar, y el punto de inflexión superior, asociado con el comienzo de la sobredistensión.
Para la
programación, se sugiere utilizar inicialmente una MRA,35,39 ya sea en CPAP (como se describió
para el LOVS38) o en
modo PC-CMV (como en el estudio ART35). A partir de allí, disminuir la PEEP en pasos progresivos hasta el nivel
en el que se alcanza la mayor distensibilidad.
Específicamente,
luego de la MRA, se reinicia la ventilación en modo VC-CMV (VC 6 ml/kg según
PCP, Ti 0,6-1 segundo, FiO2 1, FR hasta 35 rpm) con PEEP 20-25 cmH2O. Si la PM fuera >40 cmH2O, se debería reducir el VC a 5 o 4
ml/kg.
En ese nivel
de PEEP, se calcula la DSR, de forma dinámica (VC/Presión pico – PEEP),39 o estática (VC/PM - PEEP)35 luego de, al menos, 3 minutos de
estabilización.
Posteriormente,
la PEEP se reduce en pasos de 2-3 cmH2O cada 3-5 minutos, valorando la DSR en
cada nivel hasta identificar el mayor valor. En algunos estudios, no se evalúa
por debajo de 11 cmH2O.35 En la Figura 5, se expone un ejemplo de
ajuste.
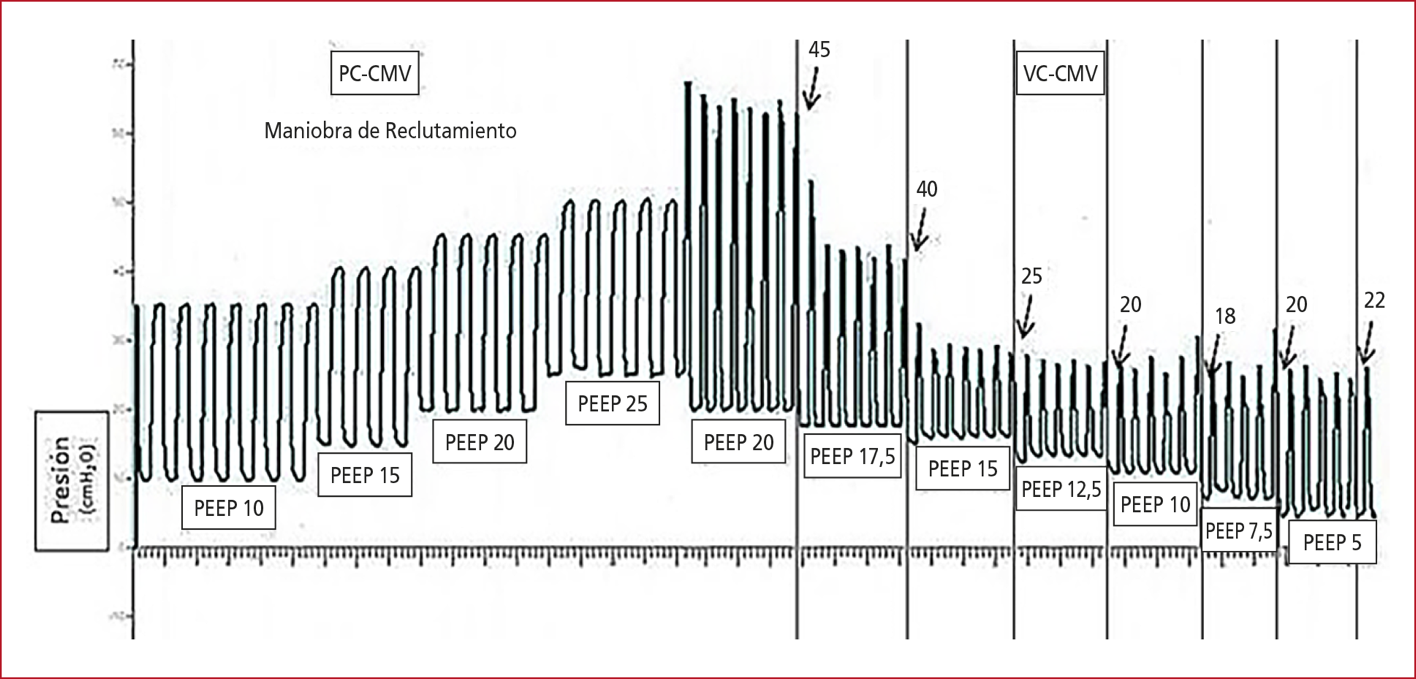
Figura 5. Ajuste de la PEEP según la distensibilidad del sistema respiratorio, luego de una maniobra de reclutamiento alveolar (MRA) escalonada en ventilación mandatoria continua controlada por presión (PC-CMV), con disminución progresiva de la PEEP, en ventilación mandatoria continua controlada por volumen (VC-CMV). Se señalan los valores de presión meseta obtenidos con pausa de 0,2 a 0,5 segundos.
Si se
obtienen valores constantes de DSR para una serie de pasos de PEEP, se usa la
PEEP más alta asociada con esa DSR.
Una vez que
se identifica la mejor PEEP, se debe realizar una nueva MRA y, luego, se
programa la PEEP 2-3 cmH2O por sobre ese valor.
Después del
ajuste inicial, en general, no se modifica el valor de la PEEP durante las
primeras 24 horas, y se comienza a descender únicamente si la FiO2 es <0,4, de manera progresiva (2 cmH2O cada 8 horas), monitoreando la mecánica respiratoria y la oxigenación.
Si estas se deterioran, se vuelve a los parámetros previos.
Si bien tiene
una concepción mecánica atractiva, los estudios en los que se utilizó este
método de ajuste han arrojado resultados contradictorios sobre la mortalidad.35,39
Desde el
punto de vista fisiológico, es posible que los mayores valores de DSR se
alcancen cuando hay reclutamiento y desreclutamiento cíclico, lo que
potencialmente puede ser dañino para el pulmón.73
3.3.5. Ajuste de la PEEP guiado por la presión
esofágica
Esta
estrategia de ajuste de la PEEP se basa en utilizar la medida de la presión
esofágica (Pes) como un valor subrogado de la presión pleural, y calcular la
PTP para equilibrar los fenómenos de reclutamiento y sobredistensión, y así
reducir el daño pulmonar.
El objetivo
es seleccionar una PEEP lo suficientemente alta para minimizar el atelectrauma
(apertura y cierre cíclico de la vía aérea y el pulmón) y, al mismo tiempo,
limitar la sobredistensión alveolar.
Para ello, se
programa un nivel de PEEP que permita alcanzar una PTP espiratoria (PTPe) de 0
cmH2O o ligeramente positiva; y al mismo
tiempo, mantener una PTP inspiratoria (PTPi) <20 cmH2O.41
Los pacientes
deben tener un balón esofágico correctamente colocado y calibrado.74,75 Talmor et al sugieren iniciar el
ajuste con una MRA para estandarizar el inicio de la medición, para lo cual y,
como ya se mencionó,
los pacientes deben estar sedados y, si es necesario, paralizados. Se debe
programar el modo CPAP con 35-40 cmH2O de PEEP y mantenerlo por 30 segundos.
A continuación, se coloca en modo VC-CMV, con un VC de 6 ml/kg según el PCP.51
Para calcular
la PTPe se deben medir la presión en la vía aérea y la Pes durante una pausa
tele-espiratoria:51
PTPe = PEEP total – Pes espiratoria
Para calcular la PTPi se deben medir la presión en la vía aérea y la Pes
durante una pausa tele-inspiratoria:51
PTPi = PM – Pes inspiratoria
El nivel de PEEP se establecerá para alcanzar una PTPe de 0 a 6 cmH2O y una PTPi <20 cmH2O (Figura 6). Si, al programar la PEEP,
la PTPi es >20 cmH2O, se debe reducir el VC a 5 o 4 ml/kg.51
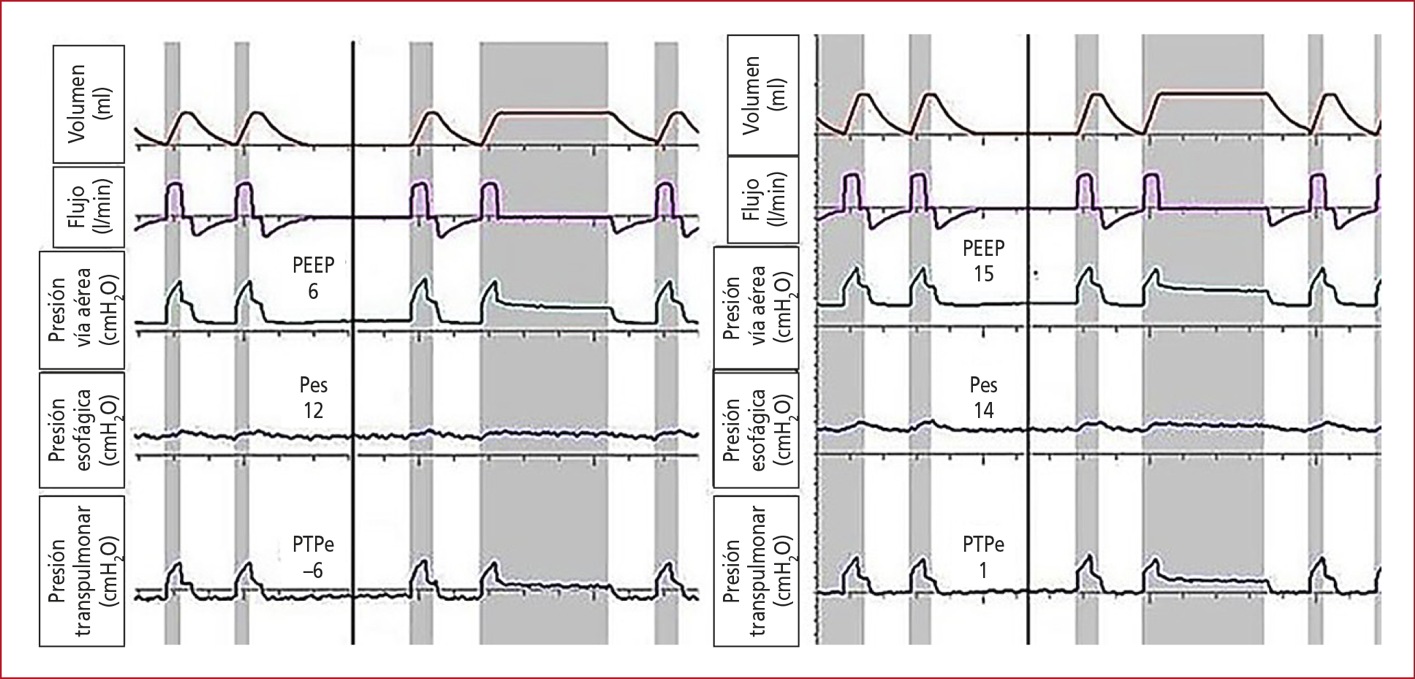
Figura 6. Ajuste de la PEEP utilizando manometría esofágica, según lo descrito por Talmor et al.51 A la izquierda, durante una pausa tele-espiratoria a una PEEP de 6 cmH2O, se observa una presión transpulmonar espiratoria (PTPe) negativa (-6 cmH2O). A la derecha, al aumentar la PEEP a 15 cmH2O, la PTPe se hace positiva (1 cmH2O).
Pes = presión esofágica; SDRA = síndrome de dificultad respiratoria aguda.
En los
estudios, se utiliza una tabla de PTPe/FiO2 empírica que permite una PTPe mayor en caso de que se requieran valores
de FiO2 elevados para cumplir las metas de
oxigenación (PaO2 = 55-120 mmHg, SatO2 = 88-98%) (Tabla 5).
Tabla 5
Combinaciones de FiO2 y presión transpulmonar espiratoria del estudio EPVENT 2
|
FiO2 |
0,3 |
0,4 |
0,5 |
0,5 |
0,6 |
0,6 |
0,7 |
0,7 |
0,8 |
0,8 |
0,9 |
0,9 |
1,0 |
|
PTPe |
0 |
0 |
0 |
2 |
2 |
3 |
3 |
4 |
4 |
5 |
5 |
6 |
6 |
FiO2 = fracción inspirada de oxígeno; PTPe = presión transpulmonar espiratoria.
Aunque el
empleo de la PEEP ajustada por la Pes ofrece beneficios fisiológicos (aumento
de la oxigenación, mejora de la distensibilidad),76 hay controversia sobre cómo utilizar
las mediciones de la Pes,77 y no se ha demostrado que sea superior a otras
estrategias de ajuste de la PEEP alta.69 Además, el concepto de la necesidad
de una PTPe >0 ha sido debatido recientemente.78
3.3.6. Ajuste de la PEEP por maniobra de
reclutamiento escalonada + PEEP disminuida por oxigenación
El estudio
PHARLAP (Permissive Hypercapnia, Alveolar Recruitment, and Low Airway Pressure
study) define su estrategia de ajuste de la PEEP basándose en el concepto de
que, después de una MRA, las regiones pulmonares colapsadas por el SDRA
deberían abrirse. Luego de esta, utilizar niveles de PEEP elevados permitiría
mantener estas regiones reclutadas, disminuyendo la lesión asociada y mejorando
el área efectiva de ventilación.40
Se realiza,
entonces, un abordaje combinado de “maniobra de reclutamiento escalonada”,
seguida por ajuste de la PEEP y, a continuación, una “maniobra de reclutamiento
breve”. En el estudio, este procedimiento se repite los primeros 5 días, salvo
que la DSR estática no mejore a partir del tercer día.40
Descripción del procedimiento:40
• El paciente debe estar ventilado en
modo PC-CMV (presión inspiratoria de 15 ±
3 cmH2O, VC 4-6 ml/kg según PCP), FiO2 ajustada para mantener una SatO2 del 90-92% durante, al menos, 15
minutos.
• MRA escalonada: se programa la PEEP en
20 cmH2O y se mantiene durante 2 minutos.
Luego se aumentará a 30 cmH2O (por 2 minutos) y luego a 40 cmH2O (durante 2 minutos). Se debe detener la maniobra si sobrevienen
inestabilidad hemodinámica, arritmias, desaturación o signos de barotrauma.
• Maniobra de ajuste de la PEEP: después
de completar la MRA, la PEEP se reduce a 25 cmH2O durante 3 minutos. A partir de allí, se reduce 2,5 cmH2O cada 3 minutos hasta que la SatO2 disminuya, por primera vez, un 2% o más (llamado nivel de
desreclutamiento).
A
continuación, se realizará una nueva MRA breve (2 minutos) con el nivel de PEEP
máximo tolerado previamente, para luego programar la PEEP 2,5 cmH2O por encima del nivel de desreclutamiento.
Si, durante
el procedimiento, no se pudiera determinar la PEEP de desreclutamiento, la PEEP
programada será de 15 cmH2O y no se realizará la MRA breve.
Como se
señaló antes, el uso de las MRA es controvertido. La oxigenación no mejora en
todos los pacientes. Sus efectos son de corta duración y están asociadas a
complicaciones (hipotensión, barotrauma),72 e incluso podrían aumentar la mortalidad.9
3.3.7. Ajuste de la PEEP por morfología pulmonar
El SDRA es un
síndrome heterogéneo que tiene subgrupos con características clínicas y
evolutivas distintivas. La respuesta a la PEEP difiere entre los pacientes con
un alto potencial de reclutamiento y aquellos que tienen bajo reclutamiento.79
Los pacientes
con SDRA e infiltrados difusos o parcheados evaluados por tomografía
computarizada tienen más deterioro de la DSR y mayor potencial de reclutamiento
(podrían beneficiarse del uso de PEEP alta), mientras que los pacientes con
infiltrados focales tienen una mayor DSR y menor potencial de reclutamiento (y
podrían beneficiarse de valores bajos de PEEP).79
En un estudio
aleatorizado y controlado que comparó dos estrategias de selección de PEEP en
pacientes con SDRA, los pacientes del grupo de tratamiento recibieron una
programación individualizada de la PEEP, de acuerdo con la morfología pulmonar
evaluada por tomografía computarizada o radiografía de tórax. A los pacientes
con SDRA focal se les programaron niveles de PEEP bajos (5-10 cmH2O) con VC de hasta 8 ml/kg según el PCP, mientras que a aquellos con SDRA
difuso o parcheado se les programaron niveles de PEEP mayores, hasta alcanzar
una PM de 30 cmH2O con un VC de 6 ml/kg según el PCP (de
manera similar al estudio Express).34 La FiO2 utilizada era la necesaria para obtener una oxigenación adecuada (PaO2 >55 mmHg o SatO2 >88%).36 En la Figura 7, se muestra un ejemplo de
ajuste basado en la morfología pulmonar.
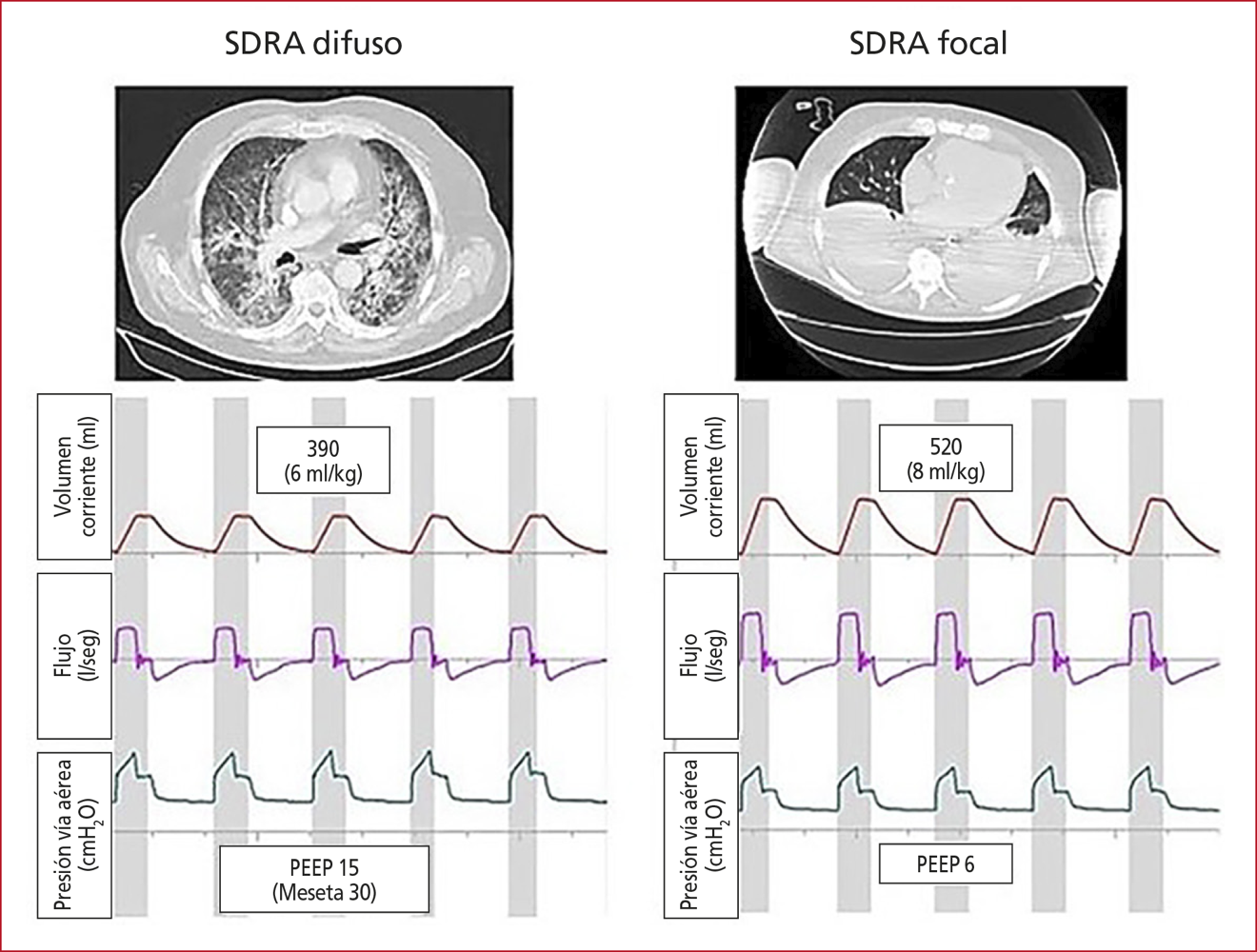
Figura 7. Síndrome de dificultad respiratoria aguda (SDRA) difusa, focal y niveles de PEEP. Se muestran dos ejemplos de pacientes con SDRA ventilados según la morfología pulmonar. A la izquierda, un corte tomográfico de tórax de un paciente con SDRA difuso. Debajo, los gráficos de la ventilación mecánica del paciente, con un volumen corriente de 6 ml/kg y una PEEP elevada (para alcanzar una presión meseta de 30 cmH2O). A la derecha, un corte tomográfico de tórax de un paciente con SDRA focal. Debajo, los gráficos de la ventilación mecánica del paciente, con un volumen corriente de 8 ml/kg y una PEEP moderada-baja (6 cmH2O en este caso).
Esta forma de
programar la PEEP tiene un sólido sustento fisiológico, pero no se ha
demostrado que mejore los resultados contra una estrategia basada en la tabla
de PEEP/FiO2.79,80 Además, la categorización de los
pacientes con un SDRA focal o uno difuso/parcheado puede ser difícil de aplicar
en la práctica clínica.36
Se han
publicado otros métodos de ajuste de la PEEP mediante distintas herramientas y
con fundamentos fisiológicos atractivos: índice de estrés,81 tomografía por impedancia eléctrica,82 capnografía volumétrica,83 cociente de reclutamiento/inflación.84 Sin embargo, ninguno de ellos ha sido
comparado contra otras estrategias en ensayos clínicos aleatorizados.
En la Tabla
6, se detalla un resumen de los valores de PEEP programados y la oxigenación en
los grupos de intervención al inicio de la VM protectora en los estudios
mencionados.
Tabla 6
Valores iniciales de fracción inspirada de oxígeno y presión positiva al final de la espiración en los grupos de intervención
|
Estudio |
Estrategia de ajuste de la PEEP |
PEEP basal (cmH2O) |
PaO2/FiO2 basal (mmHg) |
PEEP Día 1 (cmH2O) |
PaO2/FiO2 Día 1 (mmHg) |
|
ARDS Network, 20007 |
Tabla PEEP/FiO2 baja |
ND |
138 ± 64 |
9,4 ± 3,6 |
158 ± 73 |
|
Brower et al, 200433 |
Tabla PEEP/FiO2 alta |
ND |
151 ± 67 |
14,9 ± 3,6 |
220 ± 89 |
|
Mercat et al, 200834 |
PEEP para meseta 28-30 cmH2O |
8,2 ± 3,7 |
144 ± 58 |
14,6 ± 3,2 |
218 ± 97 |
|
Meade et al, 200838 |
Tabla PEEP/FiO2 alta |
11,5 ± 3,5 |
144,8 ± 47,9 |
15,6 ± 3,9 |
187,4 ± 68,8 |
|
Kacmarek et al, 201639 |
PEEP/Distensibilidad |
11,9 ± 3,3 |
133 ± 38 |
15,8 ± 3,8 |
198,5 ± 78,6 |
|
Cavalcanti et al, 201735 |
PEEP/Distensibilidad |
12,2 ± 3,0 |
119,5 ± 43,5 |
16,2 (15,9-16,6)* |
221,9 (213,5-230,4)* |
|
Constantin et al, 201936 |
Morfología pulmonar |
ND |
ND |
8 ± 2a 14 ± 3b |
217 ± 90a 240 ± 102b |
|
Hodgson et al, 201940 |
MRA y PEEP por oxigenación |
13,7 ± 2,9 |
127,7 ± 34,3 |
16,1 ± 3,6 |
203 ± 71 |
|
Beitler et al, 201941 |
Presión transpulmonar |
14 (10-18)† |
95 (73-129)† |
16 (13-20)† |
180 (160-240)† |
Los valores se expresan como media y desviación estándar, salvo aclaración.
*Media e intervalo de confianza.
†Mediana y rango intercuartílico.
aSíndrome de dificultad respiratoria aguda focal. bSíndrome de dificultad respiratoria aguda no focal.
PEEP (positive end-expiratory pressure) = presión positiva de fin de espiración; PaO2 = presión arterial de oxígeno; FiO2 = fracción inspirada de oxígeno; MRA = maniobra de reclutamiento alveolar; ND = no disponible.
4. Monitoreo de la VM
El monitoreo
de la VM tiene distintos objetivos: establecer un diagnóstico de la condición mecánica
del paciente, evaluar la respuesta a las intervenciones terapéuticas y detectar
complicaciones para facilitar la toma de decisiones respecto al tratamiento.
Se han
descrito numerosas variables de monitoreo de la VM relevantes en los pacientes
con SDRA. A continuación, revisaremos aquellas que han tenido un mayor impacto
en el manejo y la evolución de los pacientes.
4.1. Presión meseta
Junto con la
reducción del VC, la limitación de la PM es uno de los elementos centrales de
las estrategias de protección pulmonar. En el estudio de la ARDS Network, se
demostró que la reducción del VC junto con la limitación de la PM disminuye la
tasa de mortalidad y aumenta los días libres de VM y de fallas orgánicas no
pulmonares, al compararla con una estrategia de VC alto, sin limitación de la
presión.7
La PM se
considera una estimación fiable de la presión de distensión pulmonar y, en
consecuencia, de la cantidad de estrés a la que se está sometiendo al sistema
respiratorio, un factor determinante principal de VILI. La recomendación de
limitar la PM se estableció en la American-European Consensus Conference on
ARDS que desarrolló la definición y las bases del tratamiento ventilatorio en
estos pacientes.85
Por otro
lado, el monitoreo de la PM durante la VM es extremadamente importante para
evaluar las propiedades elásticas y calcular la DSR que, en pacientes con SDRA,
está directamente relacionada con el tamaño del pulmón disponible para la
ventilación (el baby lung). Este, a su vez, está asociado con la
gravedad de la enfermedad.86
Si no hay
flujo, la presión resistiva es nula y la presión medida en la vía aérea
proximal se acerca a la presión alveolar. En estas condiciones, la PM refleja
la presión de retroceso elástica de todo el sistema respiratorio.87
La PM se mide
al final de la inspiración, en condiciones estáticas a flujo cero.
Clásicamente, durante la VM en modo VC-CMV, con onda de flujo constante, se
realiza una oclusión al final de la inspiración de 0,5 a 2 segundos, durante la
cual la presión se equilibra en todo el sistema.88 La oclusión puede ser manual, de forma
intermitente, a través de una maniobra de oclusión de final de inspiración
ejecutada por el operador,88 o continua mediante la programación
de un tiempo de pausa inspiratorio fijo89 (Figura 8).
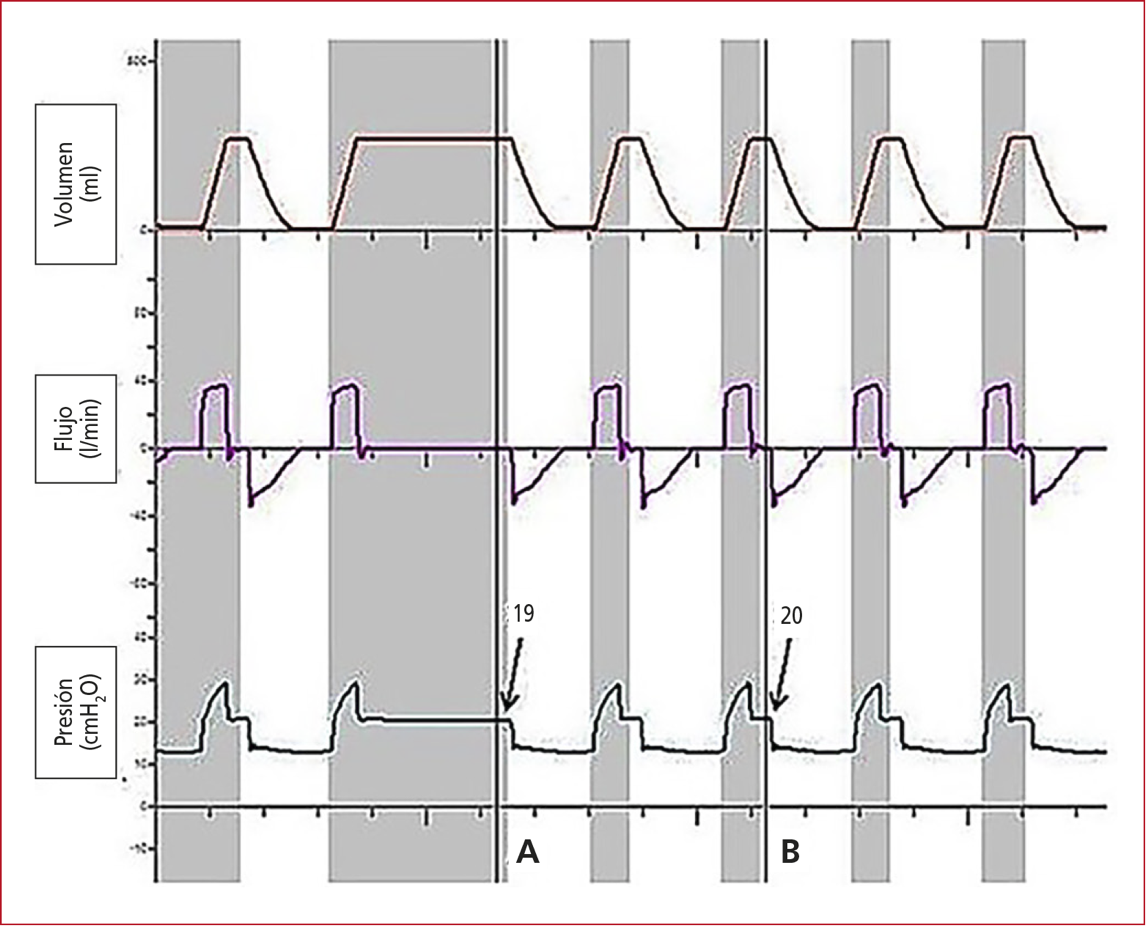
Figura 8. Medición de la presión meseta. A. Medición de la presión meseta mediante la oclusión manual tele-inspiratoria prolongada, en modo VC-CMV. B. Medición de la presión meseta mediante la programación de un tiempo fijo de pausa inspiratoria, en modo VC-CMV.
La forma
clásica de evaluar la PM, con una oclusión de, al menos, 2 segundos permite el
equilibrio de la presión en los alvéolos con diferentes constantes de tiempo, y
podría generar un valor significativamente diferente del obtenido con pausas
más cortas, sobre todo cuando hay fugas clínicas importantes (p. ej., fístula broncopleural) o microfugas (p. ej., a
través del manguito del tubo endotraqueal).89
Por esto,
para evaluar la fiabilidad de la medición de la PM, es importante observar la
presencia de las siguientes condiciones: el flujo de aire durante la pausa debe
ser igual a 0 l/min, la gráfica de la PM debe mantenerse plana y estable, y se
debe corroborar la ausencia de movimientos torácicos o abdominales al mirar
directamente al paciente durante la pausa tele-inspiratoria.90
Una PM
inestable durante la oclusión indica un esfuerzo inspiratorio o espiratorio en
curso o una fuga, y conduce a descartar la medición.90
La variación
de la presión hasta obtener una meseta es causada por fenómenos de adaptación
al estrés de los tejidos y por desigualdades en las constantes de tiempo de las
unidades alveolares.88
En la mayoría
de los protocolos de los estudios, se utiliza una pausa inspiratoria de 0,5
segundos para medir la PM,7,9,33-35,38,41,51 pero un enfoque alternativo
consiste en establecer una pausa inspiratoria aún más corta (0,2-0,3 segundos) en el modo VC-CMV.
Este método proporciona un monitoreo continuo respiración a respiración y es
menos sensible a posibles fugas.89 Algunos autores sugieren que podría
ser más representativo de la presión alveolar máxima e indicar más precisamente
el límite de sobredistensión.86,89
En el modo
PC-CMV, el monitoreo de la PM puede realizarse de dos maneras: mediante la
aplicación de una oclusión tele-inspiratoria como en el modo VC-CMV (maniobra
que no está disponible en todos los respiradores) o prolongando el Ti lo
suficiente como para que el flujo inspiratorio llegue a cero (Figura 9). De
este modo, se equilibran la presión en la vía aérea y la presión alveolar; por
lo tanto, el valor de presión máxima representa el valor de la PM. Podemos
tener así una estimación del valor de la PM en ese instante.88
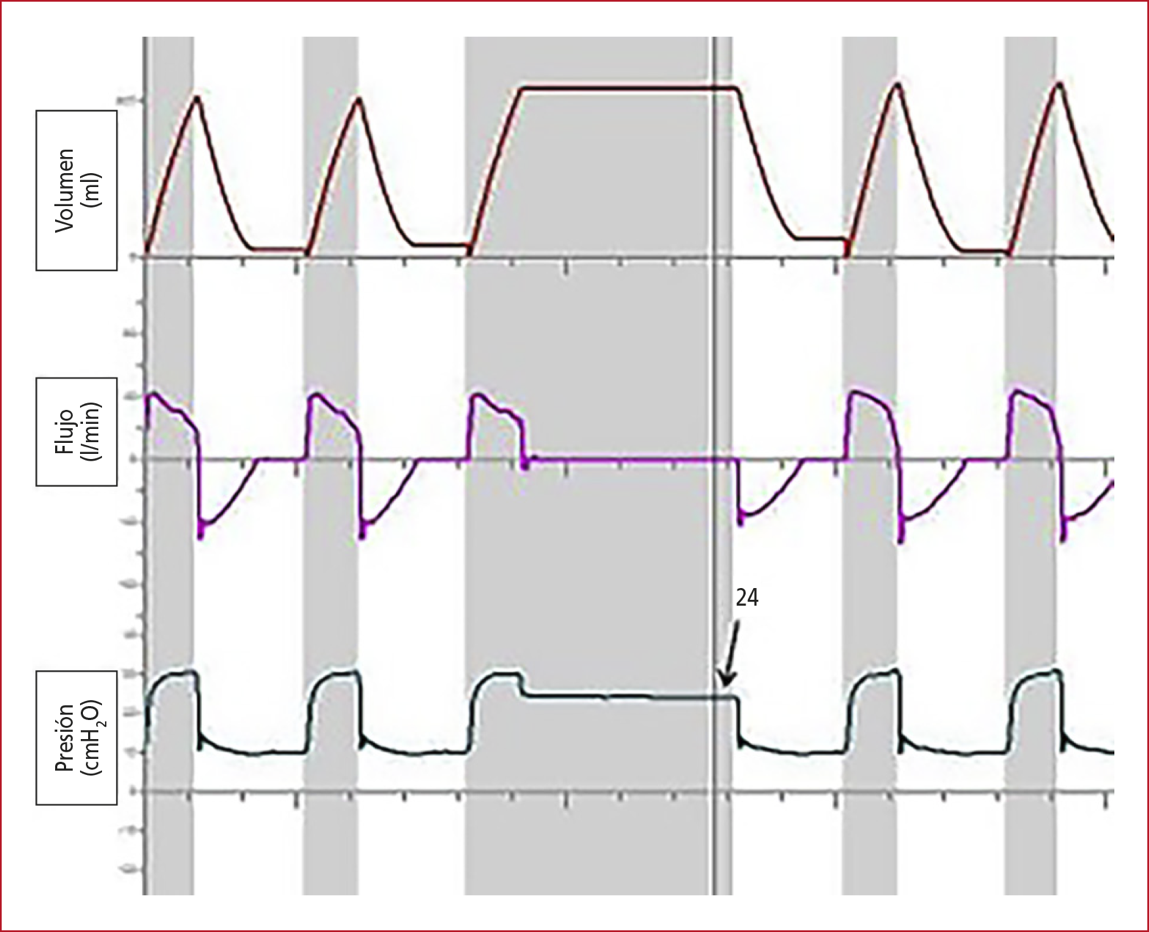
Figura 9. Medición de la presión meseta mediante la oclusión manual tele-inspiratoria prolongada, en el modo PC-CMV.
Es importante
aclarar que dicho valor será representativo para el VC entregado en ese ciclo
respiratorio y que cualquier alteración de la mecánica respiratoria, tanto del
componente resistivo como elástico, impacta directamente sobre el VC
resultante. Además, la prolongación del Ti puede favorecer el desarrollo de
atrapamiento aéreo.
Una PM
>28-30 cmH2O indica riesgo de distensión alveolar
excesiva y, por lo tanto, es un límite que no debería sobrepasarse.56
No obstante,
existen condiciones es las que un valor mayor no refleja necesariamente un
estrés pulmonar elevado. En casos de aumento de la elastancia del tórax
(obesidad, aumento de la presión intrabdominal, cifoescoliosis), una PM alta
podría ser segura (y necesaria).
A fin de
optimizar el manejo de la VM en estas condiciones, podría ser beneficioso medir
la Pes para calcular la PTP. El cálculo de la PTPi utilizando el método basado
en la elastancia representa el estrés que sufren las regiones no dependientes
del pulmón,91 que son las más expuestas a un alto riesgo de
sobredistensión alveolar.92
4.2. Auto-PEEP
Cuando la
mecánica respiratoria es normal en un paciente que recibe VM, el flujo
espiratorio al final de la espiración es igual a 0, y la presión alveolar y la
presión en la vía aérea (en general, el nivel de PEEP programado) son iguales.
El paciente alcanza el volumen de relajación, donde se halla en equilibrio (la
capacidad residual funcional o el volumen pulmonar de fin de espiración, en
caso de que tenga PEEP). Si el flujo espiratorio persiste al final de la
espiración, hay atrapamiento de aire, por lo cual la capacidad residual
funcional o el volumen pulmonar de fin de espiración son mayores que el volumen
de relajación.88,93,94
Un aumento
del volumen pulmonar de fin de espiración por encima del volumen de relajación
se denomina comúnmente hiperinsuflación pulmonar dinámica. La hiperinsuflación
pulmonar dinámica (un fenómeno de “volumen”) se asocia con un aumento en el
retroceso elástico al final de la espiración del sistema respiratorio (un
fenómeno de “presión”). Dicho aumento en el retroceso elástico al final de la
espiración se ha denominado auto-PEEP o PEEPi.93-95
Este fenómeno
es muy común en los pacientes con obstrucción del flujo aéreo, pero también se
ha descrito en los pacientes con SDRA, asociado fundamentalmente al cierre de
la vía aérea a bajos volúmenes pulmonares y al uso de FR elevadas (Figura 10).96,97
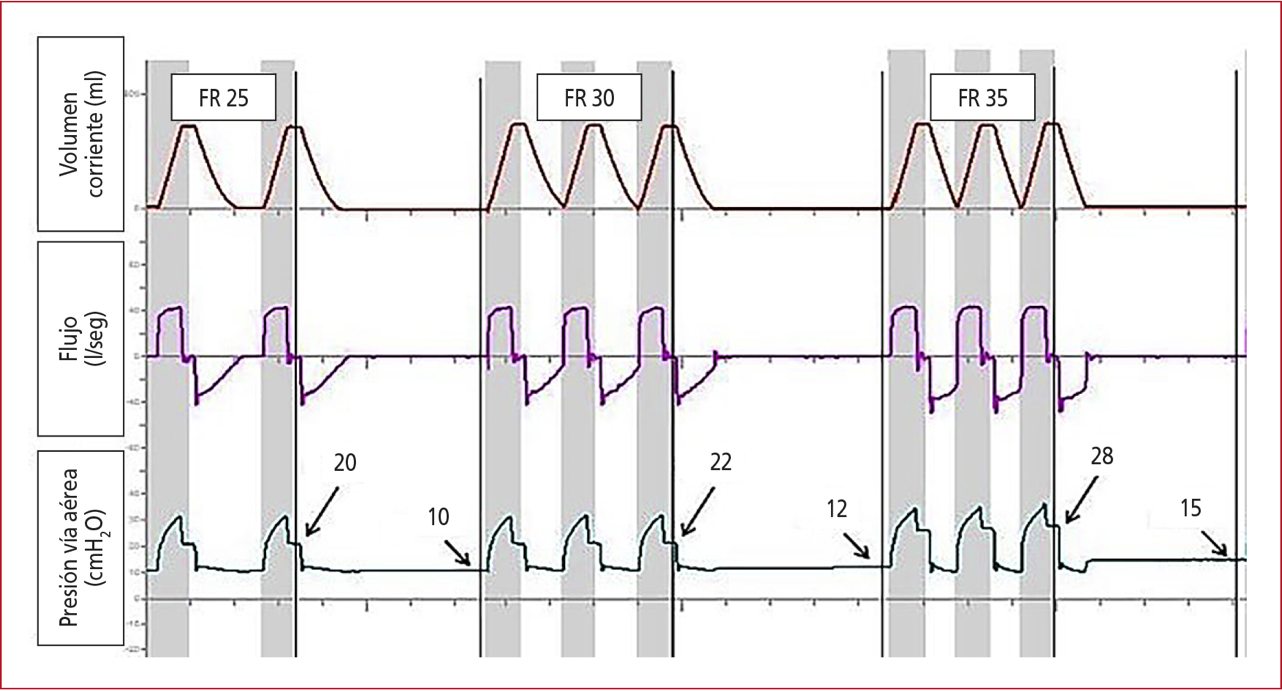
Figura 10. Impacto de la frecuencia respiratoria (FR) en el desarrollo de la PEEP intrínseca. El aumento progresivo de la FR disminuye el tiempo espiratorio, con persistencia de flujo espiratorio al inicio del nuevo ciclo ventilatorio, lo que provoca atrapamiento aéreo e incremento tanto de la PEEP intrínseca como de la presión meseta.
Se han
reportado valores disímiles de PEEPi en los pacientes ventilados con SDRA, que
oscilan entre 1 y 12 cmH2O.98,99 El valor de la PEEPi es dependiente de la programación del respirador,
principalmente el VC y el tiempo espiratorio permitido, y de las
características mecánicas del sistema respiratorio (resistencia y
distensibilidad). Se puede incrementar con el aumento de la resistencia y la
distensibilidad, la FR, el Ti y el VC.88,94
Se podría
sospechar este fenómeno cuando en la gráfica de flujo-tiempo del respirador se
observa la persistencia de flujo espiratorio al final de la espiración, cuando
hay una PM elevada sin otra causa que lo justifique o hipotensión arterial
sostenida.94,98
En los
pacientes ventilados en fase de soporte total, utilizamos las mediciones de la
PEEPi “estática”. Estas se obtienen empleando el método de oclusión sostenida
de la vía aérea al final de la espiración por 0,5 a 2 segundos, durante el cual
el flujo debe ser 0, la gráfica de la presión debe mantenerse plana y estable,
y se debe corroborar la ausencia de movimientos torácicos o abdominales al
mirar directamente al paciente durante la pausa tele-espiratoria.94,98
La diferencia
de presión en la vía aérea entre la presión obtenida al final de la oclusión y
la presión previa a la oclusión se conoce como PEEPi, mientras que la
diferencia de presión en la vía aérea entre la presión obtenida al final de la
oclusión y la presión atmosférica se conoce como PEEP total (PEEPt).88
El momento y
la ubicación de la oclusión son aspectos técnicos determinantes. La oclusión de
las vías respiratorias debe ocurrir al final del período de exhalación
establecido, justo antes de que comience el flujo inspiratorio del respirador.
Las oclusiones aplicadas demasiado pronto durante la exhalación sobrestiman la
PEEPi o sugieren su presencia cuando no existe PEEPi.94
La mayoría de
los respiradores tienen una opción de medición de la PEEPi que ocluye las
válvulas del respirador al final del ciclo respiratorio de manera automatizada,
así como también la posibilidad de hacer oclusiones de forma manual.
La presencia
de PEEPi puede hacer que el nivel de PEEPt que está recibiendo el paciente sea
subestimado y que los cálculos de PD y DSR sean erróneos. Además, en el modo
VC-CMV puede aumentar la PM y, en el modo PC-CMV, disminuir el VC.
4.3. Presión de distensión
La PD es una
variable de la mecánica respiratoria que relaciona el VC con la distensibilidad
del sistema respiratorio. Es la presión utilizada para equilibrar las fuerzas
elásticas cuando se insufla el VC programado. Su valor depende del VC
programado y de la distensibilidad del pulmón aireado.86
Si bien se
describió como variable de protección pulmonar hace ya varios años,37,100 algunos estudios recientes
sostienen que, en pacientes con SDRA, la PD puede considerarse el mejor factor
subrogado para evaluar el estrés y la tensión a la que está siendo sometido el
sistema respiratorio, de manera sencilla y confiable al lado de la cama del
paciente.9,101,102
En un estudio
retrospectivo que incluyó a 3562 pacientes con SDRA de nueve estudios
aleatorizados y controlados de protección pulmonar, Amato et al hallaron que la
PD fue la variable ventilatoria más asociada con la supervivencia. En este
análisis, el riesgo relativo de muerte aumentó significativamente por encima de
un umbral de PD de 14 cmH2O, incluso en pacientes ventilados con
VC y PM aparentemente “protectores”. En otros estudios, también comunicaron
esta asociación entre PD elevada y muerte, algunos con valores de corte
diferentes.9,86,101-103
En un estudio
prospectivo reciente que evaluó la mecánica respiratoria en pacientes con SDRA
ventilados a 6 ml/kg según el PCP, la PD alta tuvo la asociación más fuerte con
la muerte, entre muchas variables de mecánica respiratoria (inclusive algunas
de monitoreo avanzado).104
Teniendo en
cuenta que la mayoría de los estudios sobre la PD son retrospectivos y que la
forma de evaluarla no está estandarizada (tiempo de las oclusiones, medición de
la PEEPt), los valores de corte que se han descrito podrían llegar a diferir en
algunos cmH2O. Se desconoce qué impacto podría
tener esta diferencia.
La PD se mide
en condición estática (a flujo cero) o cuasiestática utilizando la diferencia
de presión entre la PM y la PEEPt o la PEEP establecida.9,86,88
Un enfoque
clásico para su medición en condiciones estáticas es realizar una maniobra de
doble oclusión (de 2-3 segundos de duración): una pausa tele-inspiratoria para
medir la PM y una tele-espiratoria para medir la PEEPt. La PD es, entonces, la
diferencia de presión entre la PM y la PEEPt.86,88
Otro enfoque
es medir la PM con pausas de 0,2-0,3 segundos al final de la inspiración en
modo VC-CMV. De esta manera, la PD es la diferencia entre la PM y la PEEP
programada (o la PEEPt) y puede evaluarse de manera continua y es menos
sensible a pequeñas fugas en el sistema (Figura 11).104
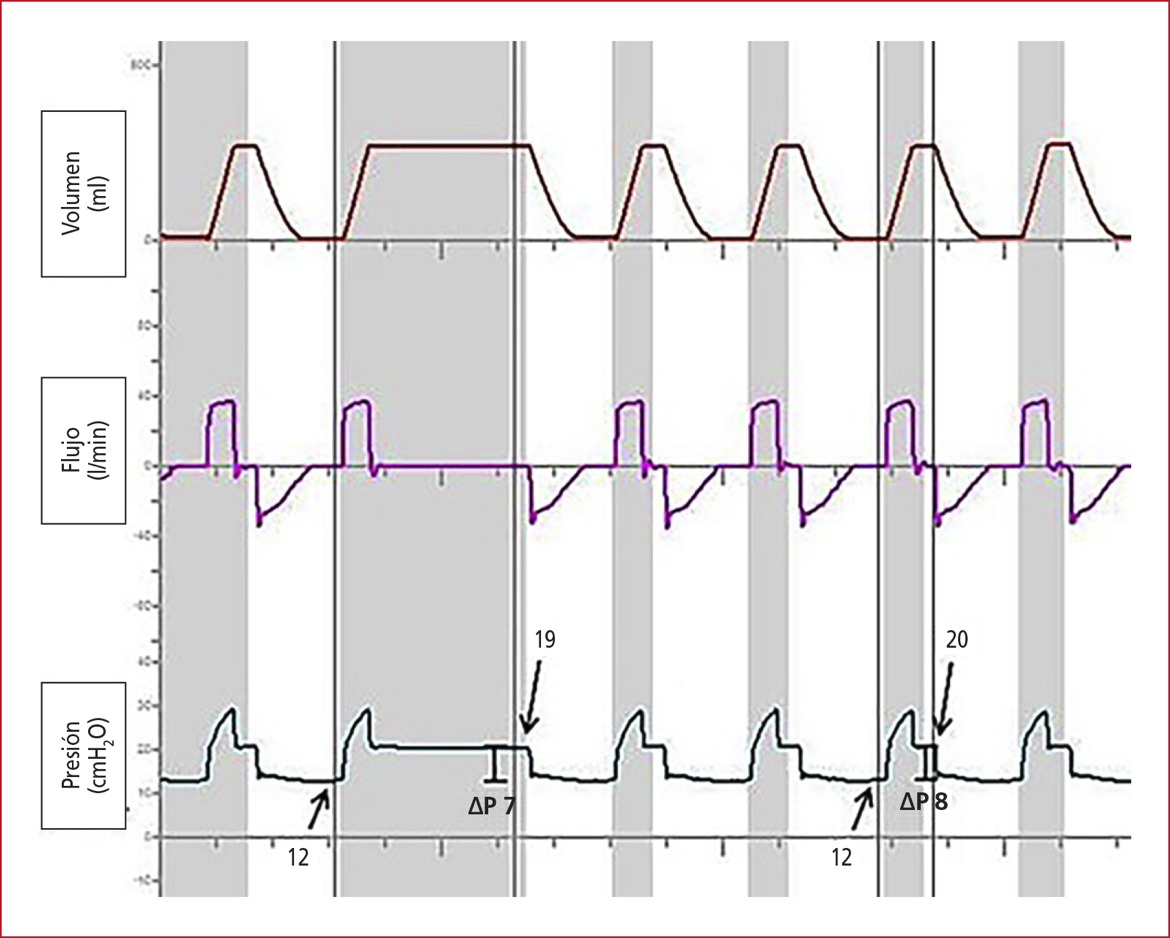
Figura 11. Cálculo de la presión de distensión. Se muestran las curvas de un paciente ventilado en modo de ventilación mandatoria continua controlada por volumen. Se señalan los valores de presión de distensión obtenidos utilizando una pausa inspiratoria prolongada (segundo ciclo graficado) y una pausa de 0,3 segundos (quinto ciclo ventilatorio).
En 2016, el
grupo de Gattinoni describió el concepto de mechanical power, o potencia
mecánica, expresado como un cálculo matemático que mide la energía entregada
por unidad de tiempo al tejido pulmonar. La ecuación integra la contribución
relativa de todos los actores involucrados en la generación de VILI (presión
pico, PD, VC y FR). Las variables de mayor impacto fueron el VC, la PD y el
flujo, mientras que la FR y la PEEP105 tuvieron un peso menor.
En los
últimos años, se demostró que la PD tiene un efecto sobre la mortalidad cuatro
veces mayor que la FR.106 Este hallazgo es interesante,
porque entonces si tenemos que aumentar el volumen respiratorio por minuto en
una situación clínica específica, el aumento de la FR sería menos dañino que el
aumento de la PD (lo cual ocurriría si se aumenta el VC).
El monitoreo
de la PD podría mejorar la seguridad del manejo de la VM en los pacientes con
SDRA, pero es preciso investigar prospectivamente la técnica de medición y el
valor objetivo de PD. Además, no hay estudios que evalúen qué efecto tendría
sobre la mortalidad programar el respirador para disminuir la PD.
4.4. Sincronía paciente-respirador
La
disincronía paciente-respirador es frecuente durante la VM, y se asocia con un
aumento de la duración de la VM y la mortalidad.107-109
Con el uso de
ventilación protectora durante la fase aguda del SDRA, los pacientes suelen
estar profundamente sedados. Además, es frecuente la administración temprana de
agentes bloqueadores neuromusculares, ya que se ha demostrado que este
tratamiento mejora la supervivencia y prolonga los días libres de
VM.110
Durante la
ventilación en condiciones pasivas, el trabajo respiratorio total es asumido
por el respirador. En esta situación (sedación profunda y eventualmente bloqueo
neuromuscular), no se esperaría encontrar disincronías entre el paciente y el
respirador.
Sin embargo,
se han descrito disincronías paciente-respirador durante la implementación de
la VM protectora en pacientes con sedación profunda111 y en la transición de la sedación profunda
hacia el comienzo de la respiración espontánea.112
Akoumianaki
et al describieron el denominado ”trigger reverso”, donde una
insuflación controlada por el respirador desencadena un esfuerzo inspiratorio
del paciente.113 Esta parece ser una de las asincronías
prevalentes en pacientes con SDRA.114
Durante el trigger
reverso, si, al finalizar la inspiración mecánica del respirador, el esfuerzo
muscular del paciente continúa y supera el umbral de disparo, se desencadena
una nueva respiración asistida (trigger reverso con doble disparo). De
lo contrario, el esfuerzo del paciente no activará el respirador (trigger
reverso sin doble disparo) (Figura 12).111
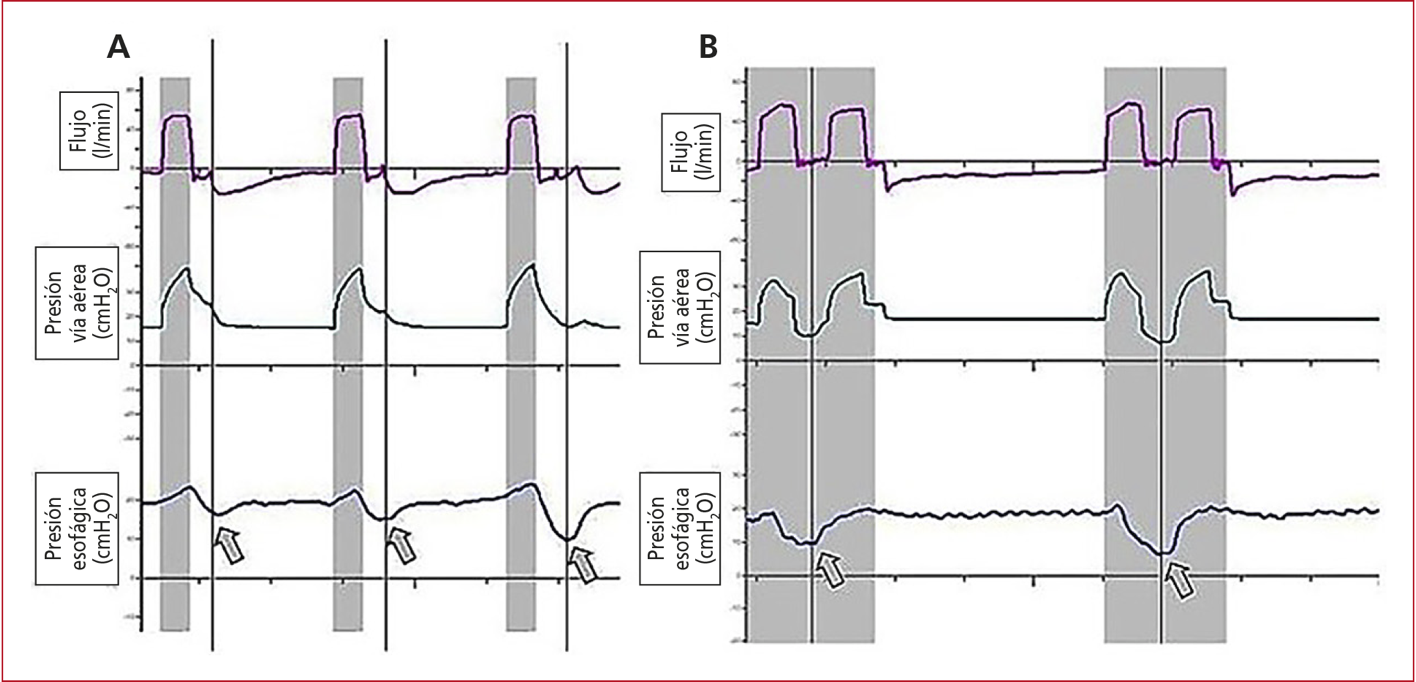
Figura 12. Curvas de un paciente ventilado en modo de ventilación mandatoria continua controlada por volumen, con asincronía de trigger reverso. A. Trigger reverso sin doble disparo. Las flechas señalan el esfuerzo del paciente al final de la inspiración mecánica. B. Trigger reverso con doble disparo. El primer ciclo es iniciado por el respirador, el esfuerzo del paciente (señalado en la curva de presión esofágica) comienza al final del ciclo mecánico y se prolonga con una duración e intensidad suficientes para disparar un segundo ciclo mecánico.
En el primer
caso, el paciente puede estar expuesto a un VC excesivo, alta PTP y al
desarrollo de esfuerzo muscular elevado. En varios estudios, se hallaron
inspiraciones dobles en pacientes con sedación profunda, dejándolos expuestos en condiciones ventilatorias
perjudiciales debido al aumento significativo del VC y a valores elevados de
esfuerzo de los músculos respiratorios.115-117
En el segundo
caso, trigger reverso sin doble disparo, el esfuerzo del paciente podría
tener algún efecto positivo sobre la función muscular, pero, a su vez, el
desarrollo de contracciones excéntricas podría ser potencialmente nocivo para
los músculos respiratorios, lo que es motivo de controversia. Además, esta
forma de disincronía puede ser más difícil de detectar al lado de la cama del
paciente y llevar a errores en el monitoreo de la PM (en general, la PM es
menor cuando se evalúa con tiempo de pausa corto y el paciente tiene este tipo
de asincronía).89,118,119
Cuando el
paciente comienza a interactuar con el respirador, una porción del trabajo
total la realiza el respirador y otra, el paciente, generándose una
transferencia de trabajo.120
Si la demanda
del paciente es muy elevada o si la programación del respirador es inadecuada
para satisfacer dicha demanda, la transferencia de trabajo hacia el paciente
puede ser excesiva, y exponerlo a una lesión pulmonar o de los músculos
respiratorios. Esta situación ha sido llamada de distintas maneras: deprivación
de flujo, asincronía de flujo, flujo insuficiente. La transferencia de trabajo
está condicionada por el modo ventilatorio. La inspección de las curvas del
respirador permite detectar la magnitud de esta transferencia de trabajo
(Figura 13).120
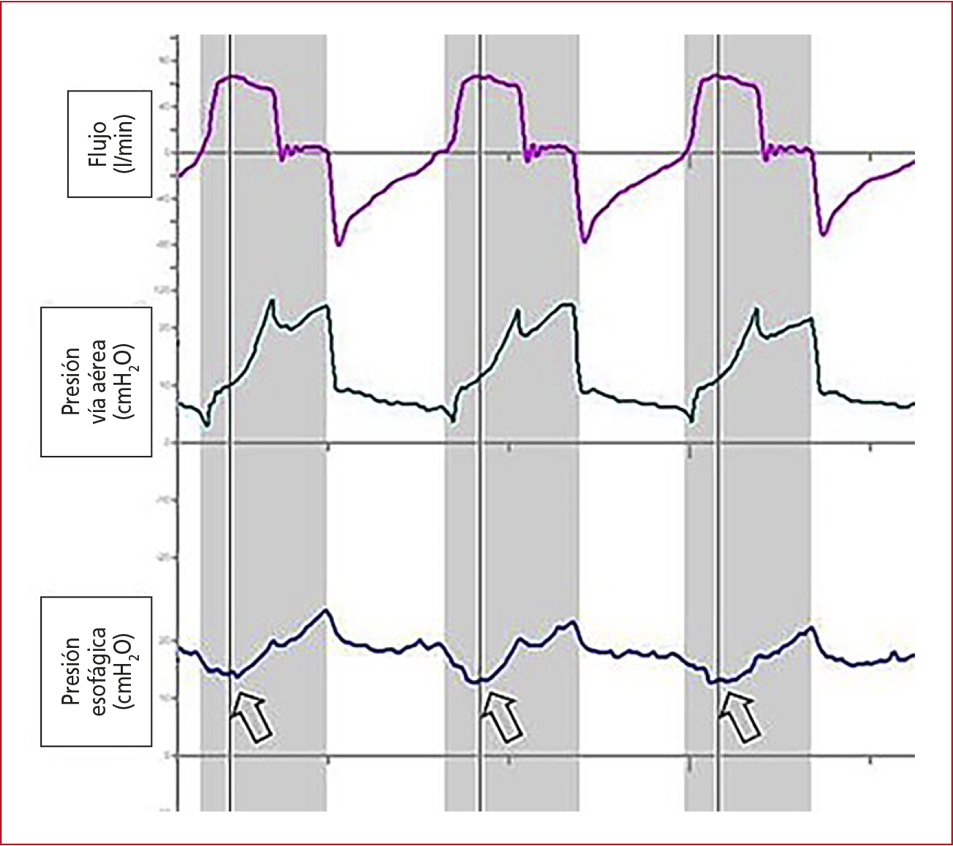
Figura 13. Transferencia de trabajo en un paciente en modo de ventilación mandatoria continua controlada por volumen. El esfuerzo del paciente dispara el respirador. El flujo es insuficiente para satisfacer su demanda. Las flechas señalan el esfuerzo inspiratorio del paciente (curva de presión esofágica) y su impacto en la presión en la vía aérea (concavidad en la curva de presión en la vía aérea en el tiempo durante el esfuerzo inspiratorio).
En casos
extremos, el esfuerzo del paciente puede ser de tal magnitud y duración que
pueden dispararse dos o más ciclos respiratorios, provocando disparos dobles.121
El uso de VM
protectora con bajo VC en pacientes que tienen esfuerzos respiratorios
espontáneos puede aumentar significativamente el trabajo respiratorio, sobre
todo si el VC es <7 ml/kg.122,123
Los modos que
utilizan la presión como variable de control (PC-CMV, ventilación controlada
por volumen regulada por presión) no disminuyen el trabajo respiratorio y, a
menudo, permiten aumentos del VC.44
En resumen,
las disincronías paciente-respirador en los enfermos con SDRA que reciben VM
protectora suelen ser frecuentes, tanto durante la fase inicial de la
enfermedad como en la fase de transición a la respiración espontánea. Su
aparición puede generar errores en la valoración de la mecánica respiratoria;
por lo tanto, se debe pesquisar activamente como parte del monitoreo de rutina.
Por otro lado, las disincronías pueden incrementar el trabajo respiratorio y,
en algunas situaciones, favorecer el desarrollo de daño muscular y pulmonar. En
este escenario, la transferencia de trabajo excesivo y el trigger
reverso con doble disparo podrían ser las más perjudiciales.
5. Modificaciones en la programación inicial de la
VM
Luego de la
programación inicial de la VM, pueden ser necesarias modificaciones después del
monitoreo de la mecánica respiratoria y el control del estado ácido-base.
5.1. Correcciones de la ventilación
5.1.1. Alcalemia
Si, con la
programación inicial sugerida, el paciente tiene alcalemia (pH >7,45), la
conducta sugerida en los estudios es disminuir la FR.7,34,35,51
5.1.2. Acidemia
Si el
paciente tiene acidemia (pH <7,30), se sugieren las siguientes
intervenciones:
• Aumentar la FR (hasta un máximo de 35
ciclos/minuto).7,33-35,51 Al aumentar la FR es posible que se deban
hacer correcciones sobre el valor de flujo inspiratorio, la onda de flujo y la
pausa inspiratoria, de manera que el atrapamiento aéreo se vea minimizado.
• Reducir el espacio muerto instrumental
(retirar humidificador pasivo, conectores).34,35
• Si la acidemia persiste, pese a las
medidas previas (y, sobre todo, si el pH es <7,15-7,20) podría considerarse
la infusión de bicarbonato.7,33-35,51
• Si la acidemia persiste, pese a las
medidas previas, podría considerarse aumentar el VC a 7-8 ml/kg según el PCP, a
expensas de mantener valores elevados de PM y PD.7,34,35,51
• Si la acidemia persiste, pese a las
medidas previas, podría considerarse el soporte extracorpóreo (remoción
extracorpórea de CO2/extracorporeal membrane oxygenation,
[ECMO]).35
El orden de
aplicación de estas correcciones dependerá de las decisiones clínicas y de la
disponibilidad de cada centro.
Siempre es
recomendable considerar y tratar el aumento de la producción de CO2 (fiebre, sobrealimentación) y la acidosis metabólica y sus causas.
En la Tabla
7, se muestran los objetivos de ventilación y los ajustes correspondientes de
programación de la VM, basados en el estudio de la ARDS Network.7
Tabla 7
Objetivos de ventilación y correcciones
programadas
|
Condición |
Ajustes del protocolo de ventilación
mecánica |
||
|
Corrección 1 |
Corrección 2 |
Corrección 3 |
|
|
Alcalosis (pH >7,45) |
¯ FR (hasta 6 mínimo) Mantener PaCO2 40-60 mmHg |
¯ VC 1 ml/kg si es necesario (VC mínimo 5
ml/kg) |
¯ VC 1 ml/kg si es necesario (VC mínimo 4
ml/kg) |
|
Acidosis moderada (pH 7,15-7,29) |
FR (hasta 35 máximo) Mantener pH ≥7,30 con PaCO2 ≥25 mmHg |
Si pH <7,30 con PaCO2 <25 mmHg, considerar NaHCO3 |
|
|
Acidosis severa (pH <7,15) |
FR (hasta 35 máximo) |
Considerar NaHCO3 |
VC (de a 1 ml/kg), aunque PM ≥30 cmH2O |
En cada condición clínica, se realiza una
corrección y se reevalúa. Si fuera necesario, se pasa a la corrección 2 y
eventualmente a la corrección 3.
FR
= frecuencia respiratoria; PaCO2
= presión arterial de dióxido de carbono; VC = volumen corriente; PM = presión
meseta; NaHCO3
=
bicarbonato de sodio.
5.2. Correcciones de la oxigenación
Las
correcciones dependen del método que se haya utilizado para seleccionar el
nivel de PEEP y FiO2.
5.2.1. Hiperoxemia
La
hiperoxemia está definida por la existencia de una PaO2 >80 mmHg o SatO2 >96%.
Tablas PEEP/FiO2
Según el
concepto de uso de estas tablas, en caso de hiperoxemia, se debe disminuir
progresivamente la PEEP o la FiO2, según corresponda, desplazándose hacia la izquierda en la tabla
utilizada.7,18,33,38
PEEP-Distensibilidad del sistema respiratorio
No disminuir
la PEEP durante, al menos, 24 horas. Se puede disminuir la FiO2 hasta un mínimo de 0,3.35,39
Si la
oxigenación se ha mantenido estable por 24 horas y la FiO2 es <0,4, puede considerarse comenzar a bajar la PEEP (2 cmH2O cada 8 horas).35,39
Máximo reclutamiento o estudio Express
Disminuir la
FiO2 progresivamente, sin cambiar el VC ni
la PEEP, hasta alcanzar el objetivo de oxigenación buscado.34
Presión esofágica
Disminuir la
FiO2 progresivamente hasta un mínimo de
0,3. Mantener siempre una PTPe >0 cmH2O.51
PHARLAP
Disminuir la
FiO2 hasta que la SatO2 sea del 90-95%.40
Morfología pulmonar
Disminuir la
FiO2 progresivamente, manteniendo el VC y
la PEEP programados.36
5.2.2. Hipoxemia
La hipoxemia
es definida por una PaO2 <55-60 mmHg o una SatO2 <88%.
Tablas PEEP/FiO2
Si la
oxigenación es baja, se debe aumentar progresivamente la PEEP o la FiO2 (desplazándose hacia la derecha en la tabla). Si la oxigenación no mejora
a pesar de una FiO2 de 1 y una PEEP de 24 cmH2O, se puede continuar incrementando la PEEP (hasta 34 cmH2O), liberando el límite de PM.7
PEEP-Distensibilidad del sistema respiratorio
Subir la FiO2 en pasos de 0,05 a 0,1, manteniendo la programación del VC y la PEEP.
En el caso de
que la PaO2/FiO2 sea <250, haya una caída de más de 50 puntos de la previa,
desconexiones accidentales del respirador, o se necesite una FiO2 >0,4 para mantener una oxigenación adecuada, se puede considerar hacer
una MRA y programar la PEEP 2-3 cmH2O por encima del valor previo (no es
necesario volver a ajustar la PEEP de manera decreciente según la DSR).35,39
Se pueden
tolerar caídas transitorias en la oxigenación (<10 min) durante la
aspiración de secreciones, procedimientos invasivos o cambios de posición,
aumentando la FiO2 a 1 durante períodos cortos.
Máximo reclutamiento o estudio Express
Aumentar el
nivel de la PEEP progresivamente hasta alcanzar un valor máximo de 32 cmH2O de PM.34
Presión esofágica
Aumentar el
nivel de la PEEP o la FiO2 progresivamente según corresponda en
la tabla FiO2/PTPe, hasta un máximo de FiO2 de 1 y hasta un máximo de 6 cmH2O de PTPe.51
PHARLAP
En caso de
caída de la SatO2 >2%, puede realizarse una MRA de
corta duración, como las descritas en el protocolo.40
Morfología pulmonar
Si no se
puede alcanzar el objetivo de oxigenación:
Para los
pacientes con SDRA focal: puede realizarse una MRA de rescate (CPAP 30-35 cmH2O por 30 segundos).36
Para los
pacientes con SDRA difuso: disminuir el VC a 4-5 ml/kg, MRA y reajustar la PEEP
a 30 cmH2O de la PM, o colocar en posición
prona.36
5.2.3. Hipoxemia refractaria
Si bien no
hay una definición estandarizada, en la mayoría de los estudios, se considera
hipoxemia refractaria a la situación clínica en la cual el paciente no alcanza
el objetivo de oxigenación con FiO2 de 0,8-1, pese a haber optimizado el
tratamiento de selección de PEEP y FiO2.
Se han
propuesto los siguientes tratamientos como coadyuvantes para el manejo del
paciente con hipoxemia refractaria:
• Posición prona34,35,38-40,51
• Óxido nítrico
inhalado34,35,38,39,51
• Oscilación de alta frecuencia38-40,51
• Ventilación jet38
• Ventilación con relación invertida
entre los tiempos inspiratorio y espiratorio39
• Bismesilato de almitrina por vía
intravenosa34
• Epoprostenol sódico51
• Prostaciclina inhalada40
• MRA51
• Ventilación con liberación de presión
en la vía aérea51
Claramente,
la posición prona es la primera intervención para estos pacientes.124 Los demás tratamientos estarán determinados
por el juicio clínico y la disponibilidad de cada unidad.
5.3. Correcciones sobre la mecánica respiratoria
Si, con la
programación inicial, la PM es >30 cmH2O (o la PTPi es >20 cmH2O) o la PD es >15 cmH2O, se debería considerar reducir el VC de 6 a 5 o 4 ml/kg, en pasos de 1
ml/kg.7,34,35,38-40,51 Probablemente, esto requiera de
nuevos ajustes de la FR, el flujo y el Ti para mantener una ventilación
adecuada.
Si esas
medidas no logran el objetivo deseado, se podría reducir el nivel de la PEEP
(si esto fuera posible) o tolerar dichos valores.
Si el
paciente mantiene estos valores anormales a pesar de los ajustes de la VM,
podría considerarse iniciar soporte extracorpóreo (ECMO o remoción
extracorpórea de CO2), para reducir el VC y la PM.125
5.4. Corrección de las disincronías
Si hay una
transferencia de trabajo excesiva hacia el paciente, hay que tratar de corregir
la programación del respirador de manera de satisfacer la demanda. Así, podría
ser útil revisar la programación de la sensibilidad o aumentar la FR.
En el modo
VC-CMV, aumentar el flujo inspiratorio, utilizar una onda de flujo decreciente,
o aumentar el VC a 7-8 ml/kg si lo permite la PM.18
En el modo
PC-CMV, ajustar el nivel de tiempo de presurización (rise time) o el
nivel de presión.120
Cuando la
transferencia de trabajo hacia el paciente es extrema (drive
respiratorio elevado, hipoxemia, acidosis) es difícil que la VM pueda aliviarla
sin el uso de sedación profunda o parálisis muscular.
Si se
producen asincronías del trigger reverso no es esperable que el aumento
de la sedación pueda inhibirlas. Alternativamente, reducir los niveles de
sedación para aumentar el drive respiratorio (si el cuadro clínico lo
permite) podría ayudar a eliminarlo. Además, disminuir la FR
programada favorece que el esfuerzo del paciente comience antes de la
insuflación pasiva y, eventualmente, sea el paciente quien tome el control e
inicie todos los ciclos ventilatorios. Mientras que, en el otro extremo,
aumentar la FR programada en el respirador podría disminuir
el impulso ventilatorio del paciente y evitar que ocurra esta
disincronía.
A pesar de lo
anterior y debido a la complejidad del fenómeno, estos ajustes relacionados con
los niveles de sedación y los parámetros ventilatorios no siempre son exitosos.
Como última opción, el bloqueo neuromuscular para abolir la contracción
muscular es un recurso eficaz para eliminar el trigger reverso.
6. Criterios para iniciar la transición desde la
fase inicial (soporte ventilatorio total) hacia la fase de soporte ventilatorio
parcial e inicio de la desconexión
Cuándo es el
momento oportuno, cuáles son los criterios para finalizar la fase de VM
controlada y cómo implementar la transición hacia la respiración espontánea son
cuestiones que no están claramente establecidas en la bibliografía.
La mayoría de
los ensayos clínicos que han comparado distintas estrategias de VM en pacientes
con SDRA coinciden en que la mejoría de la oxigenación es una condición
necesaria para iniciar el proceso de desconexión de la VM.7,33-41 Este criterio se ha consignado por un menor
requerimiento de FiO2,35,39 de PEEP (o ambos),7,33,37,38,40,41 o al alcanzar un determinado umbral
de PaO2/FiO2.34 En algunos, hay criterios temporales para
iniciar esta fase (al menos, 48-96 h desde el inicio de la VM protectora).
En general,
la transición desde la fase de soporte ventilatorio total hacia la fase de
soporte parcial y la desconexión de la VM se ha implementado utilizando presión
de soporte, con niveles de asistencia decrecientes.
Los criterios
para iniciar la fase de desconexión de la VM y realizar pruebas de respiración
espontánea en los estudios más representativos se describen en la Tabla 8.
Tabla 8
Criterios para iniciar la fase de desconexión de la ventilación mecánica y para realizar una prueba de respiración
espontánea (PRE)
|
Estudio |
Criterios para iniciar la fase de desconexión |
Modalidad de soporte ventilatorio parcial |
Criterios para realizar una PRE |
|
Amato et al, 199837 |
FiO2 <0,4 y PEEP <10 cmH2O |
PS decreciente |
Si PS 5 cmH2O, PEEP 5 cmH2O, FiO2 <0,4, extubar |
|
ARDS Network, 20007 |
PEEP ≤8 cmH2O y FiO2 ≤0,4, sin BNM, PAS <90 mmHg sin vasopresores |
PS decreciente desde 15-20 cmH2O, descanso nocturno en modo VC-CMV |
Si PS 5 cmH2O por 2 h, realizar PRE en CPAP 5 cmH2O |
|
Brower et al, 200433 |
PEEP ≤8 cmH2O y FiO2 ≤0,4 |
PS decreciente |
ND |
|
Mercat et al, 200834 |
Si PaO2/FiO2 >150 mmHg y FiO2 ≤0,6 (día 4): prueba de destete de PEEP (PEEP 5 cmH2O, FiO2 0,5) |
Si PaO2/FiO2 >200 mmHg en la prueba de destete de PEEP: Modo VC-CMV o PS, PEEP 5 cmH2O, presión máxima <30 cmH2O |
Prueba de destete de PEEP exitosa, sin vasopresores, sin sedación, con respuesta a órdenes, tos durante la aspiración |
|
Meade et al, 200838 |
PEEP ≤10 cmH2O y FiO2 ≤0,4 |
PS en caso de molestias del paciente, hasta alcanzar criterios de PRE |
Evaluación para PRE. Prueba de fuga |
|
Kacmarek et al, 201639 |
FiO2 ≤0,4 por 24 h |
Descenso de PEEP (2 cmH2O cada 8 h). Modo PC-CMV o PS |
Mejoría de la causa de ventilación mecánica, estabilidad hemodinámica, sin sedación profunda, con esfuerzo respiratorio espontáneo. PRE de 30 a 60 min |
|
Cavalcantiet al, 201735 |
Si FiO2 ≤0,4 durante 24 h, reducir PEEP 2 cmH2O cada 8 h |
Destete de PEEP y PS decreciente a partir de PEEP ≤14 cmH2O |
Mejoría de la enfermedad de base, paciente alerta y cooperativo, sin dolor, tos adecuada, escasas secreciones, sin aumento del trabajo respiratorio: PRE en PS 5 cmH2O, PEEP 5 cmH2O |
|
Hodgson et al, 201940 |
Estabilidad clínica, SatO2 >90%, FiO2 ≤0,4 y PEEP <10 cmH2O por 6 h |
Destete de PEEP (2,5 cmH2O cada 4 h) |
Adecuada protección de la vía aérea, escasas secreciones, razonable nivel de conciencia sin sedantes |
|
Beitler et al, 201941 |
Si
PTPe 0 cmH2O y FiO2 0,4-0,5 durante 24 h
transición a tabla de PEEP/FiO2 |
Si PEEP ≤0 cmH2O y FiO2 ≤0,4, estable hemodinámicamente, con esfuerzo respiratorio espontáneo: PS y PEEP decreciente |
Si PS y PEEP <10 cmH2O durante 12 h, PRE |
FiO2 = fracción inspirada de oxígeno; PEEP (positive end-expiratory pressure) = presión positiva al final de la espiración;
PS = presión de soporte; BNM = bloqueadores neuromusculares; PAS = presión arterial sistólica; VC-CMV (volume-controlled continuous mandatory ventilation) = ventilación mandatoria continua controlada por volumen; CPAP (continuous positive airway pressure) = presión positiva continua en la vía aérea; PaO2 = presión arterial de oxígeno; PC-CMV (pressure-controlled continuous mandatory ventilation) = ventilación mandatoria continua controlada por presión; SatO2 = saturación de oxígeno; PTPe = presión transpulmonar espiratoria; ND = no descrito.
7. Conclusiones
El manejo de
la VM invasiva de los pacientes con diagnóstico de SDRA puede ser determinante
de su evolución.
La
preparación del respirador y de las interfaces, la selección adecuada de los
parámetros de la VM, su monitoreo y las correcciones previstas para enfrentar
distintas situaciones emergentes son la clave para implementar adecuadamente la
protección pulmonar en los pacientes con SDRA.
Esperamos que
esta revisión, con un análisis detallado de los protocolos de VM más
relevantes, sirva como una herramienta de mejora a los profesionales de la
salud.
Conocer,
adoptar e implementar estas estrategias puede favorecer una VM segura, eficaz,
y mejorar los resultados de los pacientes con SDRA.
8. Bibliografía
1.
Ashbaugh
DG, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress in adults.
Lancet 1967; 2(7511): 319-323. https://doi.org/10.1016/S0140-6736(67)90168-7
2.
Webb HH,
Tierney DF. Experimental pulmonary edema due to intermittent positive pressure
ventilation with high inflation pressures. Protection by positive
end-expiratory pressure. Am Rev Respir Dis 1974; 110(5): 556-565. https://doi.org/10.1164/arrd.1974.110.5.556
3.
Dreyfuss
D, Soler P, Basset G, Saumon G. High inflation pressure pulmonary edema.
Respective effects of high airway pressure, high tidal volume, and positive
end-expiratory pressure. Am Rev Respir Dis 1988; 137(5): 1159-1164. https://doi.org/10.1164/ajrccm/137.5.1159
4.
Dreyfuss
D, Basset G, Soler P, Saumon G. Intermittent positive-pressure hyperventilation
with high inflation pressures produces pulmonary microvascular injury in rats.
Am Rev Respir Dis 1985; 132(4): 880-884. https://doi.org/10.1164/arrd.1985.132.4.880
5.
Muscedere
JG, Mullen JB, Gan K, Slutsky AS. Tidal ventilation at low airway pressures can
augment lung injury. Am J Respir Crit Care Med 1994; 149(5): 1327-1334. https://doi.org/10.1164/ajrccm.149.5.8173774
6.
Ranieri
VM, Suter PM, Tortorella C, et al. Effect
of mechanical ventilation on inflammatory mediators in patients with acute
respiratory distress syndrome: a randomized controlled trial. JAMA 1999;
282(1): 54-61. https://doi.org/10.1001/jama.282.1.54
7.
Acute
Respiratory Distress Syndrome Network, Brower RG, Matthay MA, Morris A,
Schoenfeld D, et al. Ventilation with lower tidal volumes as compared with
traditional tidal volumes for acute lung injury and the acute respiratory
distress syndrome. N Engl J Med 2000; 342(18): 1301-1308. https://doi.org/10.1056/NEJM200005043421801
8.
Nuckton
TJ, Alonso JA, Kallet RH, et al. Pulmonary dead-space fraction as a risk factor
for death in the acute respiratory distress syndrome. N Engl J Med 2002;
346(17): 1281-1286. https://doi.org/10.1056/NEJMoa012835
9.
Amato MB,
Meade MO, Slutsky AS, et al. Driving pressure and survival in the acute
respiratory distress syndrome. N Engl J Med 2015; 372(8): 747-755. https://doi.org/10.1056/NEJMsa1410639
10.
Tonetti
T, Vasques F, Rapetti F, et al. Driving pressure and mechanical power: new
targets for VILI prevention. Ann Transl Med 2017; 5(14): 286. https://doi.org/10.21037/atm.2017.07.08
11. Gattinoni L, Carlesso E, Cressoni M. Selecting the ‘right’ positive
end-expiratory pressure level. Curr Opin Crit Care 2015; 21(1): 50-57. https://doi.org/10.1097/MCC.0000000000000166
12.
Esteban
A, Frutos-Vivar F, Muriel A, et al. Evolution
of mortality over time in patients receiving mechanical ventilation. Am J
Respir Crit Care Med 2013; 188(2): 220-230. https://doi.org/10.1164/rccm.201212-2169OC
13.
Bellani
G, Laffey JG, Pham T, et al; LUNG SAFE Investigators; ESICM Trials Group.
Epidemiology, patterns of care, and mortality for patients with acute
respiratory distress syndrome in Intensive Care Units in 50 countries. JAMA
2016; 315(8): 788-800. https://doi.org/10.1001/jama.2016.0291
14.
Bernard
GR, Artigas A, Brigham KL, et al. The American-European Consensus Conference on
ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial
coordination. Am J Respir Crit Care Med 1994; 149(3 Pt 1): 818-824. https://doi.org/10.1164/ajrccm.149.3.7509706
15.
ARDS
Definition Task Force, Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, et
al. Acute respiratory distress syndrome: the Berlin Definition. JAMA 2012;
307(23): 2526-2533. https://doi.org/10.1001/jama.2012.5669
16.
AARC
Clinical Practice Guideline. Patient-ventilator system checks. American
Association for Respiratory Care. Respir Care 1992; 37(8): 882-886. PMID: 10145778
17.
Branson
RD. Monitoring ventilator function. Crit Care Clin 1995; 11(1): 127-143. PMID: 7736264
18.
Kallet
RH, Corral W, Silverman HJ, Luce JM. Implementation of a low tidal volume
ventilation protocol for patients with acute lung injury or acute respiratory
distress syndrome. Respir Care 2001; 46(10): 1024-1037. PMID: 11572755
19. Operator’s Manual Addendum: Software Enhancements. [Internet].
[Consulta: 20 octubre, 2022]. Disponible en: https://www.medtronic.com/content/dam/covidien/library/us/en/product/acute-care-ventilation/PB840_Technical_Reference_Manual_EN_10067720D00.pdf
20.
Plotnikow
GA, Accoce M, Navarro E, Tiribelli N. Humidification and heating of inhaled gas
in patients with artificial airway. A narrative review. Rev Bras Ter Intensiva
2018; 30(1): 86-97. https://doi.org/10.5935/0103-507x.20180015
21.
Hinkson
CR, Benson MS, Stephens LM, Deem S. The effects of apparatus dead space on
P(aCO2) in patients receiving lung-protective ventilation. Respir Care 2006;
51(10): 1140-1144. PMID: 17005059
22.
Prin S,
Chergui K, Augarde R, et al. Ability and safety of a heated humidifier to
control hypercapnic acidosis in severe ARDS. Intensive Care Med 2002; 28(12):
1756-1760. https://doi.org/10.1007/s00134-002-1520-2
23.
Prat G,
Renault A, Tonnelier JM, et al. Influence of the humidification device during
acute respiratory distress syndrome. Intensive Care Med 2003; 29(12):
2211-2215. https://doi.org/10.1007/s00134-003-1926-5
24.
Branson
RD. Humidification of respired gases during mechanical ventilation: mechanical
considerations. Respir Care Clin N Am 2006; 12(2): 253-261. https://doi.org/10.1016/j.rcc.2006.03.011
25.
Thiessen
RJ. The impact of severe acute respiratory syndrome on the use of and
requirements for filters in Canada. Respir Care Clin N Am 2006; 12(2): 287-306.
https://doi.org/10.1016/j.rcc.2006.03.003
26. Fredes S,
Gogniat E, Plotnikow G, Rodrigues-La Moglie R. Utilización de filtros bacterianos/virales durante
ventilación mecánica invasiva. Medicina Intensiva 2013; 30(1). Disponible
en: https://revista.sati.org.ar/index.php/MI/article/view/340/286
27.
American
Association for Respiratory Care. AARC Clinical Practice Guidelines.
Endotracheal suctioning of mechanically ventilated patients with artificial
airways 2010. Respir Care 2010; 55(6): 758-764. PMID: 20507660
28.
Maggiore
SM, Lellouche F, Pigeot J, et al. Prevention of endotracheal suctioning-induced
alveolar derecruitment in acute lung injury. Am J Respir Crit Care Med 2003;
167(9): 1215-1224. https://doi.org/10.1164/rccm.200203-195OC
29.
Nasa
P, Azoulay E, Khanna AK, et al. Expert
consensus statements for the management of COVID-19-related acute respiratory
failure using a Delphi method. Crit Care 2021; 25(1): 106. https://doi.org/10.1186/s13054-021-03491-y
30.
Imbriaco
G, Monesi A. Closed tracheal suctioning systems in the era of COVID-19: is it
time to consider them as a gold standard? J Infect Prev 2021; 22(1): 44-45. https://doi.org/10.1177/1757177420963775
31.
Caramez
MP, Schettino G, Suchodolski K, et al. The impact of endotracheal suctioning on
gas exchange and hemodynamics during lung-protective ventilation in acute
respiratory distress syndrome. Respir Care 2006; 51(5): 497-502. PMID: 16638159
32.
Lellouche
F, Delorme M, Brochard L. Impact of respiratory rate and dead space in the
current era of lung protective mechanical ventilation. Chest 2020; 158(1):
45-47. https://doi.org/10.1016/j.chest.2020.02.033
33.
Brower
RG, Lanken PN, MacIntyre N, et al; National Heart, Lung, and Blood Institute
ARDS Clinical Trials Network. Higher versus lower positive end-expiratory
pressures in patients with the acute respiratory distress syndrome. N Engl J
Med 2004; 351(4): 327-336. https://doi.org/10.1056/NEJMoa032193
34.
Mercat A,
Richard JC, Vielle B, et al; Expiratory Pressure (Express) Study Group.
Positive end-expiratory pressure setting in adults with acute lung injury and
acute respiratory distress syndrome: a randomized controlled trial. JAMA 2008;
299(6): 646-655. https://doi.org/10.1001/jama.299.6.646
35.
Writing
Group for the Alveolar Recruitment for Acute Respiratory Distress Syndrome
Trial (ART) Investigators, Cavalcanti AB, Suzumura ÉA, Laranjeira LN, et al. Effect of lung recruitment and titrated
positive end-expiratory pressure (PEEP) vs low PEEP on mortality in patients
with acute respiratory distress syndrome: A randomized clinical trial. JAMA
2017; 318(14): 1335-1345. https://doi.org/10.1001/jama.2017.14171
36.
Constantin
JM, Jabaudon M, Lefrant JY, et al; AZUREA Network. Personalised mechanical
ventilation tailored to lung morphology versus low positive end-expiratory
pressure for patients with acute respiratory distress syndrome in France (the
LIVE study): a multicentre, single-blind, randomised controlled trial. Lancet
Respir Med 2019; 7(10): 870-880. https://doi.org/10.1016/S2213-2600(19)30138-9
37.
Amato MB,
Barbas CS, Medeiros DM, et al. Effect of a protective-ventilation strategy on
mortality in the acute respiratory distress syndrome. N Engl J Med 1998;
338(6): 347-354. https://doi.org/10.1056/NEJM199802053380602
38.
Meade MO,
Cook DJ, Guyatt GH, et al; Lung Open Ventilation Study Investigators.
Ventilation strategy using low tidal volumes, recruitment maneuvers, and high
positive end-expiratory pressure for acute lung injury and acute respiratory
distress syndrome: a randomized controlled trial. JAMA 2008; 299(6): 637-645. https://doi.org/10.1001/jama.299.6.637
39.
Kacmarek
RM, Villar J, Sulemanji D, et al; Open Lung Approach Network. Open lung
approach for the acute respiratory distress syndrome: A pilot, randomized
controlled trial. Crit Care Med 2016; 44(1): 32-42.
https://doi.org/10.1097/CCM.0000000000001383
40.
Hodgson
CL, Cooper DJ, Arabi Y, et al. Maximal recruitment open lung ventilation in
acute respiratory distress syndrome (PHARLAP). A phase II, multicenter
randomized controlled clinical trial. Am J Respir Crit Care Med 2019; 200(11):
1363-1372. https://doi.org/10.1164/rccm.201901-0109OC
41.
Beitler
JR, Sarge T, Banner-Goodspeed VM, et al; EPVent-2 Study Group. Effect of
titrating positive end-expiratory pressure (PEEP) with an esophageal
pressure-guided strategy vs an empirical high PEEP-Fio2 strategy on death and
days free from mechanical ventilation among patients with acute respiratory
distress syndrome: A randomized clinical trial. JAMA 2019; 321(9): 846-857. https://doi.org/10.1001/jama.2019.0555
42.
Koh SO.
Mode of mechanical ventilation: volume controlled mode. Crit Care Clin 2007;
23(2): 161-7, viii. https://doi.org/10.1016/j.ccc.2006.11.014
43.
Mancebo
J. Assist-control ventilation. En: Tobin MJ (ed). Principles and practice of
mechanical ventilation. 3rd ed. New York: McGraw Hill Medical; 2013; p. 159-174.
44.
Kallet
RH, Campbell AR, Dicker RA, Katz JA, Mackersie RC. Work of breathing during
lung-protective ventilation in patients with acute lung injury and acute
respiratory distress syndrome: a comparison between volume and
pressure-regulated breathing modes. Respir Care 2005; 50(12): 1623-1631. PMID: 16318643
45.
Sosio S,
Bellani G. Plateau pressure during pressure control ventilation. AboutOpen
2019; 5(1): 76-77. https://doi.org/10.33393.abtpn.2019.297
46.
Akoumianaki
E, Maggiore SM, Valenza F, et al; PLUG Working Group (Acute Respiratory Failure
Section of the European Society of Intensive Care Medicine). The application of
esophageal pressure measurement in patients with respiratory failure. Am J
Respir Crit Care Med 2014; 189(5): 520-531. https://doi.org/10.1164/rccm.201312-2193CI
47.
Branson
RD, Johannigman JA. The role of ventilator graphics when setting dual-control
modes. Respir Care 2005; 50(2): 187-201. PMID: 15691391
48.
Sasidhar
M, Chatburn RL. Tidal volume variability during airway pressure release
ventilation: case summary and theoretical analysis. Respir Care 2012; 57(8):
1325-1333. https://doi.org/10.4187/respcare.01394
49.
Kallet
RH. Patient-ventilator interaction during acute lung injury, and the role of
spontaneous breathing: part 2: airway pressure release ventilation. Respir Care
2011; 56(2): 190-203; discussion 203-6. https://doi.org/10.4187/respcare.00968
50.
Zhou
Y, Jin X, Lv Y, et al. Early
application of airway pressure release ventilation may reduce the duration of
mechanical ventilation in acute respiratory distress syndrome. Intensive Care
Med 2017; 43(11): 1648-1659. https://doi.org/10.1007/s00134-017-4912-z
51.
Talmor D,
Sarge T, Malhotra A, et al. Mechanical ventilation guided by esophageal
pressure in acute lung injury. N Engl J Med 2008; 359(20): 2095-2104. https://doi.org/10.1056/NEJMoa0708638
52.
Devaquet
J, Jonson B, Niklason L, et al. Effects of inspiratory pause on CO2 elimination
and arterial PCO2 in acute lung injury. J Appl Physiol (1985) 2008; 105(6):
1944-1949. https://doi.org/10.1152/japplphysiol.90682.2008
53.
Aboab J,
Niklason L, Uttman L, Brochard L, Jonson B. Dead space and CO2
elimination related to pattern of inspiratory gas delivery in ARDS patients.
Crit Care 2012; 16(2): R39. https://doi.org/10.1186/cc11232
54.
Aguirre-Bermeo
H, Morán I, Bottiroli M, et al. End-inspiratory pause
prolongation in acute respiratory distress syndrome patients: effects on gas
exchange and mechanics. Ann Intensive Care 2016; 6(1): 81. https://doi.org/10.1186/s13613-016-0183-z
55.
Gattinoni
L, Pesenti A. The concept of “baby lung”. Intensive Care Med 2005; 31: 776-784. https://doi.org/10.1007/s00134-005-2627-z
56.
Terragni
PP, Rosboch G, Tealdi A, et al. Tidal hyperinflation during low tidal volume
ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med
2007; 175(2): 160-166. https://doi.org/10.1164/rccm.200607-915OC
57.
Yehya N,
Hodgson CL, Amato MBP, et al. Response to ventilator adjustments for predicting
acute respiratory distress syndrome mortality. Driving pressure versus
oxygenation. Ann Am Thorac Soc 2021; 18(5): 857-864. https://doi.org/10.1513/AnnalsATS.202007-862OC
58.
Goligher
EC, Costa ELV, Yarnell CJ, et al. Effect of lowering Vt on mortality in acute
respiratory distress syndrome varies with respiratory system elastance. Am J
Respir Crit Care Med 2021; 203(11): 1378-1385. https://doi.org/10.1164/rccm.202009-3536OC
59.
Barbas
CSV, Palazzo RF. Should we titrate mechanical ventilation based on driving
pressure?-yes. Ann Transl Med 2018; 6(19): 393. https://doi.org/10.21037/atm.2018.06.26
60.
Xie J,
Jin F, Pan C, et al. The effects of low tidal ventilation on lung strain
correlate with respiratory system compliance. Crit Care 2017; 21(1): 23. https://doi.org/10.1186/s13054-017-1600-x
61.
Hickling
KG, Henderson SJ, Jackson R. Low mortality associated with low volume pressure
limited ventilation with permissive hypercapnia in severe adult respiratory
distress syndrome. Intensive Care Med 1990; 16(6): 372-377. https://doi.org/10.1007/BF01735174
62.
Amato MB,
Barbas CS, Medeiros DM, et al. Beneficial effects of the “open lung approach” with low distending pressures in acute respiratory distress syndrome. A
prospective randomized study on mechanical ventilation. Am J Respir Crit Care
Med 1995; 152(6 Pt 1): 1835-1846. https://doi.org/10.1164/ajrccm.152.6.8520744
63.
Brochard
L, Roudot-Thoraval F, Roupie E, et al. Tidal volume reduction for prevention of
ventilator-induced lung injury in acute respiratory distress syndrome. The
Multicenter Trail Group on Tidal Volume reduction in ARDS. Am J Respir Crit
Care Med 1998; 158(6): 1831-1838. https://doi.org/10.1164/ajrccm.158.6.9801044
64.
Stewart
TE, Meade MO, Cook DJ, et al. Evaluation of a ventilation strategy to prevent
barotrauma in patients at high risk for acute respiratory distress syndrome.
Pressure- and Volume-Limited Ventilation Strategy Group. N Engl J Med 1998;
338(6): 355-361. https://doi.org/10.1056/NEJM199802053380603
65.
Kallet
RH, Zhuo H, Ho K, et al. Lung injury etiology and other factors influencing the
relationship between dead-space fraction and mortality in ARDS. Respir Care
2017; 62(10): 1241-1248. https://doi.org/10.4187/respcare.05589
66.
Sahetya
SK, Goligher EC, Brower RG. Fifty years of research in ARDS. Setting positive
end-expiratory pressure in acute respiratory distress syndrome. Am J Respir
Crit Care Med 2017; 195(11): 1429-1438. https://doi.org/10.1164/rccm.201610-2035CI
67.
Santa
Cruz R, Villarejo F, Irrazabal C, Ciapponi A. High versus low positive
end-expiratory pressure (PEEP) levels for mechanically ventilated adult
patients with acute lung injury and acute respiratory distress syndrome.
Cochrane Database Syst Rev 2021; 3(3): CD009098. https://doi.org/10.1002/14651858.CD009098.pub3
68. Briel M, Meade M, Mercat A, Brower RG, Talmor D,
Walter SD, et al. Higher vs lower positive end-expiratory pressure in patients
with acute lung injury and acute respiratory distress syndrome: systematic
review and meta-analysis. JAMA
2010; 303(9): 865-873. https://doi.org/10.1001/jama.2010.218
69.
Dianti J,
Tisminetzky M, Ferreyro BL, et al. Association of positive end-expiratory
pressure and lung recruitment selection strategies with mortality in acute
respiratory distress syndrome: A systematic review and network meta-analysis.
Am J Respir Crit Care Med 2022; 205(11): 1300-1310. https://doi.org/10.1164/rccm.202108-1972OC
70.
Chiumello
D, Cressoni M, Carlesso E, et al. Bedside
selection of positive end-expiratory pressure in mild, moderate, and severe
acute respiratory distress syndrome. Crit Care Med 2014; 42(2): 252-264. https://doi.org/10.1097/CCM.0b013e3182a6384f
71.
Lachmann
B. Open up the lung and keep the lung open. Intensive Care Med 1992; 18(6):
319-321. https://doi.org/10.1007/BF01694358
72.
Hess DR.
Recruitment maneuvers and PEEP titration. Respir Care 2015; 60(11): 1688-1704. https://doi.org/10.4187/respcare.04409
73.
Grieco
DL, Bongiovanni F, Dell’Anna AM,
Antonelli M. Why compliance and driving pressure may be inappropriate targets
for PEEP setting during ARDS. Crit Care 2022; 26(1): 234. https://doi.org/10.1186/s13054-022-04109-7
74.
Mojoli
F, Torriglia F, Orlando A, et al. Technical
aspects of bedside respiratory monitoring of transpulmonary pressure. Ann
Transl Med 2018; 6(19): 377. https://doi.org/10.21037/atm.2018.08.37
75.
Mojoli
F, Iotti GA, Torriglia F, et al. In vivo
calibration of esophageal pressure in the mechanically ventilated patient makes
measurements reliable. Crit Care 2016; 20: 98. https://doi.org/10.1186/s13054-016-1278-5
76.
Baedorf-Kassis
E, Loring SH, Talmor D. Should we titrate peep based on end-expiratory
transpulmonary pressure?-yes. Ann Transl Med 2018; 6(19): 390. https://doi.org/10.21037/atm.2018.06.35
77.
Gulati G,
Novero A, Loring SH, Talmor D. Pleural pressure and optimal positive
end-expiratory pressure based on esophageal pressure versus chest wall
elastance: incompatible results*. Crit Care Med 2013; 41(8):1951-1957. https://doi.org/10.1097/CCM.0b013e31828a3de5
78.
Sarge T,
Baedorf-Kassis E, Banner-Goodspeed V, et al; EPVent-2 Study Group. Effect of
esophageal pressure-guided positive end-expiratory pressure on survival from
acute respiratory distress syndrome: A risk-based and mechanistic reanalysis of
the EPVent-2 Trial. Am J Respir Crit Care Med 2021; 204(10): 1153-1163. https://doi.org/10.1164/rccm.202009-3539OC
79.
Puybasset
L, Gusman P, Muller JC, et al. Regional distribution of gas and tissue in acute
respiratory distress syndrome. III. Consequences for the effects of positive
end-expiratory pressure. CT Scan ARDS Study Group. Adult Respiratory Distress
Syndrome. Intensive Care Med 2000; 26(9): 1215-1227. https://doi.org/10.1007/s001340051340
80.
Rouby JJ,
Puybasset L, Cluzel P, et al. Regional distribution of gas and tissue in acute
respiratory distress syndrome. II. Physiological correlations and definition of
an ARDS Severity Score. CT Scan ARDS Study Group. Intensive Care Med 2000;
26(8): 1046-1056. https://doi.org/10.1007/s001340051317
81.
Grasso S,
Terragni P, Mascia L, et al. Airway pressure-time curve profile (stress index)
detects tidal recruitment/hyperinflation in experimental acute lung injury.
Crit Care Med 2004; 32(4): 1018-1027. https://doi.org/10.1097/01.ccm.0000120059.94009.ad
82.
Costa
EL, Borges JB, Melo A, et al. Bedside
estimation of recruitable alveolar collapse and hyperdistension by electrical
impedance tomography. Intensive Care Med 2009; 35(6): 1132-1137. https://doi.org/10.1007/s00134-009-1447-y
83. Gogniat E,
Ducrey M, Dianti J, et al. Dead
space analysis at different levels of positive end-expiratory pressure in acute
respiratory distress syndrome patients. J Crit Care 2018; 45: 231-238. https://doi.org/10.1016/j.jcrc.2018.01.005
84.
Chen
L, Del Sorbo L, Grieco DL, et al. Potential
for lung recruitment estimated by the recruitment-to-inflation ratio in acute
respiratory distress syndrome. A clinical trial. Am J Respir Crit Care Med
2020; 201(2): 178-187. https://doi.org/10.1164/rccm.201902-0334OC
85.
Artigas
A, Bernard GR, Carlet J, et al. The American-European Consensus Conference on
ARDS, part 2: Ventilatory, pharmacologic, supportive therapy, study design
strategies, and issues related to recovery and remodeling. Acute respiratory
distress syndrome. Am J Respir Crit Care Med 1998; 157(4 Pt 1): 1332-1347. https://doi.org/10.1164/ajrccm.157.4.ats2-98
86.
Mauri T,
Lazzeri M, Bellani G, Zanella A, Grasselli G. Respiratory mechanics to
understand ARDS and guide mechanical ventilation. Physiol Meas 2017; 38(12):
R280-H303. https://doi.org/10.1088/1361-6579/aa9052
87.
Lucangelo
U, Bernabé F, Blanch L. Respiratory mechanics derived from
signals in the ventilator circuit. Respir Care 2005; 50(1): 55-65; discussion
65-7. PMID: 15636645
88.
Hess DR.
Respiratory mechanics in mechanically ventilated patients. Respir Care 2014;
59(11): 1773-1794. https://doi.org/10.4187/respcare.03410
89.
Chen L,
Jonkman A, Pereira SM, Lu C, Brochard L. Driving pressure monitoring during
acute respiratory failure in 2020. Curr Opin Crit Care 2021; 27(3): 303-310. https://doi.org/10.1097/MCC.0000000000000827
90.
Bellani
G, Grassi A, Sosio S, et al. Driving pressure is associated with outcome during
assisted ventilation in acute respiratory distress syndrome. Anesthesiology
2019; 131(3): 594-604. https://doi.org/10.1097/ALN.0000000000002846
91.
Grasso S,
Terragni P, Birocco A, et al. ECMO criteria for influenza A (H1N1)-associated
ARDS: role of transpulmonary pressure. Intensive Care Med 2012; 38(3): 395-403.
https://doi.org/10.1007/s00134-012-2490-7
92.
Yoshida
T, Amato MBP, Grieco DL, et al. Esophageal
manometry and regional transpulmonary pressure in lung injury. Am J Respir Crit
Care Med 2018; 197(8): 1018-1026. https://doi.org/10.1164/rccm.201709-1806OC
93.
Pepe PE,
Marini JJ. Occult positive end-expiratory pressure in mechanically ventilated
patients with airflow obstruction: the auto-PEEP effect. Am Rev Respir Dis
1982; 126(1): 166-170. https://doi.org/10.1164/arrd.1982.126.1.166
94. Laghi F, Goyal A. Auto-PEEP in respiratory failure. Minerva
Anestesiol 2012; 78(2): 201-221. PMID: 21971439
95.
Junhasavasdikul
D, Telias I, Grieco DL, et al. Expiratory flow limitation during mechanical
ventilation. Chest 2018; 154(4): 948-962. https://doi.org/10.1016/j.chest.2018.01.046
96.
Vieillard-Baron
A, Jardin F. The issue of dynamic hyperinflation in acute respiratory distress
syndrome patients. Eur Respir J Suppl. 2003; 42: 43s-47s. https://doi.org/10.1183/09031936.03.00420703
97.
Koutsoukou
A, Bekos B, Sotiropoulou C, et al. Effects of positive end-expiratory pressure
on gas exchange and expiratory flow limitation in adult respiratory distress
syndrome. Crit Care Med 2002; 30(9): 1941-1949. https://doi.org/10.1097/00003246-200209000-00001
98.
Rossi A,
Polese G, Brandi G, Conti G. Intrinsic positive end-expiratory pressure
(PEEPi). Intensive Care Med 1995; 21(6): 522-536. https://doi.org/10.1007/BF01706208
99.
Kallet
RH, Katz JA. Respiratory system mechanics in acute respiratory distress
syndrome. Respir Care Clin N Am 2003; 9(3): 297-319. https://doi.org/10.1016/s1078-5337(03)00040-6
100. Estenssoro
E, Dubin A, Laffaire E, et al. Incidence,
clinical course, and outcome in 217 patients with acute respiratory distress
syndrome. Crit Care Med 2002; 30(11): 2450-2456. https://doi.org/10.1097/00003246-200211000-00008
101. Guérin C,
Papazian L, Reignier J, et al; investigators of the Acurasys and Proseva
trials. Effect of driving pressure on mortality in ARDS patients during lung
protective mechanical ventilation in two randomized controlled trials. Crit
Care 2016; 20(1): 384. https://doi.org/10.1186/s13054-016-1556-2
102. Urner M, Jüni P,
Hansen B, et al. Time-varying intensity of mechanical ventilation and mortality
in patients with acute respiratory failure: a registry-based, prospective
cohort study. Lancet Respir Med 2020; 8(9): 905-913. https://doi.org/10.1016/S2213-2600(20)30325-8
103. Villar J, Martín-Rodríguez C, Domínguez-Berrot
AM, et al; Spanish Initiative for Epidemiology, Stratification and Therapies
for ARDS (SIESTA) Investigators Network. A quantile analysis of plateau and
driving pressures: Effects on mortality in patients with acute respiratory
distress syndrome receiving lung-protective ventilation. Crit Care Med 2017;
45(5): 843-850. https://doi.org/10.1097/CCM.0000000000002330
104. Chen L, Grieco DL, Beloncle F, et al. Partition of
respiratory mechanics in patients with acute respiratory distress syndrome and
association with outcome: a multicentre clinical study. Intensive Care Med
2022; 48(7): 888-898. https://doi.org/10.1007/s00134-022-06724-y
105. Gattinoni L, Tonetti T, Cressoni M, et al.
Ventilator-related causes of lung injury: the mechanical power. Intensive Care
Med 2016; 42(10): 1567-1575. https://doi.org/10.1007/s00134-016-4505-2
106. Costa ELV, Slutsky AS, Brochard LJ, et al. Ventilatory
variables and mechanical power in patients with acute respiratory distress
syndrome. Am J Respir Crit Care Med 2021; 204(3): 303-311. https://doi.org/10.1164/rccm.202009-3467OC
107. de Wit M, Miller KB, Green DA, Ostman HE, Gennings C,
Epstein SK. Ineffective triggering predicts increased duration of mechanical
ventilation. Crit Care Med 2009; 37(10): 2740-2745. https://doi.org/10.1097/ccm.0b013e3181a98a05
108. Blanch L, Villagra A, Sales B, et al. Asynchronies
during mechanical ventilation are associated with mortality. Intensive Care Med
2015; 41(4): 633-641. https://doi.org/10.1007/s00134-015-3692-6
109. Vaporidi
K, Babalis D, Chytas A, et al. Clusters
of ineffective efforts during mechanical ventilation: impact on outcome.
Intensive Care Med 2017; 43(2): 184-191. https://doi.org/10.1007/s00134-016-4593-z
110. Papazian L, Forel JM, Gacouin A, et al; ACURASYS Study
Investigators. Neuromuscular blockers in early acute respiratory distress
syndrome. N Engl J Med 2010;363(12):1107-16. https://doi.org/10.1056/NEJMoa1005372
111. Kallet RH, Luce JM. Detection of patient-ventilator
asynchrony during low tidal volume ventilation, using ventilator waveform
graphics. Respir Care 2002; 47(2): 183-185. PMID: 11878247
112. Mellado
Artigas R, Damiani LF, Piraino T, et al. Reverse triggering dyssynchrony 24 h after initiation of mechanical
ventilation. Anesthesiology 2021; 134(5): 760-769. https://doi.org/10.1097/ALN.0000000000003726
113. Akoumianaki
E, Lyazidi A, Rey N, et al. Mechanical
ventilation-induced reverse-triggered breaths: a frequently unrecognized form
of neuromechanical coupling. Chest 2013; 143(4): 927-938. https://doi.org/10.1378/chest.12-1817
114. Rodriguez
PO, Tiribelli N, Fredes S, et al; Grupo Argentino de Estudio de Asincronías en la Ventilación Mecánica Study
Group. Prevalence of reverse triggering in early ARDS:
Results from a multicenter observational study. Chest 2021; 159(1): 186-195. https://doi.org/10.1016/j.chest.2020.08.018
115. Pohlman MC, McCallister KE, Schweickert WD, et al.
Excessive tidal volume from breath stacking during lung-protective ventilation
for acute lung injury. Crit Care Med 2008; 36(11): 3019-3023. https://doi.org/10.1097/CCM.0b013e31818b308b
116. Beitler JR, Sands SA, Loring SH, et al. Quantifying
unintended exposure to high tidal volumes from breath stacking dyssynchrony in
ARDS: the BREATHE criteria. Intensive Care Med 2016; 42(9): 1427-1436. https://doi.org/10.1007/s00134-016-4423-3
117. Pham T, Montanya J, Telias I, et al; BEARDS study
investigators. Automated detection and quantification of reverse triggering
effort under mechanical ventilation. Crit Care 2021; 25(1): 60. https://doi.org/10.1186/s13054-020-03387-3
118. Telias I, Beitler JR. Reverse triggering, the rhythm
dyssynchrony: Potential implications for lung and diaphragm protection. Am J
Respir Crit Care Med 2021; 203(1): 5-6. https://doi.org/10.1164/rccm.202008-3172ED
119. Yoshida T, Nakamura MAM, Morais CCA, Amato MBP,
Kavanagh BP. Reverse triggering causes an injurious inflation pattern during
mechanical ventilation. Am J Respir Crit Care Med 2018; 198(8): 1096-1099. https://doi.org/10.1164/rccm.201804-0649LE
120. Mireles-Cabodevila
E, Siuba MT, Chatburn RL. A
taxonomy for patient-ventilator interactions and a method to read ventilator
waveforms. Respir Care 2022; 67(1) :29-148. https://doi.org/10.4187/respcare.09316
121. Liao KM, Ou CY, Chen CW. Classifying different types
of double triggering based on airway pressure and flow deflection in
mechanically ventilated patients. Respir Care 2011; 56(4): 460-466. https://doi.org/10.4187/respcare.00731
122. Kallet RH, Campbell AR, Dicker RA, Katz JA, Mackersie
RC. Effects of tidal volume on work of breathing during lung-protective
ventilation in patients with acute lung injury and acute respiratory distress
syndrome. Crit Care Med 2006; 34(1): 8-14. https://doi.org/10.1097/01.ccm.0000194538.32158.af
123. Kacmarek RM. Lung protection: the cost in some is
increased work of breathing. Is it too high? Respir Care 2005; 50(12):
1614-1616. PMID: 16318639
124. Guérin C,
Reignier J, Richard JC, et al; PROSEVA Study Group. Prone positioning in severe
acute respiratory distress syndrome. N Engl J Med 2013; 368(23): 2159-2168. https://doi.org/10.1056/NEJMoa1214103
125. Brodie D, Bacchetta M. Extracorporeal membrane
oxygenation for ARDS in adults. N Engl J Med 2011; 365(20): 1905-1914. https://doi.org/10.1056/NEJMct1103720