Infarto agudo de miocardio después de la ablación por radiofrecuencia
en un paciente con síndrome de Wolff-Parkinson-White. A propósito de
un caso clínico
[Acute myocardial infarction after radiofrequency ablation in a patient
with Wolff-Parkinson-White syndrome. Case report]
Pedro Taffarel,a* Karina Vallone,a Sebastián
Maldonadob
a Servicio de Terapia Intensiva, Fundación Hospitalaria, Ciudad Autónoma
de Buenos Aires, Argentina
b Servicio de Electrofisiología, Fundación Hospitalaria, Ciudad Autónoma
de Buenos Aires, Argentina
* Correspondencia: pedrotaffarel@hotmail.com
Los
autores no declaran conflictos de intereses.
Resumen
La ablación con radiofrecuencia es un tratamiento eficaz para
pacientes con síndrome de Wolff-Parkinson-White. La tasa de complicaciones es
baja y el infarto agudo de miocardio es un desenlace infrecuente. Comunicamos
el caso de un paciente de 10 años con diagnóstico de síndrome de
Wolff-Parkinson-White que fue sometido a una ablación por radiofrecuencia y
que, luego de ingresar en la Unidad de Terapia Intensiva, tuvo precordialgia y
supradesnivel del ST en electrocardiograma; progresó con aumento de enzimas
cardíacas y compromiso de la función ventricular izquierda, según el ecocardiograma.
La angiografía reveló una oclusión en la arteria descendente posterior. Se
indicó la administración de nitroglicerina, anticoagulación con heparina,
antiagregación con ácido acetilsalicílico y betabloqueantes. El paciente tuvo
una buena evolución y fue dado de alta el día 5, con persistencia de una onda T
invertida en el electrocardiograma, e hipomotilidad en la pared posterior del
ventrículo izquierdo y discinesia septal en el ecocardiograma.
Palabras clave: Arritmias cardíacas; ablación por
radiofrecuencia; infarto de miocardio.
Abstract
Radiofrequency catheter ablation (RFA) has been shown to be effective in
the treatment of patients with Wolff-Parkinson-White (WPW) syndrome with a low
rate of complications, being the acute myocardial infarction (AMI) an uncommon
outcome. We report the case of a 10-year-old patient diagnosed with WPW who
underwent radiofrequency ablation, and who after arriving at the intensive care
unit presented precordialgia, ST-segment elevation on the electrocardiogram;
progressing with an increase in cardiac enzymes and left ventricular function
involvement on the echocardiography. An angiography was performed that revealed
occlusion in the posterior descending artery. Medical treatment was instituted
(nitroglycerin, anticoagulation with heparin, antiplatelet therapy with
acetylsalicylic acid, and beta-blockers).The patient progressed well, being
discharged on day 5, with an inverted T wave persisting on the
electrocardiogram, and hypomotility in the left ventricular posterior wall and
septal dyskinesia on the echocardiogram.
Keywords: Cardiac arrhythmias; radiofrequency
ablation; myocardial infarction.
Introducción
El infarto
agudo de miocardio (IAM) es una condición clínica que se desarrolla asociada
con una reducción o interrupción repentina del flujo sanguíneo en los vasos que
irrigan el corazón. Los criterios diagnósticos electrocardiográficos,
ecocardiográficos y enzimáticos de IAM están bien definidos en los adultos.1 El IAM es infrecuente en el ámbito
pediátrico, se asocia a una cardiopatía congénita, y sus causas más frecuentes
son el origen anómalo de la arteria coronaria izquierda en la arteria pulmonar
y la enfermedad de Kawasaki. Además, las enfermedades protrombóticas
congénitas, las vasculitis y los procedimientos quirúrgicos o intervencionistas
también pueden causar isquemia e infarto.1,2
Se ha
demostrado que la ablación por radiofrecuencia es eficaz en el tratamiento de
pacientes con síndrome de Wolff-Parkinson-White (WPW), la tasa de
complicaciones es baja,3,4 y
el IAM es un desenlace infrecuente.5,6
Presentamos
el caso de un paciente con diagnóstico de síndrome de WPW que sufrió un IAM
después de la ablación por radiofrecuencia y tuvo una respuesta favorable al
tratamiento farmacológico.
Caso clínico
Varón de 10
años de edad, previamente sano, con síndrome de WPW diagnosticado en un control
de rutina, que se internó para
un procedimiento terapéutico programado. Fue sometido a un estudio
electrofisiológico con mapeo 3D y ablación del síndrome de WPW posteroseptal
derecho en la vena posterior del seno coronario, mediante la aplicación de
radiofrecuencia que alcanzó 20 W y 65 °C durante 60 segundos, con una segunda consolidación
de igual duración. El procedimiento fue exitoso.
El paciente
clínicamente estable fue trasladado a la Unidad de Terapia Intensiva
Pediátrica. A los pocos minutos de ingresar, tuvo precordialgia de intensidad
creciente, que se irradiaba al dorso, asociada a sudoración, bradicardia y
ligera hipotensión. Se optimizó la volemia, se trató el dolor con agentes opioides
y antinflamatorios no esteroides a dosis habituales, y se realizó un electrocardiograma que fue
compatible con IAM (supradesnivel del segmento ST; Figura 1). La angiografía
reveló una oclusión en la arteria descendente posterior; la intervención
percutánea no era posible dado el limitado calibre del vaso afectado. Se indicó
nitroglicerina a 6 µg/kg/min,
anticoagulación con heparina a 10 U/kg/h, antiagregación con ácido
acetilsalicílico y atenolol 1 mg/kg/día, que se mantuvo por 48 horas. Se
realizaron análisis seriados de enzimas cardíacas que arrojaron valores iniciales
normales y alcanzaron un valor máximo a las 24 h del evento (Figura 2), y
electrocardiogramas que mostraron la consolidación del IAM y su progresión
(Figura 1). El ecocardiograma complementario no reveló daño alguno inmediato al
evento. Este estudio se repitió a las 72 h y se observó la lesión consolidada
(ventrículo izquierdo con hipomotilidad en la pared posterior y discinesia septal).
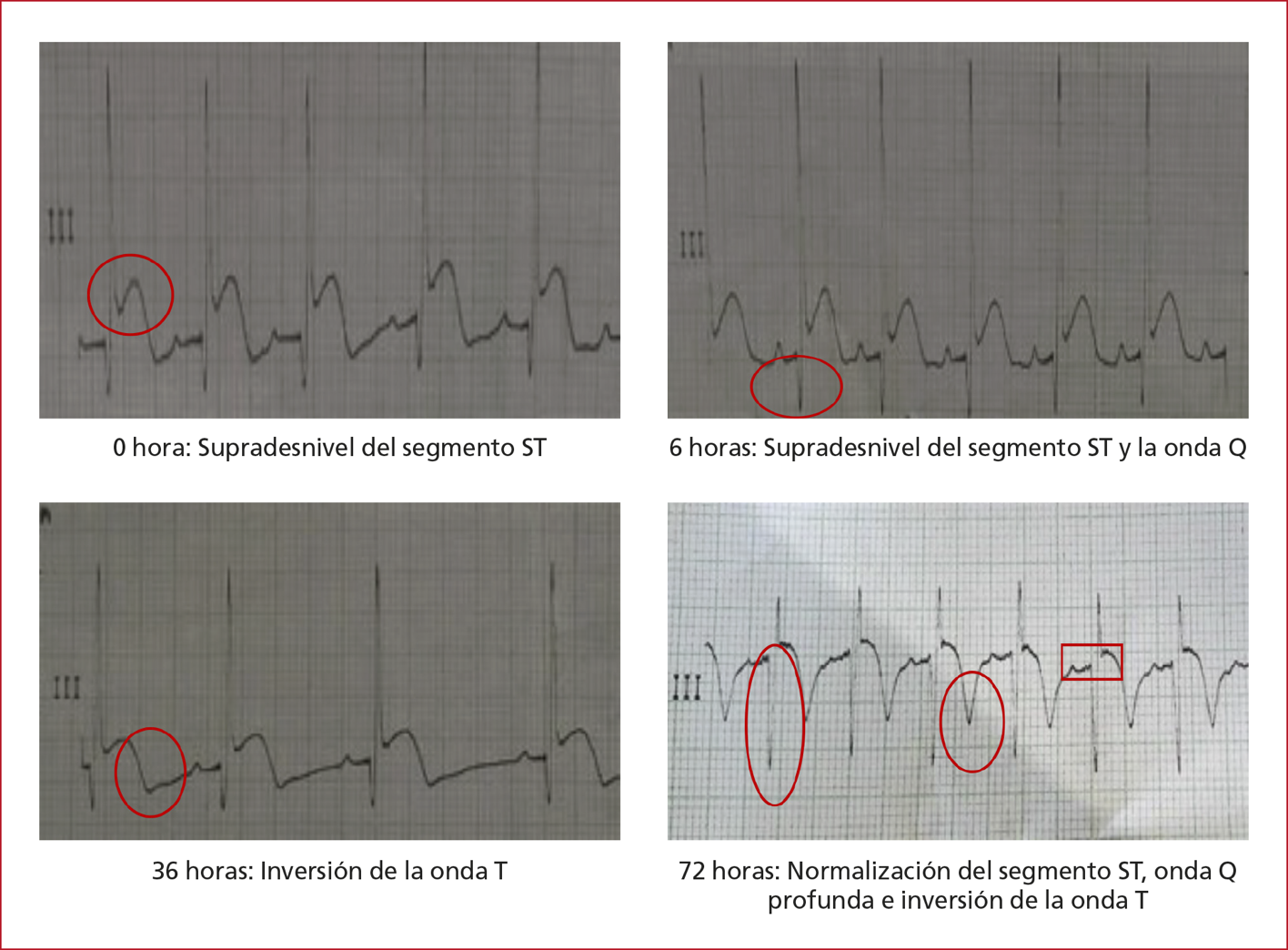
Figura 1. Progresión del electrocardiograma.
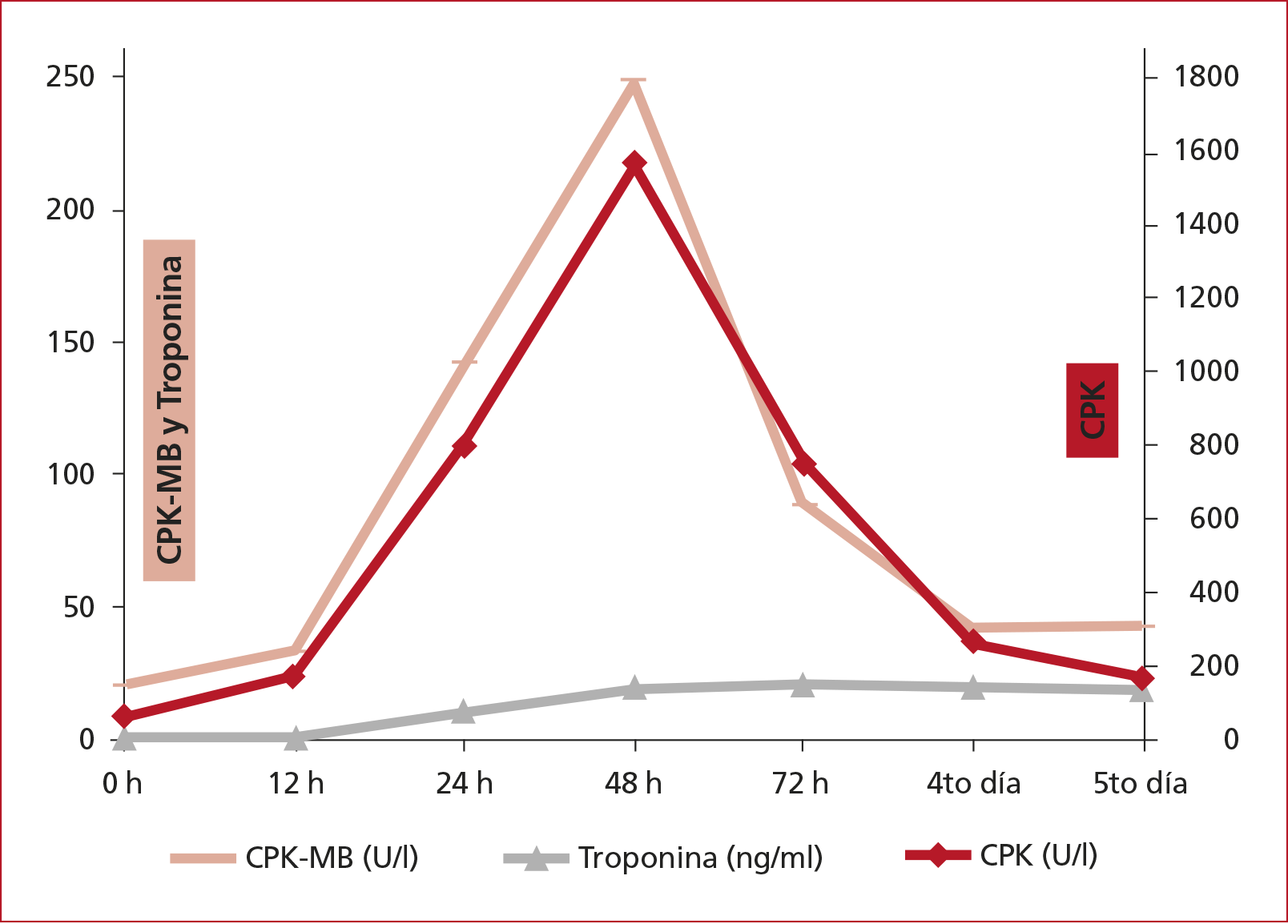
Figura 2.
Progresión de las enzimas cardíacas.
CPK =
creatinfosfoquinasa
La evolución
clínica de paciente fue buena, se le otorgó el alta hospitalaria al día 5, bajo
tratamiento con enalapril 0,1 mg/kg/día, atenolol 1 mg/kg/día y antiagregación plaquetaria con ácido
acetilsalicílico 100
mg/día.
En el
seguimiento ambulatorio por Cardiología, la resonancia magnética a los 7 meses
del evento mostró la remodelación miocárdica que reflejaba la dilatación de
ventrículos derecho e izquierdo (puntaje Z 2,4 y 5, respectivamente), con
alteración de la motilidad y fibrosis/necrosis transmural a nivel
inferoposterolateral del ventrículo izquierdo, con fracción de eyección del
35%. La evaluación se complementó con una coronariografía por tomografía axial
computarizada que no mostró obstrucción o estenosis del lecho vascular. En el
último ecocardiograma, a los 10 meses del evento, se halló una miocardiopatía
dilatada con deterioro de la función sistólica, secuela de isquemia.
En la
actualidad, el paciente se encuentra asintomático, clase I de la escala de la
New York Heart Association, y recibe tratamiento con dapagliflozina, valsartán-sacubitrilo, bisoprolol y
espironolactona.
Discusión
La ablación
por radiofrecuencia se considera una terapéutica eficaz en pacientes con
síndrome de WPW. En 2015, la American Heart Association la recomendó como
terapia de primera línea para pacientes sintomáticos con síndrome de WPW,7 mientras que la European Heart Rhythm Association
recomienda la ablación para pacientes asintomáticos con síndrome de WPW
cuya vía accesoria tenga características de alto riesgo, incluidos
pacientes jóvenes, con múltiples vías accesorias, taquicardia por
reentrada auriculoventricular inducible y período refractario
efectivo de la vía de <240 msegundos.8 En Pediatría, la tasa de éxito de la ablación por
radiofrecuencia oscila entre el 92% y el 100%, y la tasa de complicaciones es
baja.9
En un
reciente metanálisis que incluyó 11 estudios y 5537 pacientes con síndrome de
WPW expuestos a ablación por radiofrecuencia, la tasa de complicaciones fue del
1%.3 La mayoría de estas complicaciones se
consideran menores, así lo refleja el análisis de 1021 procedimientos
realizados en 887 pacientes con cardiopatías congénitas; en el 32,7% de los
casos (n = 287), el motivo de la ablación fue el síndrome de WPW y cinco
sufrieron complicaciones graves, uno de ellos tuvo un IAM.5
En un
análisis que incluyó a centros pediátricos de Europa, se evaluó a 683 pacientes
sometidos a ablación, el 55,7% de ellos tenía diagnóstico de síndrome de WPW.
El 0,7% (n = 5) sufrió complicaciones mayores: hubo dos casos de estrechamiento
transitorio de la arteria coronaria circunfleja debido a una lesión térmica
después de la ablación por radiofrecuencia de las vías auriculoventriculares
accesorias en una ubicación posteroseptal derecha.6
Como lo
reflejan los anteriores reportes, el IAM posablación es poco frecuente, y los
mecanismos que subyacen no se conocen completamente. Puede estar relacionado
con la intensidad y la duración de la radiofrecuencia (lesión directa por
necrosis). La incidencia de lesión de las arterias coronarias es baja (0,09%),
el IAM se atribuye a la proximidad de las lesiones de radiofrecuencia a la
arteria coronaria, especialmente en la región posteroseptal y el seno
coronario.10
La energía de
radiofrecuencia puede provocar espasmo coronario, traumatismo vascular directo
y lesiones endoteliales que conducen al tromboembolismo agudo o
subagudo. Se cree que el espasmo es el mecanismo más común de lesión
coronaria, como consecuencia del aumento de la actividad autonómica en las
terminaciones nerviosas en la aurícula izquierda, inducido por la
radiofrecuencia.11 Incluso el espasmo de la arteria coronaria puede ser
secundario a la ablación por radiofrecuencia, sin expresión clínica, tal como
lo documentan Schneider et al,12 quienes realizaron angiografías
coronarias a 212 pacientes con diagnóstico de taquicardia supraventricular
(mediana de 12 años de edad) antes y 30 min después de la ablación por
radiofrecuencia, y observaron el estrechamiento de la arteria coronaria adyacente
al sitio de radiofrecuencia en 2 de 117 pacientes con una vía accesoria. Ambos
tenían cambios en el segmento ST (con normalización del electrocardiograma en
una semana), estaban asintomáticos y su ecocardiografía bidimensional era
normal.
El IAM en
niños es anecdótico, su diagnóstico requiere de una alta sospecha clínica,
junto al análisis e interpretación del electrocardiograma. En pacientes
pediátricos, ante cambios del electrocardiograma en una derivación, se
presupone un IAM. La observación de más de uno de estos cambios, como elevación
del segmento ST, cambios en la onda Q, depresión del segmento ST o inversión de
la onda T, debería sugerir, con más fuerza, el diagnóstico de IAM,13 y la angiografía es el método
diagnóstico de certeza.14
El
tratamiento del IAM en Pediatría se ha adaptado del indicado para adultos e
incluye: agentes fibrinolíticos, anticoagulantes, antiagregantes y
betabloqueantes.1 En nuestro paciente, el tratamiento fibrinolítico no
fue considerado como una opción terapéutica por parte del equipo tratante,
sopesando los riesgos y beneficios de dicha intervención.
No existen
ensayos clínicos ni recomendaciones específicas sobre la dosificación de
la terapia trombolítica para el tratamiento del IAM en
Pediatría, solo informes sobre su uso para tratar el
IAM en niños con enfermedad de Kawasaki.15
Presentamos
un caso clínico con un cuadro de incidencia infrecuente en el ámbito
pediátrico, secundario a un procedimiento considerado seguro, y aquí radica la
importancia de este artículo que tiene como fin de familiarizar al lector con
dicha eventualidad, su clínica de presentación, los exámenes y estudios
complementarios que solicitar (electrocardiograma, enzimas cardíacas,
ecocardiograma), tendientes a lograr un diagnóstico precoz e indicar el
tratamiento eficaz y oportuno.
Nuestro
paciente tuvo una buena evolución clínica después del evento; a mediano plazo
(7 meses), evolucionó con dilatación biventricular y deterioro de la función
sistólica del ventrículo izquierdo, consecuencia del IAM.
Conclusión
La ablación
por radiofrecuencia se considera un procedimiento seguro y el IAM es una rara
eventualidad. La sospecha clínica, el diagnóstico precoz y el tratamiento
eficaz son indispensables para una buena evolución.
Bibliografía
1.
Bilici M,
Ture M, Balik H. Myocardial infarction in children. Myocardial Infarction.
Intech Open 2019. https://doi.org/10.5772/intechopen.74793
2.
Bassareo
PP, O’Brien ST, Dunne E, Duignan S, Martino E, Martino F, et
al. Should we be screening for ischaemic heart disease earlier in childhood? Children (Basel) 2022; 9(7): 982. https://doi.org/10.3390/children9070982
3.
Ibrahim
Ali Sherdia AF, Abdelaal SA, Hasan MT, Elsayed E, Mare’y M, Nawar AA, et al.
The success rate of radiofrequency catheter ablation in
Wolff-Parkinson-White-syndrome patients: A systematic review and meta-analysis. Indian Heart J 2023; 75(2): 98-107. https://doi.org/10.1016/j.ihj.2023.02.001
4.
Pappone
C, Vicedomini G, Manguso F, Saviano M, Baldi M, Pappone A, et al.
Wolff-Parkinson-White syndrome in the era of catheter ablation: insights from a
registry study of 2169 patients. Circulation 2014; 130: 811-819. https://doi.org/10.1161/CIRCULATIONAHA.114.011154
5.
Kato K,
Suzuki T, Yoshida Y, Ozaki N, Kishimoto S, Aoki H, et al. Catheter ablation in
children and patients with congenital heart disease: Review of 1021 procedures
at a high-volume single center in Japan. Heart Rhythm 2020;
17(1): 49-55. https://doi.org/10.1016/j.hrthm.2019.08.013
6.
Krause U,
Paul T, Bella PD, Gulletta S, Gebauer RA, Paech C, et al. Pediatric catheter
ablation at the beginning of the 21st century: results from the European
Multicenter Pediatric Catheter Ablation Registry ‘EUROPA’. Europace
2021; 23(3): 431-440. https://doi.org/10.1093/europace/euaa325
7.
Page RL,
Joglar JA, Caldwell MA, Calkins H, Conti JB, Deal BJ, et al. 2015 ACC/AHA/HRS
guideline for the management of adult patients with supraventricular
tachycardia: a report of the American College of Cardiology/American Heart
Association Task Force on Clinical Practice Guidelines and the Heart Rhythm
Society. Circulation 2016; 133(14): e506-e574. https://doi.org/10.1161/CIR.0000000000000311
8.
Arnar DO,
Mairesse GH, Borian G, Calki H, Chin A,
Coats A, et al. Management of asymptomatic arrhythmias: a European heart rhythm
association (EHRA) consensus document, endorsed by the heart failure
association (HFA), heart rhythm society (HRS), Asia Pacific heart rhythm
society (APHRS), cardiac arrhythmia society of Southern Africa (CASSA), and
Latin America heart rhythm society (LAHRS). Europace 2019; 21(6): 844-845. https://doi.org/10.1093/europace/euz046
9.
Cohen MI,
Triedman JK, Cannon BC, Davis AM, Drago F, Janousek J, et al. PACES/HRS expert
consensus statement on the management of the asymptomatic young patient with a
Wolff-Parkinson-White (WPW, ventricular preexcitation) electrocardiographic
pattern: developed in partnership between the Pediatric and Congenital
Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed
by the governing bodies of PACES, HRS, the American College of Cardiology
Foundation (ACCF), the American Heart Association (AHA), the American Academy
of Pediatrics (AAP), and the Canadian Heart Rhythm Society (CHRS). Heart Rhythm 2012; 9(6): 1006-1024. https://doi.org/10.1016/j.hrthm.2012.03.050
10. Zheng MF, Wang Z, Bao ZY. Myocardial injury and
pericarditis after combined left atrial and coronary sinus ablation in
Wolff-Parkinson-White syndrome: a case report. BMC Cardiovasc Disord 2020; 20(1): 18. https://doi.org/10.1186/s12872-020-01333-3
11. Castaño A,
Crawford T, Yamazaki M, Avula UMR, Kalifa J. Coronary artery pathophysiology
after radiofrequency catheter ablation: review and perspectives. Heart Rhythm
2011; 8(12): 1975-1980. https://doi.org/10.1016/j.hrthm.2011.07.006
12. Schneider HE, Kriebel T, Gravenhorst VD, Pau T.
Incidence of coronary artery injury immediately after catheter ablation for
supraventricular tachycardias in infants and children. Heart Rhythm 2009; 6(4):
461-467. https://doi.org/10.1016/j.hrthm.2009.01.029
13. Towbin JA, Bricker JT, Garson A. Electrocardiographic criteria for diagnosis of acute
myocardial infarction in childhood. Am J Cardiol 1992;69. https://doi.org/10.1016/0002-9149(92)90700-9
14. Desai A, Patel S, Book W. “Myocardial infarction” in
adolescents: do we have the correct diagnosis? Pediatr Cardiol 2005; 26(5): 627-631. https://doi.org/10.1007/s00246-004-0864-5
15. McCrindle BW, Rowley AH, Newburger JW, Burns JC,
Bolger AF, Gewitz M, et al. Diagnosis, treatment, and long-term management of
Kawasaki disease: a scientific statement for health professionals from the
American Heart Association. Circulation 2017; 135(17): e927-e999. https://doi.org/10.1161/CIR.0000000000000484