Factores de riesgo de fracaso de la
ventilación mecánica no
invasiva binivelada en niños <1 año con insuficiencia respiratoria aguda
hipoxémica
[Risk factors of failure of bilevel noninvasive
mechanical ventilation in pediatric patients under one year of age with acute
hypoxemic respiratory failure]
Julia I. Simonassi,a* María Tatiana Canzobre,a Mariela
Ricciardellib
a Servicio de kinesiología, Hospital Nacional de
Pediatría “Prof. Dr. Juan P. Garrahan”, Ciudad Autónoma de Buenos Aires, Argentina
b Servicio de kinesiología, Hospital “Teodoro J.
Schestakow”, Mendoza, Argentina
* Correspondencia:
jsimonassi@garrahan.gov.ar
Las
autoras no declaran conflictos de intereses.
Resumen
Objetivos: Describir las características de los pacientes
<1 año con insuficiencia respiratoria aguda hipoxémica (IRAH) que recibieron
ventilación mecánica no invasiva (VMNI) inicial, comparar la evolución de los
casos exitosos y fallidos e identificar posibles factores de fracaso. Pacientes y Métodos: Estudio de cohorte observacional
retrospectivo. Se incluyó a pacientes <1 año con IRAH y VMNI. Resultados: Se analizó a 176 pacientes (mediana de edad, 4
[RIC 2-7] meses; mediana de peso, 6 [RIC 5-7,7] kg), 77 tenían un cuadro
crónico complejo. El 93% tenía bronquiolitis y el resto, neumonía. Cuatro
murieron. Se evitó la intubación en 102 pacientes. El 59,5% de los fracasos se
produjo en las primeras 12 h. Los pacientes que respondieron satisfactoriamente
a la VMNI tuvieron una estancia más corta en la UCIP y hospitalaria. Los
factores de riesgo hallados fueron: inicio de los síntomas >2 días; puntaje
de Tal modificado >10 y PIM3 ≥0,6. Conclusiones: La VMNI sincronizada en pacientes <1 año
con IRAH severa es factible. La población estudiada tenía bajo peso y edad, y
alta prevalencia de cuadros crónicos complejos. La estancia en la UCIP y
hospitalaria de los pacientes con VMNI exitosa fue significativamente menor.
Los factores de riesgo de fracaso de la VMNI fueron: el tiempo de evolución de
la enfermedad, la gravedad de la IRAH al inicio de la VMNI y la severidad del
PIM3 al ingresar en la UCIP. La VMNI es un recurso útil en niños con IRAH. Se
requieren más investigaciones relacionadas con su uso y efectividad.
Palabras clave: Bronquiolitis; ventilación no invasiva; unidad
de cuidados intensivos pediátricos; insuficiencia respiratoria.
Abstract
Objectives: To describe the characteristics of infants under
one year of age diagnosed with acute hypoxemic respiratory failure (AHRF) who
received initial non-invasive ventilation (NIV); to compare the outcomes
between those who succeeded and those who failed, and identify potential
failure factors in this population. Patients and Methods: Retrospective observational cohort study. All
infants under one year of age diagnosed with AHRF requiring NIV were included. Results: A total of 176 subjects were analyzed (median age,
4 [IQR 2-7] months; median weight, 6 [IQR 5-7.7] kg, 77 had complex chronic
conditions. 93% had bronchiolitis and the rest had pneumonia. Four children
died. Intubation was avoided in 102 patients. 59.5% of failures occurred within
the first 12 hours. Patients who responded successfully to NIV had a shorter
stay in the PICU and hospital. Identified risk factors were: symptom onset
>2 days; modified Tal score >10, and a PIM3 score ≥0.6. Conclusions: The use of synchronized NIV in infants under one
year of age with AHRF is feasible. The studied population had low weight and
age, and a high prevalence of complex chronic conditions. Those patients with a
successful NIV had significantly shorter stays in the PICU and hospital. Risk
factors for NIV failure were disease progression time, severity of AHRF at the
onset of NIV, and severity in the mortality score upon admission to the PICU.
NIV is a useful resource in infants with AHRF, yet further research regarding
its usage and effectiveness is warranted.
Keywords: Bronchiolitis; non-invasive ventilation;
pediatric intensive care unit; respiratory failure.
Introducción
La
insuficiencia respiratoria aguda hipoxémica (IRAH) es el motivo más común de
ingreso hospitalario y de muerte en pacientes pediátricos <5 años.1 En los lactantes, la enfermedad más frecuente
que provoca esta insuficiencia es la bronquiolitis. En la Argentina, se
registran 250.000 casos por año, alrededor del 8% ingresa en la Unidad de
Cuidados Intensivos Pediátricos (UCIP) y la tasa de mortalidad es del 1%.2 El mecanismo por el que se produce esta
insuficiencia es un desequilibrio en la relación ventilación:perfusión, con
regiones pulmonares mal ventiladas que permanecen perfundidas a pesar de la
vasoconstricción regional inducida por la hipoxia. Se caracteriza
principalmente por obstrucción de las vías respiratorias tanto por aumento de
las secreciones bronquiales, como por episodios de broncoespasmo o edema en la
vía aérea.3 La primera línea de tratamiento de la IRAH en
pacientes pediátricos consiste en administrar oxígeno suplementario, de bajo o
alto flujo, a fin de alcanzar un nivel adecuado de saturación arterial. Sin
embargo, en los cuadros más severos, el esfuerzo muscular sostenido junto
con la hipoxemia progresiva predispone a la fatiga muscular con la consecuente
claudicación respiratoria. En estas situaciones, se recomienda colocar ventilación mecánica no invasiva
(VMNI) con el objetivo de disminuir el trabajo respiratorio a través de la
asistencia ventilatoria y evitar la intubación.4,5 Los beneficios de su implementación
por sobre la ventilación mecánica invasiva son múltiples. Principalmente se
evitan potenciales lesiones de la vía aérea, se reduce el riesgo de infecciones
asociadas a la ventilación mecánica y se administra menos sedación.6 La VMNI, además, tiene como objetivo
contrarrestar el colapso de la vía aérea superior y reducir el atrapamiento
aéreo disminuyendo la carga elástica umbral, lo que desacelera el deterioro
clínico y favorece el intercambio gaseoso.7,8 Si bien la VMNI binivelada se
utiliza ampliamente en pediatría, los lactantes con IRAH severa son el grupo
que plantea mayor dificultad en el momento de implementarla y en quienes el
éxito es menor debido a su pequeño tamaño, el alto impulso respiratorio y la
falta de colaboración, lo cual posiblemente también esté relacionado con las
características poblacionales o incluso con la gravedad de la enfermedad antes
de ingresar en la UCIP.9-11 Por lo tanto, los objetivos de nuestro estudio
fueron describir las características de los pacientes <1 año de edad, con diagnóstico de IRAH que recibieron
VMNI inicial; comparar la evolución entre los pacientes en quienes la VMNI fue
exitosa y aquellos en los que fracasó e identificar posibles factores de fracaso en esta población.
Pacientes y Métodos
Cohorte retrospectiva de una UCIP polivalente del Hospital Nacional de Pediatría “Prof. Dr. Juan P. Garrahan” de la Argentina. Se trata de una unidad mixta, médica y quirúrgica, que admite pacientes desde el primer mes de vida hasta los 18 años de edad. Los pacientes ingresan desde el Servicio de Urgencias, la Sala de Pediatría, el quirófano o desde otros hospitales. Tiene una capacidad máxima de 17 camas y recibe entre 500 y 600 pacientes por año.
Se incluyó a todos los pacientes <1 año de edad que ingresaron con diagnóstico de IRAH y requirieron VMNI entre enero de 2018 y diciembre de 2021. Se excluyó a los pacientes con traqueotomía al ingresar o con contraindicaciones para la colocación de la VMNI o si la causa de la IRAH no era bronquiolitis o neumonía. Se eliminó a aquellos que no cumplieron la evolución total de la enfermedad en la UCIP.
Los datos se obtuvieron de las fichas informatizadas del Servicio de Kinesiología y de las historias clínicas.
Oxigenoterapia de bajo y alto flujo como primera línea de tratamiento
Se utilizaron diferentes dispositivos de oxigenoterapia (bigotera, máscara de oxígeno, cánula nasal de alto flujo) según la necesidad de los pacientes, la disponibilidad y el criterio del personal de la Unidad de Emergencias (UE) o de las salas de Cuidados Intermedios. La oxigenoterapia de alto flujo a través de cánulas nasales (CNAFO2) se implementó en niños >1 mes de vida con diagnóstico de bronquiolitis, score de Tal modificado ≥7 y requerimiento de flujo de oxígeno >2 l/min por cánula nasal. Esta escala consta de cuatro componentes: frecuencia respiratoria, uso de los músculos accesorios, grado de sibilancias y SaO2 con aire ambiente. Cada componente se puntúa entre 0 y 3, lo que proporciona un puntaje total de 0 a 12. Los objetivos terapéuticos fueron la mejoría clínica según la escala de Tal modificada y mantener una SaO2 ≥94%.12 El fracaso de la oxigenoterapia de bajo flujo o de la CNAFO2 se definió como el empeoramiento del puntaje de Tal modificado según el criterio del médico tratante, junto con el inicio, en ese momento, de VMNI tanto en la UCIP como en la UE para el posterior traslado a la UCIP.
Implementación de la ventilación no invasiva
Inicialmente se utilizaron como interfaz máscaras faciales modelo PerforMax® (Respironics, Murrysville, PA, EE.UU.). Los respiradores empleados fueron equipos de categoría intermedia con turbina Dräger Carina® (Drägerwerk, Lübeck, Alemania) y los modelos Trilogy® y EV300® (Respironics, Murrysville, PA, EE.UU.). Se priorizó el uso de los últimos dos modelos para los pacientes que pesaban <10 kg según la disponibilidad en la UCIP. Todos los circuitos que se utilizaron fueron de una sola rama con puerto exhalatorio en la interfaz o a través de un conector adicional lo más próximo a esta.
La programación fue individualizada de acuerdo con los requerimientos de cada paciente y favoreciendo la sincronía paciente-respirador. La programación inicial parte de una PEEP de 7 cmH2O hasta 10 cmH2O y una presión inspiratoria de entre 5 y 12 cmH2O por encima de la PEEP hasta notar una reducción en el esfuerzo respiratorio del paciente. El tiempo inspiratorio se programó entre 0,4 y 0,5, con una frecuencia de respaldo de entre 30 y 40 respiraciones por minuto. El aporte de oxígeno se aumentó hasta alcanzar, al menos, un objetivo de SaO2 ≥94%. A todos se les colocó una sonda nasogástrica para evitar la distensión abdominal y asegurar la alimentación enteral. Con respecto al cuidado de la piel, se examinaron diariamente las zonas de apoyo de la interfaz, se limpiaron y se aplicó vitamina A. Se realizaron desconexiones diarias de 10-15 min, tres veces por día, para evitar las lesiones por decúbito y efectuar una evaluación clínica sin soporte. Con el fin de soslayar episodios de irritabilidad o agitación que empeorasen el cuadro respiratorio y la interacción con el respirador, se administró un goteo de clonidina (0,5-2 µg/kg/h) en infusión continua. Los signos vitales se controlaron mediante monitores multiparamétricos, el cálculo de la SaO2/FiO2, los signos clínicos de esfuerzo y reclutamiento de músculos accesorios, los valores y gráficos del respirador. Cuando el equipo tratante lo consideró necesario, solicitó un análisis de sangre.
Los criterios por los que se consideró suspender la VMNI y proceder con la intubación fueron los siguientes: requerimiento de oxígeno >60% por más de 24 h, sin mejoría clínica; requerimiento de aumento progresivo de los parámetros ventilatorios sin disminución de la frecuencia respiratoria y del esfuerzo; aumento de la acidosis respiratoria o hipoxemia persistente; asincronía paciente-respirador, intolerancia y agitación, apneas y signos de fatiga.
Se registraron las siguientes variables:
• Demográficas: edad (en meses), peso (en kg), sexo, mortalidad, índice de mortalidad pediátrico (Pediatric Index of Mortality 3, PIM3),13 cuadros crónicos complejos (respiratorio, neurológico, oncológico, cardiológico; otros: hepático, trastornos de la vía aérea, intestinales, metabolopatías, etc.),14 síndrome genético (síndrome de Down, otros), edad gestacional (en semanas), diagnóstico de IRAH (bronquiolitis o neumonía), días en la UCIP, días de internación hospitalaria, rescate de gérmenes (positivo, negativo), tipo de germen (virus sincicial respiratorio, adenovirus, influenza, parainfluenza, rinovirus, otro) y coinfección.
• Inicio del cuadro respiratorio y primera línea de soporte: inicio de los síntomas; si recibió CNAFO2, horas de CNAFO2, puntaje de Tal modificado al inicio de la VMNI, lugar donde se inicia la VMNI (UE o UCIP), estado ácido base (antes de comenzar la VMNI) y glóbulos blancos (antes de la VMNI).
• Evolución de la VMNI inicial: fracaso
de la VMNI (intubación orotraqueal), tiempo en el que se produce el fracaso
(Inicial 0-2 h, Precoz 2-12 h, Tardío >12 h), causa del fracaso (hipoxemia,
hipercapnia, aumento de la carga respiratoria, disminución del sensorio,
incapacidad de poder mantener permeable la vía aérea, obstrucción alta),
complicaciones asociadas con la VMNI (neumotórax, lesión cutánea,
aerofagia/distensión abdominal, intolerancia).
Análisis estadístico
Las variables cuantitativas se expresan como mediana y con sus rangos intercuartílicos (RIC) debido a que la muestra es asimétrica. Se describe la frecuencia de las variables cualitativas en porcentajes con sus correspondientes intervalos de confianza del 95%.
Se realizó un análisis univariado entre cada variable independiente y la variable dependiente “fracaso de la VMNI”. Las variables dicotómicas se introdujeron de la misma manera, las categóricas se transformaron en dummies y las continuas, en dicotómicas.
Las variables con un valor p <0,20 se introdujeron en forma manual en el modelo multivariado, permanecieron aquellas variables que mejoran su capacidad predictiva, teniendo una asociación significativa con el evento o se consideren clínicamente relevantes.
Consideraciones éticas y legales
El estudio fue aprobado por el Comité de Ética en Investigación del Hospital de Pediatría “Prof. Dr. Juan P. Garrahan” que eximió a los autores de la necesidad de solicitar el consentimiento informado por el tipo de estudio. Durante todo el proceso, se garantizó la confidencialidad de los datos y la preservación de la identidad de los pacientes, a través de la codificación numérica de la identidad de los pacientes.
Resultados
Durante el período de estudio, ingresaron 184 pacientes y se analizaron 176 (Figura). El 63% era del sexo masculino, con una mediana de edad de 4 meses (RIC 2-7) y una mediana de peso de 6 kg (RIC 5-7,7), 77 (37%) tenían un cuadro crónico complejo y 16 (9%), un síndrome genético. A 163 (93%) se les diagnosticó bronquiolitis y, al resto, neumonía. Cuatro niños (2%) murieron, dos tenían un cuadro crónico complejo de base. Los gérmenes más frecuentes fueron: virus sincicial respiratorio y adenovirus. Las características generales de la población, su evolución y comparación se muestran en la Tabla 1.
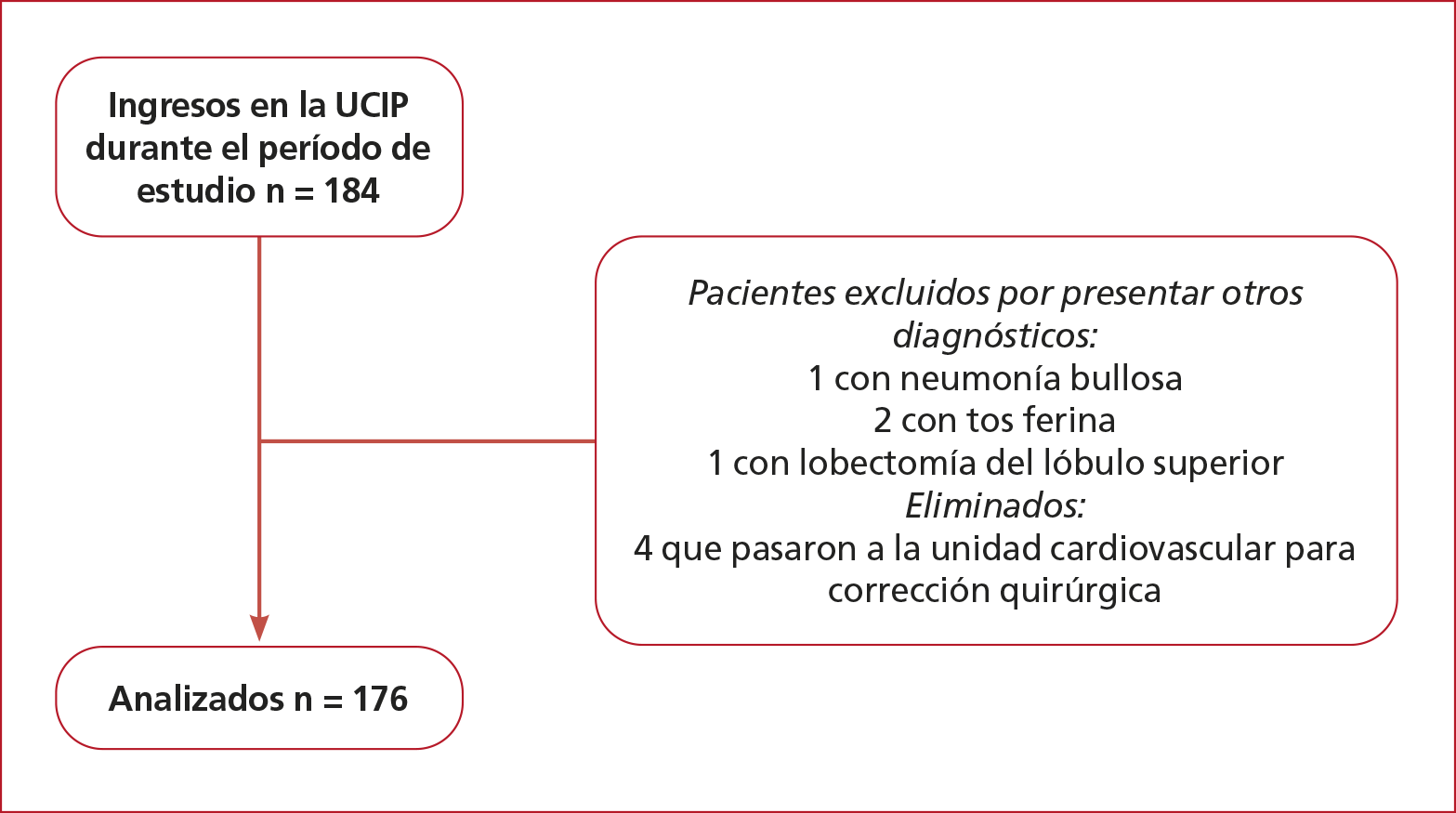
Figura. Diagrama de flujo.
UCIP = unidad de
cuidados intensivos pediátricos; CNAF = cánula nasal de alto flujo.
Tabla 1
Características de la población
|
|
Todos |
Éxito VMNI |
Fracaso VMNI |
p |
|
n |
176 |
102 |
74 |
|
|
Sexo masculino (%, IC95%) |
63 (56-70) |
59 (49-69) |
70 (58-80) |
0,17 |
|
Edad gestacional <38 semanas (%, IC95%) |
33 (26-40) |
34 (25-44) |
31 (20-42) |
0,65 |
|
Edad <6 meses (%, IC95%) |
71 (64-78) |
74 (66-83) |
66 (55-77) |
0,23 |
|
Peso <5 kg (%, IC95%) |
40 (33-48) |
38 (27-48) |
43 (32-55) |
0,50 |
|
CCC (%, IC95%) |
38 (31-45) |
34 (25-44) |
43 (32-56) |
0,22 |
|
Bronquiolitis (%, IC95%) |
93 (89-96) |
95 (91-99) |
89 (82-96) |
0,13 |
|
VSR (%, IC95%) |
56 (49-64) |
51 (41-61) |
64 (52-75) |
0,09 |
|
Adenovirus (%, IC95%) |
12 (7-18) |
8 (3-14) |
16 (8-25) |
0,13 |
|
Inicio de los síntomas >2 días (%, IC95%) |
45 (38-53) |
45 (35-56) |
72 (61-81) |
0,01 |
|
PIM3 ≥0,6 (%, IC95%) |
22 (16-28) |
37 (28-48) |
42 (30-53) |
0,1 |
|
CNAFO2 pre-VMNI (%, IC95%) |
80 (75-86) |
86 (76-91) |
77 (67-87) |
0,29 |
|
Puntaje de Tal >10 (%, IC95%) |
47 (40-55) |
40 (31-50) |
60 (70-81) |
0,01 |
|
Días de VMNI (mediana, RIC) |
2 (1-4) |
3 (2-5) |
1 (1-2) |
0,01 |
|
Días en UCIP (mediana, RIC) |
7 (5-10) |
5 (4-7) |
11 (9-14) |
0,01 |
|
Días de internación, total (mediana, RIC) |
10 (6-17) |
6 (5-9) |
16.5 (12-22) |
0,01 |
|
Mortalidad (n, %) |
4 (2) |
- |
4 (5) |
- |
|
VMNI = ventilación mecánica no invasiva;
IC95% = intervalo de confianza del 95%; CCC = cuadros crónicos complejos; VSR
= virus sincicial respiratorio; PIM3 = Pediatric Mortality Index 3; CNAFO2 = oxigenoterapia
de alto flujo a través de cánula nasal; UCIP = unidad de cuidados intensivos
pediátricos; RIC = rango intercuartílico. |
||||
El uso de CNAFO2 antes de la VMNI no se asoció con el fracaso de la VMNI. En el 77,3% (136), la VMNI se inició en la UCIP y, en el resto, en la UE, con una mediana de 2 (1-4) días de uso; se evitó la intubación en 102 (58%). Más de la mitad de los fracasos se produjeron dentro de las primeras 12 h (59,5%), y la fatiga muscular fue la causa más frecuente (76%). Se produjeron seis (3,4%) complicaciones asociadas a la VMNI (Tabla 2). El análisis de regresión logística se muestra en la Tabla 3.
Tabla 2
Uso y evolución de la ventilación mecánica no invasiva (VMNI)
|
Variables |
n = 176 |
|
Inicio de los síntomas, días, mediana (RIC) |
2 (1-3) |
|
VMNI, n (%) |
|
|
Departamento de Emergencia |
40 (23) |
|
UCIP |
136 (77) |
|
Días de uso de VMNI, mediana (RIC) |
2 (1-4) |
|
Éxito de la VMNI, n (%) |
102 (58) |
|
Tipo de fracaso, n (%) |
|
|
Inicial |
21 (28) |
|
Precoz |
23 (31) |
|
Tardío |
30 (41) |
|
Causa del fracaso, n (%) |
|
|
Hipoxemia |
5 (7) |
|
Hipercapnia |
6 (8) |
|
Aumento de la carga respiratoria |
56 (76) |
|
Disminución del sensorio |
2 (3) |
|
Mal manejo de secreciones |
1 (1) |
|
Obstrucción de la vía aérea |
1 (1) |
|
Otras |
3 (4) |
|
Complicaciones de la VMNI |
|
|
Ninguna |
170 (97) |
|
Neumotórax |
1 (0,33) |
|
Lesión de piel |
3 (2) |
|
Aerofagia |
1 (0,33) |
|
Intolerancia |
1 (0,33) |
|
VMNI = ventilación mecánica no invasiva; RIC = rango intercuartílico; UCIP = unidad de cuidados intensivos pediátricos. |
|
Tabla 3
Análisis de regresión logística para estimar los factores predictivos de fracaso en el uso de la VMNI en pacientes <1 año de vida
|
Variables |
Odds ratio |
IC95% |
p |
|
PIM3 ≥0,6 |
22 |
(5-45) |
0,001 |
|
Inicio de los síntomas >2 días |
3 |
(1,5-6) |
0,003 |
|
Puntaje de Tal >10 |
4 |
(2-8) |
0,001 |
|
VMNI = ventilación mecánica no invasiva; PIM3 = Pediatric Mortality Index 3; IC95% = intervalo de confianza del 95%. |
|||
Discusión
La VMNI binivelada se implementa con el fin de reducir el esfuerzo respiratorio provocado por la IRAH y así evitar la intubación.
En nuestro estudio, hemos hallado varios puntos que merecen destacarse. Principalmente describimos su implementación en una población <1 año de edad con IRHA grave en la que la VMNI de forma sincronizada es difícil. La evolución fue significativamente favorable en quienes la VMNI fue exitosa, en relación con los días de internación en la UCIP y en el hospital, comparada con la de aquellos en los que fracasó.
Por último, se hallaron los siguientes factores de riesgo de fracaso de la VMNI: 1) inicio de los síntomas >2 días; 2) puntaje de Tal modificado >10 y 3) PIM3 ≥0,6.
La población analizada tenía
características que se han asociado previamente con una evolución desfavorable
en pacientes con IRAH, especialmente en casos de bronquiolitis, como el bajo
peso y la edad <6 meses.4,6 El
peso es un factor determinante cuando nos proponemos realizar una ventilación
sincronizada, ya que, como mencionan Beck et al, los lactantes especialmente
cuando están agotados, tienen una frecuencia respiratoria más alta, un volumen
corriente más bajo y esfuerzos inspiratorios más débiles, lo que determina que
la sincronización con el respirador sea una tarea más compleja.15 Otro
aspecto relacionado con la población es que incluimos en nuestro análisis un
18,75% de pacientes con edad gestacional <38 semanas, un 9% con síndrome
genético y un 37% con cuadros crónicos complejos. Si bien, no se halló una
significancia estadística de estos aspectos como factores predictivos de
fracaso, consideramos que podrían actuar como agravantes durante la IRAH. Yaman
et al mencionan una alta prevalencia de cuadros crónicos complejos con una baja
tasa de fracaso, en su mayoría de origen cardíaco y neurológico.16
En nuestro estudio, la tasa de éxito del uso de la VMNI inicial fue del 58%, similar a lo publicado (48-66%) por otros autores que analizaron a niños <1 año de vida con IRAH.6,9,17 Sin embargo, este punto en particular genera un conflicto a la hora de ser analizado, ya que es notable la variabilidad de las tasas de éxito comunicadas en diferentes estudios (48-93%) con el uso de la VMNI en poblaciones pediátricas. Esta problemática podría analizarse desde dos aspectos. El principal sería desde la falta de evidencia y de guías de práctica clínica que colaboren para definir un abordaje más homogéneo de esta población y evitar que las decisiones se tomen exclusivamente sobre la base del criterio clínico y el pragmatismo.7 Por otra parte, es cuestionable desde el aspecto metodológico. Casualmente reportan un éxito mayor, aquellos estudios que incluyen, por lo general, poblaciones heterogéneas con insuficiencia respiratoria hipercápnica e hipoxémica, de amplio rango etario, sin categorizar la gravedad y, en algunos casos, también se incluyen todas las instancias de uso de la VMNI, ya sea inicial o posextubación dentro del mismo análisis.
Con respecto a la evolución, al igual
que lo publicado por Wang et al, los pacientes con una VMNI exitosa tuvieron
significativamente más días de VMNI que los que fracasaron y una estadía más
corta en la UCIP y hospitalaria, y esto se podría deber a que, como se evita la
intubación, el cuadro que lleva a requerir soporte ventilatorio se resuelve en
pocos días, el paciente recibe menos sedación y está menos expuesto a
potenciales morbilidades asociadas a la ventilación invasiva.18
La evolución de los síntomas >48 h como factor de riesgo de fracaso podría deberse a varios aspectos, como la fiebre persistente, el uso de antibióticos y las condiciones socio-económicas que posterguen el acceso a la atención sanitaria. Los niños <1 año de vida tienen una condición en común: su predisposición a desarrollar un agotamiento precoz durante la IRAH por sus características anatomofisiológicas al compararlos con otras poblaciones. Por un lado, tienen una baja capacidad residual funcional provocada por el desarrollo torácico inmaduro que se distorsiona por la alta elastancia pulmonar. Esto genera una desventaja biomecánica de los músculos que desde ya tienen una menor proporción de fibra resistentes a la fatiga. Por otra parte, se produce un aumento del componente resistivo de las vías aéreas debido a la presencia de secreciones, broncoespasmo o edema con el consecuente atrapamiento aéreo y la mayor demanda inspiratoria. Estos aspectos los hacen propensos a desarrollar rápidamente dificultad respiratoria e hipoventilación alveolar, por lo que es más dificultoso para esta población mantener una estabilidad ventilatoria en el tiempo a medida que avanza la enfermedad.1,3,19
En nuestra institución, se implementa el uso de CNAFO2 en la UE y en las salas intermedias de internación a los pacientes <2 años con IRAH. Como ya se mencionó, la evolución de los síntomas por más de 48 h es un factor de riesgo de fracaso de la VMNI, por lo que podríamos sospechar que la CNAFO2 podría retrasar la implementación de la ventilación y haría que los pacientes evolucionaran desfavorablemente. Sin embargo, el 80% de nuestros pacientes recibió CNAFO2 antes de la VMNI y no se observó una asociación estadística entre su uso antes de la VMNI y el fracaso de esta.
En esta población, se utilizan muchos puntajes de severidad durante una IRAH; sin embargo, varios autores destacaron que el puntaje de Tal modificado es una herramienta con alta fiabilidad y con validez para ser implementada tanto clínicamente como para investigación.20 Una de sus principales ventajas es que es una escala breve y que el resultado es independiente del nivel de formación y la experiencia del profesional que la utilice. Esta escala clasifica al lactante con IRAH en tres niveles.21 Del análisis multivariado un puntaje de Tal >10 fue un factor predictivo de fracaso de la VMNI en nuestra población, lo que coherentemente hace pensar que el uso de esta herramienta podría colaborar junto con la evaluación clínica a identificar pacientes que ya se encuentran en la categoría severa, con mayor riesgo de fracaso de la VMNI y, si se decidiera iniciar una prueba de VMNI, mantener una alerta mayor para el grupo tratante con el fin de no retrasar la intubación si fuera necesaria.
En varias publicaciones, se mencionan los puntajes de riesgo de mortalidad PRISM II y el PRISM III como factores predictivos de fracaso de la VMNI,6,17,22-24 pero al igual que Pons-Òdena et al, consideramos que, al ser un puntaje que se calcula con la información de las primeras 24 h en las UCIP, a los fines de determinar el riesgo de fracaso de la VMNI inicial nos aportaría información tardía; por lo tanto, en este caso, podría ser más útil el PIM3 que está validado en la población argentina y utiliza información de la primera hora en la UCIP y, en este caso, un PIM3 ≥0,6 sería un factor de riesgo de fracaso.13,25 Otros autores informaron una estrecha relación con el PIM2 y, en el estudio donde se analizaron solo los fracasos de la VMNI en una población pediátrica con IRAH, reportaron una mediana de PIM2 de 3,4; en este estudio, la mayoría de los pacientes tenía neumonías; por otro lado, un valor más bajo en nuestro estudio podría deberse a que la mayoría sufría bronquiolitis.26-28
Este estudio tiene algunas limitaciones,
como su diseño retrospectivo, de un solo centro y que no se analizaron
variables de los parámetros ventilatorios ni fisiológicas. Sin embargo,
destacamos como una fortaleza el tamaño de la muestra y el abordaje homogéneo
de los pacientes analizados. Por otro lado, la pérdida de datos inherentes al
tipo de estudio podría ser otra limitante. No obstante, los datos fueron
cargados de manera prospectiva en una base de datos, por personal altamente
entrenado, lo cual minimizó la pérdida de datos relevantes. Por último,
mencionamos un dato relevante como la carencia de un protocolo para poder
estandarizar tanto el ingreso en la VMNI como el destete o el fracaso de la
terapéutica. No obstante, los profesionales con amplia experiencia en el área
se basan tanto en las guías locales como en las recomendaciones más
actualizadas hasta el momento.11,29
Conclusiones
El uso de VMNI sincronizada en pacientes <1 año de vida con IRAH severa es factible. La población estudiada tenía bajo peso y edad, y una alta prevalencia de cuadros crónicos complejos. La permanencia en la UCIP y hospitalaria de los pacientes con VMNI exitosa fue significativamente menor. El tiempo de evolución de la enfermedad, la gravedad de la IRAH al inicio de la VMNI y la severidad del puntaje PIM3 al ingreso en la UCIP fueron factores de riesgo de fracaso de la VMNI. La VMNI es un recurso útil en los lactantes con IRAH que requiere más investigaciones relacionadas con su uso y efectividad.
Agradecimientos
A GAP por su mentoría.
Bibliografía
1.
Yañez LJ, Yunge M, Emilfork M, et al. A prospective, randomized, controlled trial of
noninvasive ventilation in pediatric acute respiratory failure. Pediatr Crit
Care Med 2008; 9(5): 484-489. https://doi.org/10.1097/PCC.0B013E318184989F
2.
Rodríguez MS. Bronchiolitis in the year of COVID-19. Arch
Argent Pediatr 2020; 118(3): 222-223. https://doi.org/10.5546/aap.2020.222
3.
Teague
WG. Noninvasive ventilation in the pediatric intensive care unit for children
with acute respiratory failure. Pediatr Pulmonol 2003; 35(6): 418-426. https://doi.org/10.1002/PPUL.10281
4.
Combret
Y, Prieur G, Le Roux P, Médrinal C.
Non-invasive ventilation improves respiratory distress in children with acute
viral bronchiolitis: a systematic review. Minerva Anestesiol 2017; 83(6):
624-637. https://doi.org/10.23736/S0375-9393.17.11708-6
5.
Christophe
M, Julien B, Gilles C. Improving synchrony in young infants supported by
noninvasive ventilation for severe bronchiolitis: Yes, we can… so we should! Pediatr Pulmonol 2021; 56(2):
319-322. https://doi.org/10.1002/ppul.25184
6.
Mayordomo-Colunga
J, Medina A, Rey C, et al. Predictive factors of non invasive ventilation failure
in critically ill children: a prospective epidemiological study. Intensive Care
Med 2009; 35(3): 527-536. https://doi.org/10.1007/s00134-008-1346-7
7.
Delacroix
E, Millet A, Pin I, Mortamet G. Use of bilevel positive pressure ventilation in
patients with bronchiolitis. Pediatr Pulmonol 2020; 55(11): 3134-3138. https://doi.org/10.1002/ppul.25033
8.
Mayordomo-Colunga
J, Rey C, Medina A, et al. Helmet
versus nasal-prong CPAP in infants with acute bronchiolitis. Respir Care 2018;
63(4): 455-463. https://doi.org/10.4187/respcare.05840
9.
Javouhey
E, Barats A, Richard N, Stamm D, Floret D. Non-invasive ventilation as primary
ventilatory support for infants with severe bronchiolitis. Intensive Care Med
2008; 34(9): 1608-1614. https://doi.org/10.1007/s00134-008-1150-4
10. Baudin F, Pouyau R, Cour-Andlauer F, Berthiller J,
Robert D, Javouhey E. Neurally adjusted ventilator assist (NAVA) reduces
asynchrony during non-invasive ventilation for severe bronchiolitis: NAVA for
NIV in Severe Bronchiolitis. Pediatr Pulmonol 2015; 50(12): 1320-1327. https://doi.org/10.1002/ppul.23139
11. O’Brien S,
Borland ML, Cotterell E, et al.
Australasian bronchiolitis guideline. J Paediatr Child Health 2019; 55(1):
42-53. https://doi.org/10.1111/jpc.14104
12. Zuázaga DM, Pellegrini S, Gallagher R, Casais G,
Landry L. Evolución de pacientes con
bronquiolitis tratados con cánulas de
alto flujo de oxígeno que ingresan a la
unidad de cuidados intensivos. Med Infant 2020; XXVII(2): 101-106. Disponible
en: https://www.medicinainfantil.org.ar/index.php/2020-volumen-xxvii/numero-2/565-evolucion-de-pacientes-con-bronquiolitis-tratados-con-canulas-de-alto-flujo-de-oxigeno-que-ingresan-a-la-unidad-de-cuidados-intensivos
13. Del Arias
López MP, Boada N, Fernández A, et al. Performance of the pediatric index of mortality 3
score in PICUs in Argentina: A prospective, national multicenter study. Pediatr
Crit Care Med 2018; 19(12): e653-661. https://doi.org/10.1097/PCC.0000000000001741
14. Feudtner C, Feinstein JA, Zhong W, Hall M, Dai D.
Pediatric complex chronic conditions classification system version 2: updated
for ICD-10 and complex medical technology dependence and transplantation. BMC
Pediatr 2014; 14(1): 199. https://doi.org/10.1186/1471-2431-14-199
15. Beck J, Reilly M, Grasselli G, et al. Patient-ventilator interaction during neurally
adjusted ventilatory assist in low birth weight infants. Pediatr Res 2009;
65(6): 663-668. https://doi.org/10.1203/PDR.0b013e31819e72ab
16. Yaman A, Kendirli T, Ödek Ç, et al.
Efficacy of noninvasive mechanical ventilation in prevention of intubation and
reintubation in the pediatric intensive care unit. J Crit Care 2016; 32:
175-181. https://doi.org/10.1016/j.jcrc.2015.12.013
17. Campion A, Huvenne H, Leteurtre S, et al. Ventilation non invasive des nourrissons ayant une
infection respiratoire sévère présumée à virus
respiratoire syncitial : faisabilité et critères d’échec.
Arch Pédiatrie 2006; 13(11): 1404-1409. https://doi.org/10.1016/S0929-693X(09)74128-4
18. Wang BC, Pei T, Lin CB, et al. Clinical characteristics and outcomes associated
with nasal intermittent mandatory ventilation in acute pediatric respiratory
failure. World J Crit Care Med 2018; 7(4): 46-51. https://doi.org/10.5492/wjccm.v7.i4.46
19. Gupta S, Ramasubban S, Dixit S, et al. ISCCM Guidelines for the Use of Non-invasive
Ventilation in Acute Respiratory Failure in Adult ICUs. Indian J Crit Care Med
2020; 24(S1): S61-81. https://doi.org/10.5005/jp-journals-10071-G23186
20. McCallum GB, Morris PS, Wilson CC, et al. Severity scoring systems: Are they internally
valid, reliable and predictive of oxygen use in children with acute
bronchiolitis?: Validated Severity Tools for Bronchiolitis. Pediatr Pulmonol
2013; 48(8): 797-803. https://doi.org/10.1002/ppul.22627
21. Golan-Tripto I, Goldbart A, Akel K, Dizitzer Y, Novack
V, Tal A. Modified Tal Score: Validated score for prediction of bronchiolitis
severity. Pediatr
Pulmonol 2018; 53(6): 796-801. https://doi.org/10.1002/ppul.24007
22. Lins ARB da S, Duarte M do CMB, Andrade LB de. Noninvasive
ventilation as the first choice of ventilatory support in children. Rev Bras
Ter Intensiva 2019; 31(3): 333. https://doi.org/10.5935/0103-507X.20190045
23. Pons-Odena
M, Palancaa D, Modesto V, et al. SpO2/FiO2 as a predictor of non-invasive ventilation
failure in children with hypoxemic respiratory insufficiency. J Pediatr
Intensive Care 2013; 2(3): 111. https://doi.org/10.3233/PIC-13059
24. Ongun E,
Dursun O, Anil AB, Altug U, Koksoy OT. A multicentered study on efficiency of noninvasive ventilation
procedures (SAFE-NIV). Turk
J Med Sci 2021; 51(3): 1159-1171. https://doi.org/10.3906/sag-2004-35
25. Pons-Òdena M, Medina A, Modesto V, et al. ¿Cuáles son
los factores predictores de fracaso de ventilación no
invasiva más fiables en una unidad de
cuidados intensivos pediátricos? An Pediatr (Barc) 2019; 91(5): 307-316. https://doi.org/10.1016/j.anpedi.2019.01.013
26. Abadesso C, Nunes P, Silvestre C, Matias E, Loureiro
H, Almeida H. Non-invasive ventilation in acute respiratory failure in
children. Pediatr Rep 2012; 4(2): e16. https://doi.org/10.4081/pr.2012.e16
27. Clayton JA, McKee B, Slain KN, Rotta AT, Shein SL.
Outcomes of children with bronchiolitis treated with high-flow nasal cannula or
noninvasive positive pressure ventilation. Pediatr Crit Care Med 2019;
20(2): 128-135. https://doi.org/10.1097/pcc.0000000000001798
28. Bustos-Gajardo
FD, Luarte-Martínez SI, Dubo Araya SA,
Adasme Jeria RS. Resultados clínicos según el tiempo de inicio de la ventilación invasiva en niños con fracaso de la ventilación no invasiva. Med Intensiva 2023; 47(2):
65-72. https://doi.org/10.1016/j.medin.2021.10.006
29. Moreno L, Ferrero
F, Abramovich N, et al.
Recomendaciones para el manejo de las infecciones respiratorias agudas bajas en
menores de 2 años. Arch Argent Pediatr 2021; 119(04): S171-S197. https://doi.org/10.5546/aap.2021.S171