Síndrome de dificultad respiratoria aguda por
inhalación accidental de cloro
[Acute respiratory
distress syndrome secondary to accidental chlorine inhalation]
María José Domínguez-Rivas,a Antonio
Gordillo-Brenes,b Ángel Custodio Sánchez-Rodríguezb*
a Servicio de Medicina Intensiva, Hospital
Universitario Puerto Real, Cádiz, España
b Servicio de Medicina Intensiva, Hospital
Universitario Puerta del Mar, Cádiz, España
* Correspondencia:
rodshchez@gmail.com
Los
autores no declaran conflictos de intereses.
Resumen
El cloro es una
sustancia química de uso generalizado tanto en hogares como en la industria. La
exposición humana a niveles tóxicos es prácticamente siempre involuntaria. En
la mayoría de los casos, provoca solo síntomas menores, como irritación ocular
y de mucosas. La exposición a concentraciones elevadas puede causar
complicaciones graves, como neumonitis, edema pulmonar, insuficiencia
respiratoria grave e incluso la muerte. El síndrome de dificultad respiratoria
aguda secundario a la inhalación de cloro es poco común en la práctica clínica.
Presentamos el caso de un hombre de 30 años que inhaló accidentalmente cloro y
desarrolló un síndrome de dificultad respiratoria aguda con requerimiento de
oxigenación por membrana extracorpórea venovenosa.
Palabras clave: Intoxicación con cloro; hipoxemia; síndrome de
dificultad respiratoria aguda; oxigenación por membrana extracorpórea.
Abstract
Chlorine is a chemical element widely used in
both homes and industry. Human exposure to toxic levels is almost always
involuntary. In most cases, only minor symptoms, such as eye and mucosal
irritation, appear. Severe complications, such as pneumonitis, pulmonary edema,
severe respiratory failure, and even death may occur with exposure to high
concentrations. Acute respiratory distress syndrome secondary to chlorine
inhalation is rare in clinical practice. We present a case of a 30-year-old man
who suffers accidental inhalation by chlorine and develops a severe hypoxemic
respiratory failure that required treatment with venovenous extracorporeal
membrane oxygenation.
Keywords: Chlorine poisoning; hypoxemia; acute respiratory
distress syndrome; extracorporeal membrane oxygenation.
Introducción
El cloro es un gas amarillo verdoso a
temperatura ambiente con olor detectable; sin embargo, ante una exposición prolongada, la capacidad de
detectarlo tiende a desaparecer.1 El cloro es una sustancia química de uso generalizado tanto en
hogares como en la industria. La exposición humana a niveles tóxicos es prácticamente siempre involuntaria.2 En la mayoría de los casos, provoca solo síntomas menores, como irritación ocular y de mucosas. La exposición a concentraciones elevadas puede
causar complicaciones graves, como neumonitis, edema pulmonar, insuficiencia
respiratoria grave e incluso la muerte.3 El síndrome
de dificultad respiratoria aguda (SDRA) secundario a la inhalación de cloro es poco común en la práctica clínica. Se trata de un tipo de lesión pulmonar inflamatoria aguda y difusa que provoca un
aumento de la permeabilidad vascular pulmonar y la pérdida de tejido pulmonar aireado.4 Clínicamente, se observa hipoxemia y
opacidades bilaterales en las imágenes pulmonares, aumento del espacio muerto fisiológico y disminución de la distensibilidad pulmonar.1,2
Caso clínico
Hombre de 30 años de edad, sin antecedentes patológicos. Limpiando la depuradora de su piscina, inhaló accidentalmente cloro y floculante (sulfato de aluminio-sulfato de amonio). Permaneció aproximadamente 5 minutos en una estancia sin ventilación en contacto con el gas. Comenzó con tos irritativa y disnea que lo obligó a salir al exterior. Acudió al Servicio de Urgencias del hospital con signos de insuficiencia respiratoria hipoxémica, sin respuesta a la oxigenoterapia, ni a los corticoides inhalados e intravenosos. La radiografía posteroanterior de tórax era normal (Figura).
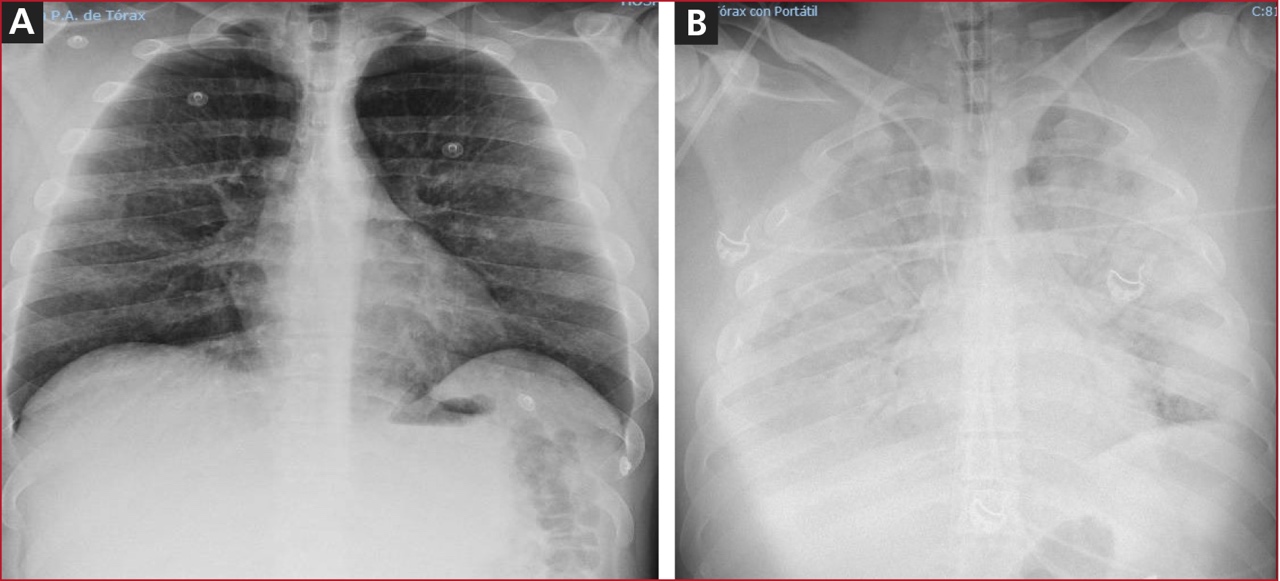
Figura. Radiografía posteroanterior de tórax al ingresar (A) y a las 3 horas (B).
Ingresó en la Unidad de Cuidados Intensivos, con una frecuencia respiratoria de 35 resp./min, uso de la musculatura accesoria, crepitantes y sibilancias bilaterales en la auscultación pulmonar; saturación de oxígeno (SpO2) por oxímetro de pulso del 85%, con mascarilla reservorio; frecuencia cardíaca de 120 lat./min, presión arterial de 100/60 mmHg. Se cambió a cánulas nasales de alto flujo a 60 l y FiO2 del 90%, La gasometría arterial arrojó los siguientes resultados: pH 7,29; pCO2 41 mmHg; pO2 60 mmHg; lactato arterial 4,4 mmol/l y bicarbonato 19,7 mmol/l.
El cuadro clínico progresivo empeoró, con PAFI <70 mmHg, acidosis láctica e hipotensión arterial; por lo tanto, se procedió a la intubación orotraqueal y a la conexión a ventilación mecánica (VM). Se administró bicarbonato 1 M y noradrenalina hasta 0,6 µg/kg/min. Una nueva radiografía posteroanterior de tórax (Figura) reveló un infiltrado alveolo-intersticial bilateral. El hemograma y los estudios de coagulación y perfiles bioquímicos fueron normales. En una ecocardiografía transtorácica, se observó un ventrículo izquierdo no dilatado con fracción de eyección normal y cavidades derechas normales. La ecografía pulmonar mostró abundantes líneas B distribuidas de forma difusa y bilateral.
En las siguientes horas, el paciente requirió sedoanalgesia profunda y relajación, continuó con corticoides intravenosos, decúbito prono en VM en presión control de +35 cmH2O, PEEP +12 cmH2O, inversión de la relación inspiración/espiración, frecuencia respiratoria de 30 resp./min, con FiO2 al 100%, volumen corriente de 4 ml/kg, SpO2 <70%. Necesitó hemofiltración continua por acidosis grave. Los resultados de la gasometría arterial fueron: pH 7,18; pCO2 51 mmHg; pO2 76 mmHg; bicarbonato 12,3 mmol/l y lactato arterial 8 mmol/l.
Ante la situación clínica, junto con el hospital de referencia, se evaluó el uso de oxigenación por membrana extracorpórea (extracorporeal membrane oxygenation, ECMO) venovenosa. Por la inestabilidad del paciente, el equipo de Cirugía Cardíaca se trasladó a nuestro hospital para la canulación de ambas venas femorales, la de drenaje con extremo distal en la vena cava inferior suprahepática y la de retorno en la confluencia de las venas cavas.
La ECMO venovenosa con flujo sanguíneo
de 5 l/min, flujo de aire de 5 l/min y FiO2 del 100%, estabilizó al paciente, mejoró la oxigenación y la
acidosis respiratoria, y permitió una VM protectora (volumen corriente 340 ml,
FiO2 100%, frecuencia
respiratoria 18 resp./min), consiguiendo los siguientes valores: pH 7,41; pCO2 47 mmHg; pO2 82 mmHg. El paciente fue trasladado
al hospital de referencia en una Unidad de Cuidados Intensivos móvil.
En los
primeros días con ECMO venovenosa, se mantuvo el flujo sanguíneo en 5-7 l/min,
flujo de gas ajustado para permitir la normocapnia y una FiO2 del
100%, anticoagulación con heparina sódica, VM protectora con volumen corriente
de 4 ml/kg, frecuencia respiratoria 15 resp./min, PEEP 10 cmH2O y FiO2 40%.
La mejoría de la oxigenación (Tabla) y de las radiografías permitió disminuir progresivamente la FiO2 y los parámetros de la ECMO hasta su retirada a los 13 días, tres días más tarde se retiró la VM.
Tabla
Evolución de los parámetros
|
ECMO-VV Día |
Parámetros en ECMO-VV |
Gasometría arterial |
Parámetros de ventilación |
|
Primero |
FS 5 l 3000 rpm Flujo de aire 6 l FiO2 100% |
pH 7,49 pCO2 41 mmHg pO2 154
mmHg Lactato 2,71 mmol/l |
VC Vc 300 ml FR 18/min PEEP +10 cmH2O FiO2 40% SpO2 100% |
|
Cuarto |
FS 5 l 3000 rpm Flujo de aire 7 l FiO2 100% |
pH 7,41 pCO2 38 mmHg pO2 155
mmHg Lactato 1,55 mmol/l |
VC Vc 300 ml FR 18/min FiO2 30% SpO2 100% |
|
Sexto |
FS 5 l 3000 rpm Flujo de aire 6,5 l FiO2 100% |
pH 7,35 pCO2 42 mmHg pO2 141
mmHg Lactato 1 mmol/l |
VC Vc 300 ml FR 18/min PEEP +8 cmH2O FiO2 40% SpO2 100% |
|
Octavo |
FS 5 l 3000 rpm Flujo de aire 2 l FiO2 80% |
pH 7,29 pCO2 50 mmHg pO2 95
mmHg Lactato 0,9 mmol/l |
PS +10 cmH20 PEEP +10 cmH2O FiO2 50% SatO2p 100% |
|
Décimo |
FS 5 l Flujo de aire 5 l 3000 rpm FiO2 100% |
pH 7,46 2Hg pO2 121
mmHg Lactato 0,9 mmol/l |
VC Vc 360 ml FR 18/min PEEP +10 cmH2O FiO2 40% SpO2 100% |
|
Duodécimo |
FS 4 l Flujo de aire 3 l 2500 rpm FiO2 60% |
pH 7,53 pCO2 38 mmHg pO2 88
mmHg Lactato 0,8 mmol/l |
PS +9 cmH20 Vc 450 ml PEEP +15 cmH2O FiO2 55% SatO2p 99% |
|
Decimotercero |
FS 2 l Flujo de aire 0 FiO2 – |
pH 7,51 pCO2 38 mmHg pO2 107
mmHg Lactato 0,8 mmol/l |
PS +9 cmH2O Vc 550 ml PEEP +10 cmH2O FR 18 pm FiO2 50% |
ECMO (extracorporeal membrane oxygenation) = oxigenación por membrana extracorpórea venovenosa; VV = venovenosa; FS = flujo de sangre; VC = volumen control; Vc = volumen corriente. FR = frecuencia respiratoria. PS = presión de soporte.
El paciente pasó a Planta y, a los 25 días del ingreso, fue dado de
alta. Se le indicó continuar con anticoagulación con acenocumarol como
prevención de la trombosis venosa profunda. Los corticoides orales se redujeron
gradualmente durante cuatro semanas. Seis semanas después, la prueba de función
pulmonar mostró la recuperación completa. A los tres meses, el paciente estaba
asintomático, se incorporó
al trabajo y a su vida normal.
Discusión
Las propiedades destructivas de la inhalación de cloro se deben a efectos directos, en relación con el ambiente ácido resultante de la interacción del cloro gaseoso con la mucosa respiratoria húmeda, y a efectos indirectos, por la liberación de radicales libres y especies altamente reactivas de los neutrófilos reclutados en las vías respiratorias después de una inhalación aguda de cloro.5,6
El alcance y la gravedad de las lesiones
por exposición al cloro dependen de la duración de la exposición, la
concentración del gas, la susceptibilidad individual, el contenido de agua de
los tejidos expuestos (formación de HCl y HOCl) y la ventilación de la persona
expuesta.3,7 La
irritación de mucosas ocurre a concentraciones >15 ppm; las manifestaciones
respiratorias leves se producen a concentraciones >30 ppm, y la neumonitis y
el edema pulmonar, a concentraciones >50 ppm. La exposición a
concentraciones >400 ppm puede provocar la muerte.3,8
La lesión por inhalación de cloro acompañada de SDRA y la necesidad de asistencia respiratoria es una situación clínica infrecuente.1,9 Se han publicado pocos casos de pacientes con requerimiento de VM invasiva, una tasa de mortalidad del 38,5%, en la mayoría de los casos, en los primeros tres días.1 La ECMO puede ofrecer una mejor oportunidad de superar la etapa aguda de la lesión por inhalación de cloro, siempre que no exista contraindicación, dando tiempo al pulmón para su reparación.1-11 Pero esta afirmación se basa únicamente en la observación clínica, se necesitan ensayos clínicos aleatorizados para dilucidar los beneficios en la supervivencia, los efectos sobre la inflamación pulmonar aguda, las secuelas a largo plazo y la aparición de complicaciones,10,11 así como para ayudar a desarrollar directrices clínicas sobre el inicio del tratamiento con ECMO.10
Conclusiones
El SDRA secundario a la inhalación de cloro con necesidad de asistencia respiratoria mediante ECMO-VV es una situación clínica poco frecuente. Presentamos a un paciente de 30 años que desarrolló un SDRA tras la inhalación accidental de cloro y necesitó de soporte respiratorio con ECMO-VV durante 13 días. El paciente tuvo una buena recuperación y, tras 25 días de hospitalización, fue dado de alta, sin secuelas.
Cuando los tratamientos convencionales fallan, la ECMO es una modalidad terapéutica potencial para el SDRA inducido por la inhalación tóxica aguda, inclusive de cloro. Sin embargo, se necesitan más estudios observacionales y ensayos clínicos aleatorizados para respaldar el efecto de la ECMO en estas situaciones.
Destacamos la importancia de contar con un programa de ECMO móvil para situaciones similares que surjan en hospitales que no cuentan con cirugía cardíaca.
Bibliografía
1.
Chen TF,
Wang CH, Hermes GL, Ko WJ. Chlorine inhalation injury with acute respiratory
distress syndrome treated by extra-corporeal membrane oxygenation system. Glob
J Medical Clin Case Rep 2020; 7(1): 005-009. https://doi.org/10.17352/2455-5282.000079
2.
Babu RV,
Cardenas V, Sharma G. Acute respiratory distress syndrome from chlorine
inhalation during a swimming pool accident: a case report and review of the
literature. J Intensive Care Med 2008; 23(4): 275-280. https://doi.org/10.1177/0885066608318471
3.
White CW,
Martin JG. Chlorine gas inhalation: human clinical evidence of toxicity and
experience in animal models. Proc Am Thorac Soc 2010; 7(4): 257-263. https://doi.org/10.1513/pats.201001-008SM
4.
ARDS
Definition Task Force, Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute
respiratory distress syndrome: the Berlin Definition. JAMA 2012; 307(23):
2526-2533. https://doi.org/10.1001/Jama.2012.5669
5.
Evans RB.
Chlorine: state of the art. Lung 2005; 183(3): 151-67. https://doi.org/10.1007/s00408-004-2530-3
6.
Zhou T,
Song WF, Shang Y, Yao SL, Matalon S. Halogen inhalation-induced lung injury and
acute respiratory distress syndrome. Chin Med J (Engl) 2018; 131(10):
1214-1219. https://doi.org/10.4103/0366-6999.231515
7.
Zellner
T, Eyer F. Choking agents and chlorine gas - History, pathophysiology, clinical
effects and treatment. Toxicol Lett 2020; 320: 73-79.
https://doi.org/10.1016/j.toxlet.2019.12.005
8.
Govier P,
Coulson JM. Civilian exposure to chlorine gas: A systematic review. Toxicol
Lett 2018; 293: 249-252. https://doi.org/10.1016/j.toxlet.2018.01.014
9.
Harischandra
T, Withanaarachchi K, Piyasiri B, et al. Successful use of extracorporeal
membrane oxygenation in acute respiratory distress syndrome following
accidental chlorine gas inhalation at a swimming pool. Perfusion 2020; 35(6):
543-545. https://doi.org/10.1177/0267659120922013
10. Yu D, Xiaolin Z, Lei P, et al. Extracorporeal membrane
oxygenation for acute toxic inhalations: Case reports and literature review.
Front Med (Lausanne) 2021; 8: 745555. https://doi.org/10.3389/fmed.2021.745555
11. Munshi L, Walkey A, Goligher E, et al. Venovenous
extracorporeal membrane oxygenation for acute respiratory distress syndrome: a
systematic review and meta-analysis. Lancet Respir Med 2019; 7(2): 163-172. https://doi.org/10.1016/S2213-2600(18)30452-1