Recomendaciones para el manejo del dengue grave en Pediatría
[Recommendations for the management of pediatric severe dengue]
Capítulo Pediátrico
Comité de Shock Pediátrico, Sociedad
Argentina de Terapia Intensiva
Josefina Pérez,1,15* Luis Llano López,2,15 Viviana Pavlicich,3 Ricardo Iramain,4 Miguel Céspedes Lesczinsky,5 Priscila Botta,6,15 Emanuel Fernández,7,15 Oscar Gómez Lund,8,16 Facundo Jorro Baron,9,17 Verónica del Valle Córdoba,10,15 Alejandro Mansur,11,16 Gladys Palacio,12,15 Javier Ponce,7,15 Marcelo Quipildor,13,15 Roberto Jabornisky14,16
1Hospital de Niños “Dr. Orlando Alassia”, Santa Fe, Argentina; 2Hospital Pediátrico “Dr. Humberto Notti”, Mendoza, Argentina; 3Hospital General Pediátrico “Niños de Acosta Ñu”, Asunción,
Paraguay; 4Hospital de Clínicas, Asunción,
Paraguay; 5Hospital Materno Infantil Boliviano
Japonés, Trinidad, Bolivia; 6Hospital
del Niño Jesús, Tucumán, Argentina; 7Hospital
“Dr. Guillermo Rawson”, San Juan, Argentina; 8Hospital
Público Materno Infantil, Salta, Argentina; 9Hospital
General de Niños “Dr. Pedro de Elizalde”, Ciudad Autónoma de Buenos Aires,
Argentina; 10Sanatorio Altos de
Salta, Swiss Medical Group, Salta, Argentina; 11Hospital
Central de Reconquista “Dra. Olga Stucky de Rizzi”, Reconquista, Santa Fe; 12Hospital de Niños “Dr. Ricardo Gutiérrez”, Ciudad Autónoma de
Buenos Aires, Argentina; 13Hospital Público
Materno Infantil, Hospital San Vicente de Paul Orán, Salta, Argentina; 14Hospital Pediátrico “Juan Pablo II”, Corrientes, Argentina; 15Sociedad Argentina de Terapia Intensiva; 16LARed Network; 17Sociedad
Argentina de Pediatría
* Correspondencia: pjosef23@gmail.com
Los autores no
declaran conflictos de intereses.
https://doi.org/10.64955/jratiy2025x942
Resumen
Introducción: En 2024, el dengue afectó a la mayoría
de las jurisdicciones de salud de Argentina, generando consultas sobre el
manejo de casos graves. El Comité de Shock Pediátrico de la Sociedad Argentina
de Terapia Intensiva observó que la bibliografía disponible para Unidades de
Cuidados Intensivos Pediátricos (UCIP) era escasa y basada en documentos
globales de más de 10 años. Objetivo: Desarrollar una recomendación nacional actualizada sobre el manejo del
dengue grave en Pediatría en Argentina, con la colaboración de expertos
regionales. No pretende reemplazar las guías del Ministerio de Salud. Diseño: Se conformó un panel de 11 intensivistas
pediátricos argentinos, 3 expertos internacionales (2 intensivistas pediátricos
de Bolivia y Paraguay, 1 emergentóloga pediátrica de Paraguay) y 1 infectólogo
experto en dengue. Se organizaron en grupos para elaborar recomendaciones sobre
epidemiología, clínica, manejo general y específico del dengue grave en
Pediatría. Metodología: Se realizaron numerosas reuniones virtuales para discutir propuestas y
alcanzar consensos iterativos hasta conformar el documento final. Resultados: El grupo desarrolló recomendaciones
sobre triaje inicial, manejo actualizado del dengue grave en Pediatría y
aspectos clave de su tratamiento en UCIP. Conclusión: Es la primera vez que un grupo de
expertos elabora recomendaciones específicas para el manejo del dengue grave en
UCIP en Argentina.
Palabras clave: Dengue; shock; dengue grave.
Abstract
Introduction: In 2024, dengue affected most health
jurisdictions in Argentina, raising concerns about the management of severe
cases. The Pediatric Shock Committee of the Argentine Society of Intensive Care
Medicine identified a lack of up-to-date literature on severe dengue management
in Pediatric Intensive Care Units (PICUs), relying primarily on global
documents over ten years old. Objetive: To develop a national recommendation on severe dengue management in
pediatric patients in Argentina, incorporating input from regional experts.
This recommendation does not replace national health guidelines. Design: A panel was formed, including 11 pediatric
intensivists from Argentina, 3 international experts (2 pediatric intensivists
from Bolivia and Paraguay, 1 pediatric emergency physician from Paraguay), and
1 infectious disease specialist in dengue. The panel was divided into groups to
draft recommendations on epidemiology, clinical presentation, general
management, and specific management of severe dengue in pediatric patients. Methods: Multiple virtual meetings were held to
discuss proposals and reach iterative consensus, leading to the final document.
Results: The group developed recommendations on
initial triage, updated management of severe dengue in pediatric patients, and
key aspects of treatment in PICUs. Conclusion: This is the first time a group of experts has developed specific
recommendations for the management of severe dengue in PICUs in Argentina.
Keywords: Dengue; shock; severe dengue.
1. Introducción
El dengue es una enfermedad causada por
el virus del dengue que pertenece a la familia Flaviviridae. Se transmite a
través de la picadura de un mosquito perteneciente al género Aedes (Aedes
aegypti) que es el vector de la enfermedad y tiene hábitos domiciliarios.
Esta enfermedad es la infección por arbovirus más frecuente y es endémica en
129 países. El virus del dengue circula por la región Asia-Pacífico, donde se
encuentra el 75% de la población en riesgo, especialmente en África, América
Central y del Sur. Alrededor de 3000 millones de personas viven en regiones
donde hay riesgo de contraer la enfermedad.1 Anualmente, se producen 390 millones de
infecciones (96 millones sintomáticas) y 20.000 muertes por el virus del
dengue, es la segunda causa de síndrome febril agudo en viajeros
internacionales.1 Afecta a todos los grupos etarios,
y los cursos clínicos son variables.1
Varios factores colaboran para que el
dengue sea un problema creciente para la salud pública mundial:
el cambio climático, el aumento de la población mundial en áreas urbanas de
aparición rápida y desorganizada, la insuficiente provisión de agua potable, la
inadecuada recolección de residuos y la gran producción de recipientes
descartables que sirven como criaderos de mosquitos, al igual que los
neumáticos desechados, el aumento de los viajes y las migraciones, así como las
fallas en el control vectorial.
El vector transmite el virus por la
picadura de la hembra infectada previamente por haber picado a una persona en
fase de viremia. También está descrita la transmisión transovárica, es la
transmisión del virus entre generaciones de mosquitos a partir del desarrollo
de huevos infectados por transmisión vertical de los vectores.
La persona infectada transmite la
enfermedad durante el período de viremia, que se extiende desde un día antes
hasta 5 o 6 días después de la aparición de la fiebre. Si, en este período, un
mosquito pica a la persona, se infecta. Luego, el mosquito desarrolla la
infección viral durante el período de incubación extrínseco, tras el cual
permanece infectante el resto de su vida.
En 1916, se produjo el primer brote
conocido en la Argentina, introducido desde países limítrofes. Se habían
descrito casos aislados entre 1905 y 1911.2 En 1963, se consideró y certificó la
erradicación del vector en el país. Transitoriamente, durante 82 años, la
enfermedad desapareció del país, pero, al no mantenerse una política permanente
de vigilancia y control vectorial, reemergió en 1998.2 En 2024, la Argentina ha padecido la mayor
epidemia de dengue en 5 años, fue el segundo país en Latinoamérica con más
casos en la región de las Américas.3
Entre las semanas epidemiológicas (SE)
1 y 42 de 2024, se reportaron, en la Región de las Américas, un total de
12.261.165 casos sospechosos de dengue (incidencia acumulada de 1284 casos por
100.000 habitantes). Esta cifra representa un incremento del 209% en
comparación con el mismo período de 2023 y del 387% con respecto al
promedio de los últimos 5 años (Figura 1).4
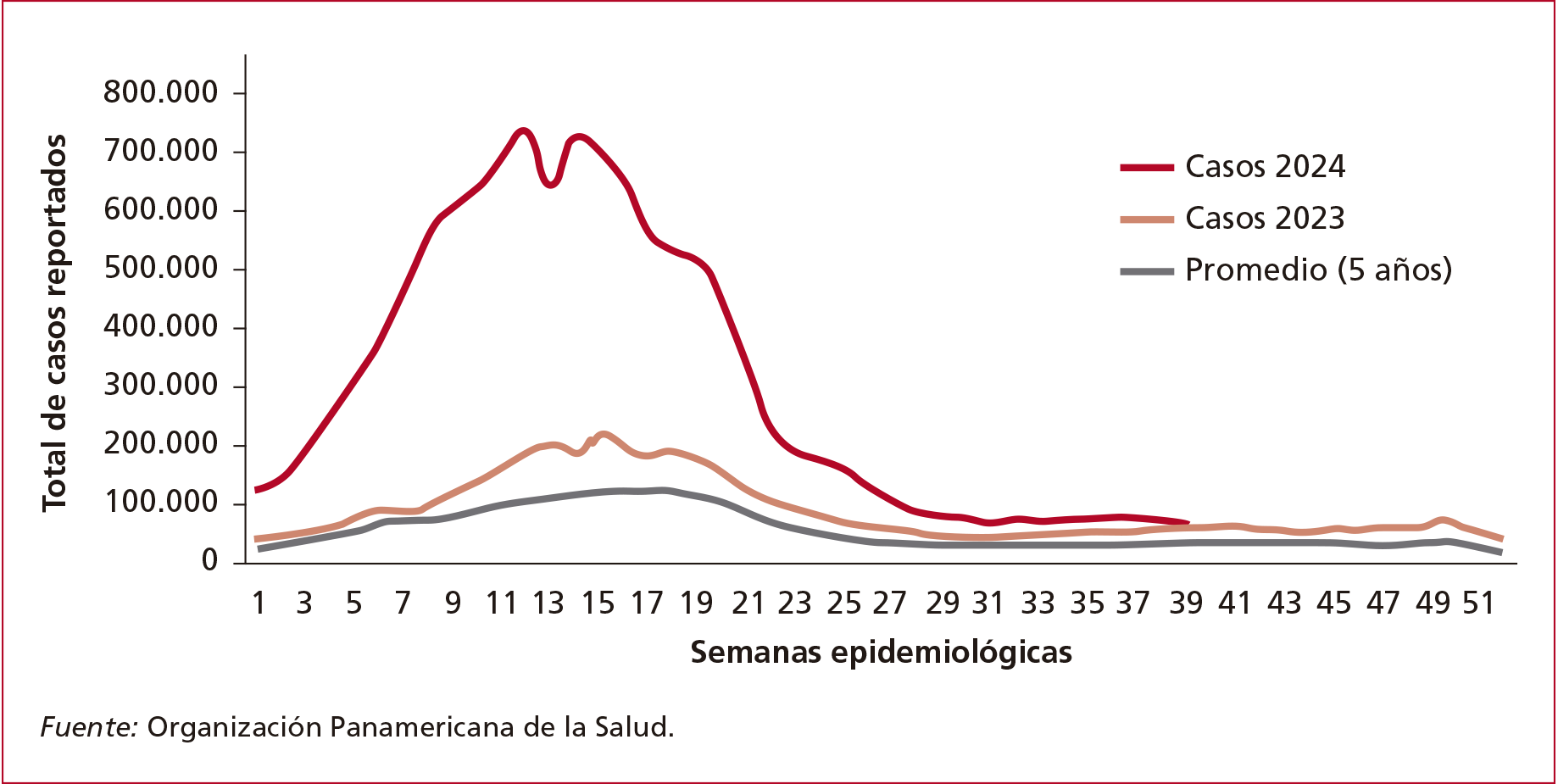
Figura 1. Número total de casos sospechosos de dengue en la SE 42 en 2024, 2023 y promedio de los últimos 5 años. Región de las Américas.
Situación del dengue en la Argentina
En 2024, hubo un importante aumento de
casos en el país. Desde la SE 1 hasta la SE 45 de 2024, se registraron 580.200
casos de dengue de un total de 765.453 casos notificados investigados.4 En las últimas SE que componen la temporada
2024/2025 (a partir de la SE 31/2024 y hasta la SE 52/2024), se registraron
20.296 casos sospechosos de dengue en el Sistema Nacional de Vigilancia de la
Salud, de los cuales 274 fueron confirmados (255 sin antecedentes de viaje, el
resto con antecedentes de viaje y 3 por trasplante).5
En la Argentina, los serotipos 1 y 2 se
encuentran actualmente en circulación, sobre todo, en personas sin antecedentes
de viajes (Figura 2).4
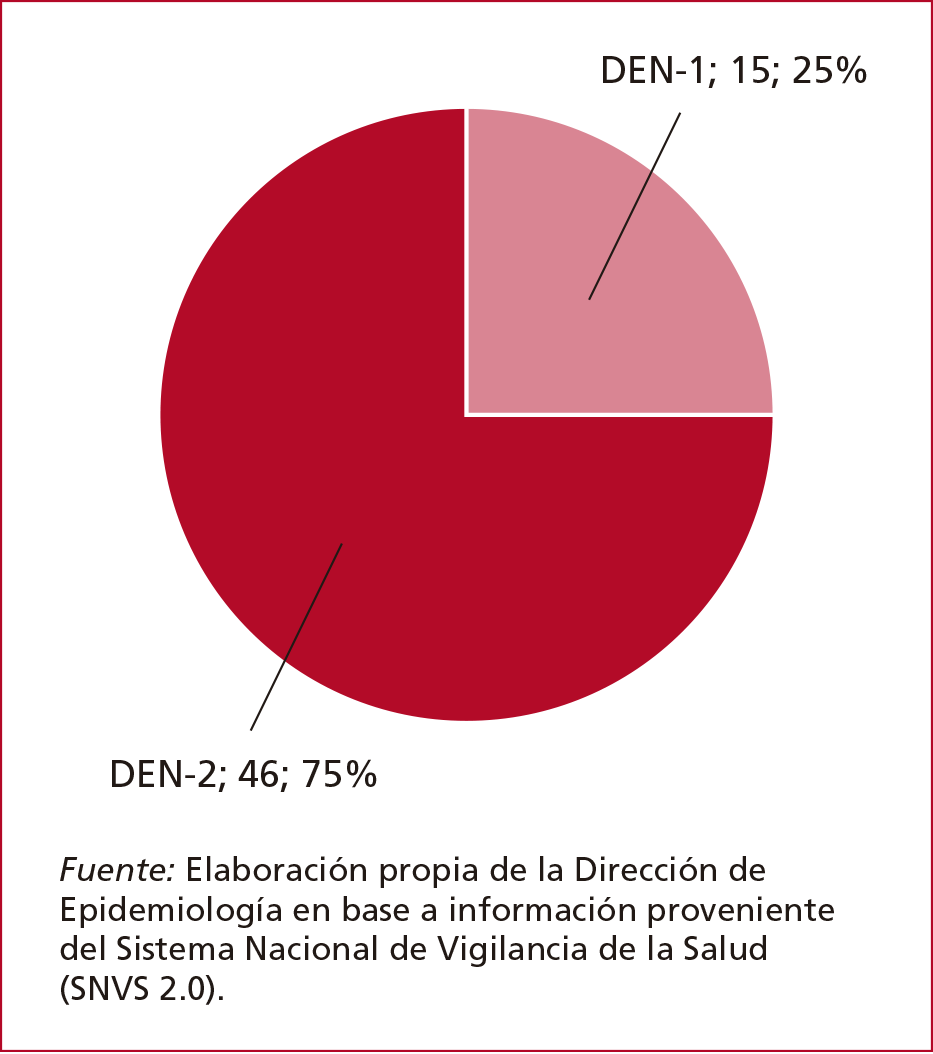
Figura 2. Dengue:
proporción de serotipos DEN-1 y DEN-2 en pacientes sin antecedentes de viajes.
De la SE 31 a la SE 45/2024. Argentina.4
Dengue en niños y adolescentes3
En lo que respecta a este grupo etario,
hasta la SE 29, se registraron 149.324 casos en menores de 20 años (incidencia
acumulada de 1018 casos cada 100.000 habitantes), de los cuales 324 se
notificaron como dengue grave (0,22%) y 44 pacientes fallecieron (letalidad
específica del 0,03%). El 26% tenía condiciones de riesgo asociadas. El 54% de
las muertes ocurrieron en pacientes del sexo femenino y el 45%, del sexo
masculino, con una mediana de edad de 10 años. Se registraron muertes en todos
los grupos etarios, pero la mayor tasa de mortalidad se observó entre los 15
a 19 años, seguido por el grupo de entre 5 y 9 años (Tabla 1).3
|
TABLA 1 Dengue en pacientes <20 años: indicadores en pacientes <20 años. De la SE 31/2023 a la SE 29/2024. Argentina3 |
||||||
|
Grupo Edad |
Casos de dengue |
Incidencia acumulada en 100.000 hab. |
Casos de dengue grave |
Casos fallecidos |
Tasa mortalidad x 100.000 hab. |
Proporción de fallecidos con respecto al total de casos |
|
0-04 años |
16.300 |
446 |
65 |
10 |
0,3 |
0,06% |
|
05-09 años |
33.457 |
898 |
58 |
12 |
0,3 |
0,04% |
|
10 a 14 años |
48.806 |
1.303 |
99 |
4 |
0,1 |
0,01% |
|
15 a 19 años |
50.761 |
1.434 |
102 |
18 |
0,5 |
0,04% |
|
Población menores de 20 años |
149.324 |
1.018 |
324 |
44 |
0,3 |
0,03% |
|
Población general |
544.778 |
1.157 |
1.601 |
415 |
0,9 |
0,08% |
|
Fuente: Elaboración propia del Área de Vigilancia de la Salud y del Área de Análisis de Información e Investigación en base a información proveniente del Sistema Nacional de Vigilancia de la Salud (SNVS 2.0). |
||||||
Según el informe del Ministerio de
Salud,3 los signos y síntomas más frecuentes en los
pacientes menores de 20 años que fallecieron fueron:
• fiebre (87%),
• cefalea (48%),
• náuseas y vómitos (38%),
• dolor abdominal (35%),
• mialgias (35%),
• diarrea (22%).
De los 37 que murieron y contaban con
información clínica completa, 24 (65%) tenían, al menos, un signo o síntoma
gastrointestinal. En 11 pacientes fallecidos (26%), se registraron condiciones
de riesgo, y las más frecuentes fueron: embarazo (3 casos) y enfermedad
cardíaca (2 casos). No se registraron datos sobre cuadros preexistentes en los
restantes 31 muertos (74%).
En 27 casos, se pudo determinar el
serotipo involucrado: en 17, era DEN-2 y, en 10, DEN-1. En la región Centro, la
mediana de edad de los pacientes fallecidos fue de 15.5 años, mientras que, en
el Noroeste y el Noreste argentino, fue de 8.5 años.5
2. Cuadro clínico
Existen cuatro serotipos con
características relevantes: 1, 2, 3 y 4. La inmunidad es específica
del serotipo, por lo que la infección por un serotipo determinado
confiere inmunidad permanente contra este serotipo (inmunidad homóloga)
y solo por unos meses contra el resto de los serotipos (inmunidad heteróloga).
Cada serotipo tiene genotipos que podrían agravar la forma de presentación del
dengue. Existen genotipos más transmisibles y otros con evolución clínica más
desfavorable; por esto, hoy se habla de la vigilancia genómica.6
Aunque, en teoría, una persona podría
padecer dengue cuatro veces a lo largo de su vida (una por cada serotipo),
hasta el momento, solo se han comprobado tres infecciones en un mismo
individuo.7-9 Cualquier serotipo puede producir
formas graves de la enfermedad.
El dengue se define por una combinación
de 2 o más hallazgos clínicos en una persona con fiebre que vive en un área
endémica de dengue, o viajó a ella (en los últimos 14 días). El 25% de los
pacientes con dengue son sintomáticos y solo el 0,5-1% puede desarrollar dengue
grave potencialmente mortal. Teniendo en cuenta que los primeros hallazgos
clínicos son inespecíficos, el dengue requiere un alto índice de sospecha.
Reconocer los signos tempranos de shock
e iniciar, de manera rápida, el tratamiento puede reducir significativamente el
riesgo de muerte (Tabla 2).10
TABLA 2
Diagnóstico de
dengue según se encuentre en brote o no de enfermedad y el tiempo desde el
comienzo de los síntomas10
|
|
Región sin confirmación de brote de dengue |
Región con confirmación de brote de dengue |
|
Muestra tomada antes de los 5 días del inicio de los síntomas |
Aislamiento
del virus o genoma viral de suero o tejido Positivo: Dengue confirmado Negativo: Repetir muestra a los 10 o 15 días del comienzo de los síntomas: Negativo: Caso negativo Positivo: Prueba de neutralización en el suero de la primera muestra, si el resultado es negativo, se confirma la seroconversión y se considera caso confirmado |
Aislamiento
del virus o genoma viral de suero o tejidos Para monitoreo del serotipo y genotipo, no para diagnóstico |
|
Muestra tomada después de los 5 días del inicio de los síntomas |
Detección
de anticuerpos IgM del virus del dengue Negativo: Se descarta diagnóstico de dengue Positivo: Confirmar mediante prueba de neutralización |
Detección
de anticuerpos IgM del virus del dengue Una sola muestra positiva para IgM puede confirmar un caso sospechoso |
Considerando esto, describiremos
resumidamente la clínica de la enfermedad, comprendiendo sus fases y los
hallazgos que pueden alertarnos del desarrollo del dengue grave (Figura 3).
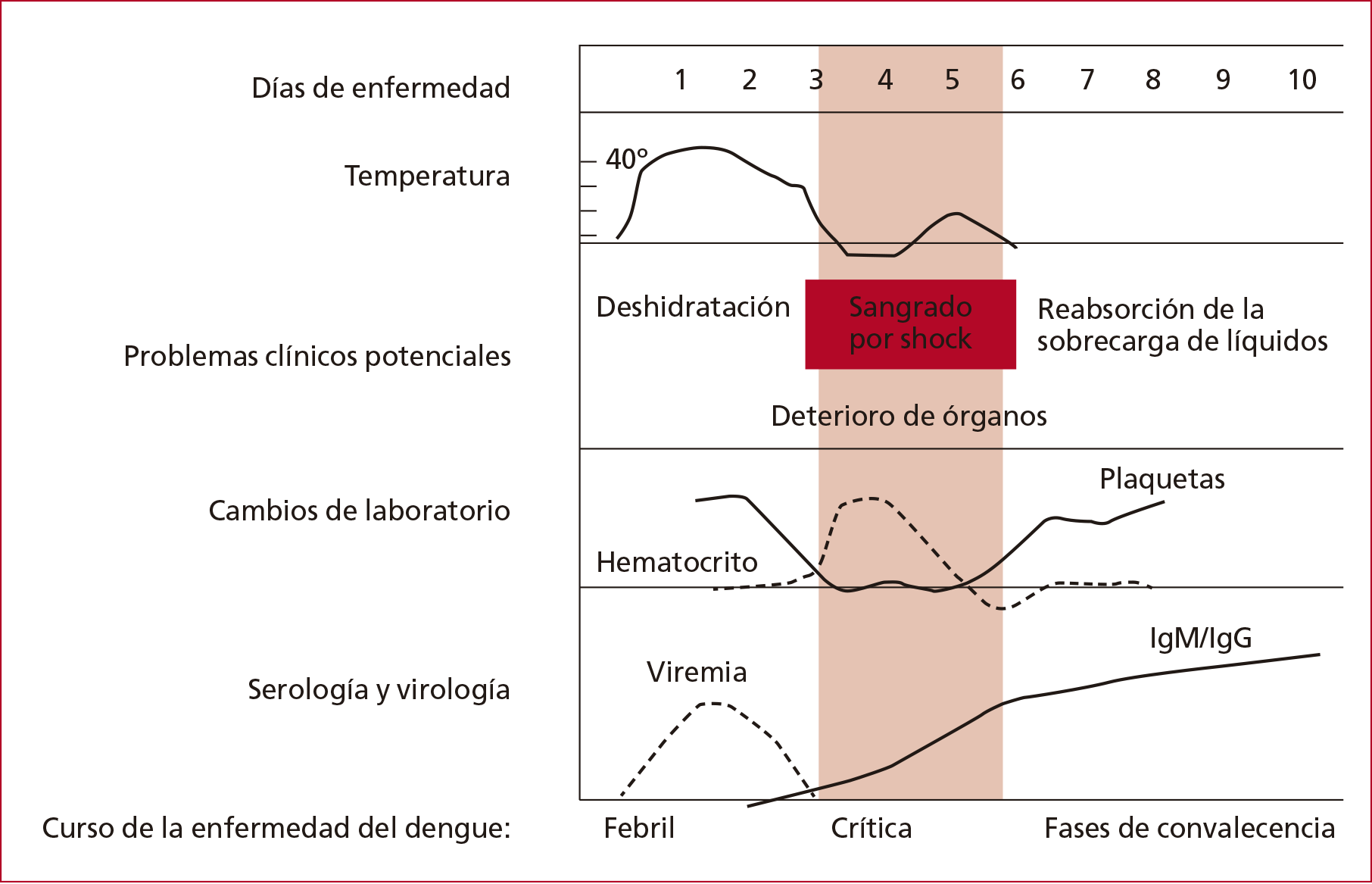
Figura 3. Etapas
de evolución del dengue. (Tomada de Dengue: guías para diagnóstico,
tratamiento, prevención y control de la Organización Panamericana de la Salud).11
Período de incubación: de 5 a 7 días.
Fases: febril, crítica y de convalecencia.
Laboratorio: leucopenia, trombocitopenia,
hiponatremia, elevación de transaminasas y velocidad de sedimentación globular
normal.
Fase febril
Duración: de 2 a 7 días.
Evaluar signos de alarma.
Clínica (Figura 4): cefalea intensa, dolor retroorbitario,
mialgias y artralgias, erupción macular o maculopapulosa y manifestaciones
hemorrágicas menores (petequias, equimosis, púrpura, epistaxis, sangrado
gingival, hematuria o un resultado positivo de la prueba del torniquete). Con
menos frecuencia, puede haber eritema orofaríngeo y facial en las primeras
24-48 horas después del inicio.
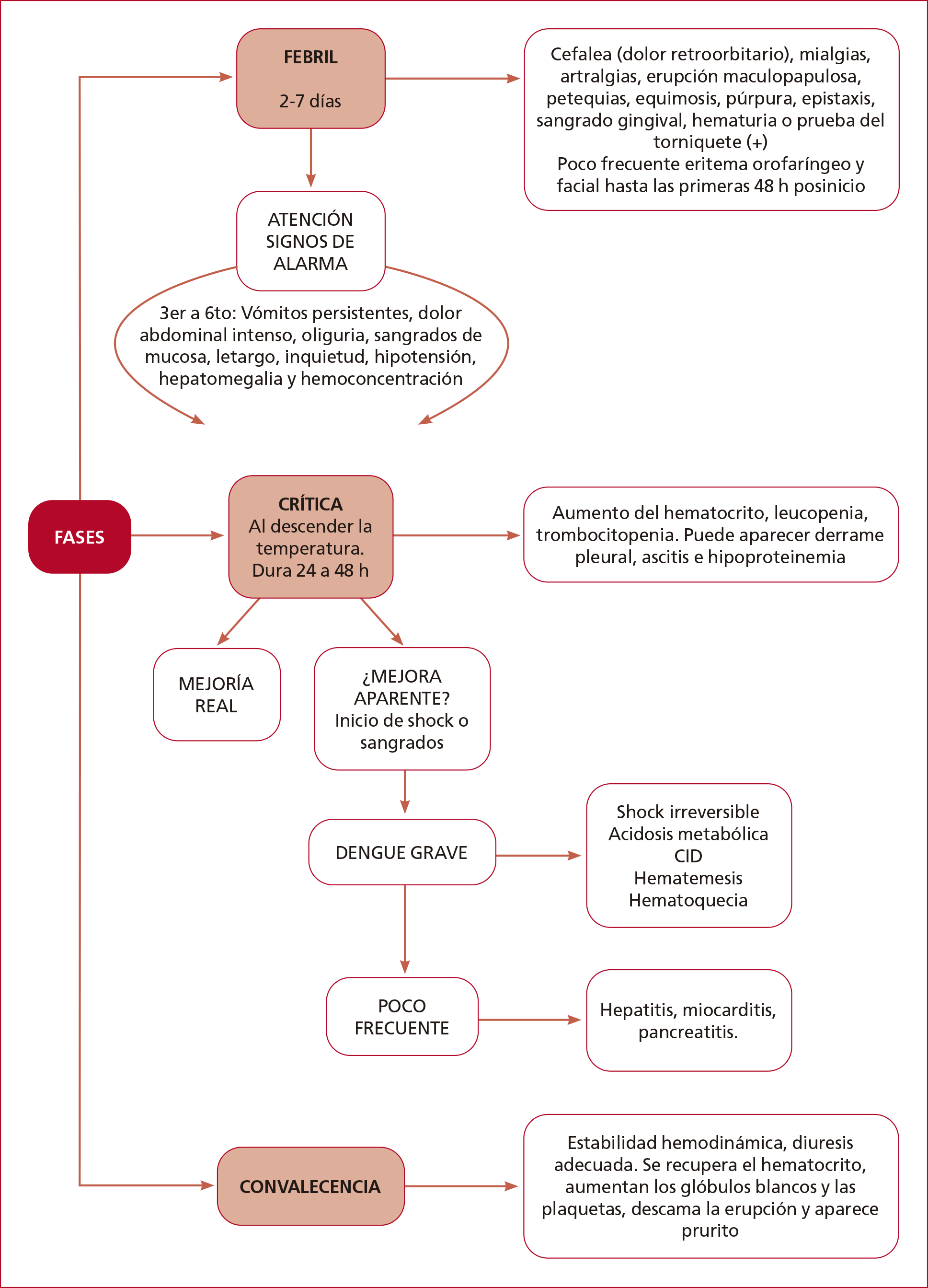
Figura 4. Fases clínicas del dengue grave según la evolución en el esquema clásico.
La progresión a dengue grave
generalmente se da en la fase febril tardía (del 4.° al 6.° día de evolución): vómitos
persistentes, dolor abdominal intenso, oliguria, sangrado de las mucosas,
letargo/inquietud, hipotensión postural, hepatomegalia y aumento progresivo del
hematocrito (por hemoconcentración).
Fase crítica
• Comienza cuando la fiebre desciende.
• La mayoría de los pacientes mejora
clínicamente durante esta fase. Pero algunos, en unas pocas horas, desarrollan
dengue grave.
• Inicialmente, los mecanismos
compensatorios fisiológicos mantienen una circulación adecuada. Si hay pérdida
importante de plasma puede haber derrames pleurales, ascitis, hipoproteinemia o
hemoconcentración.
• Los pacientes pueden parecer estar
bien, a pesar de los primeros signos de shock. Sin embargo, una vez que se
desarrolla hipotensión, la presión arterial sistólica disminuye rápidamente y
puede producirse un shock irreversible, acidosis metabólica, coagulación
intravascular diseminada y la muerte, pese a la reanimación.
• Pueden desarrollar manifestaciones
hemorrágicas graves, como hematemesis, hematoquecia o menorragia, especialmente
si han estado en shock prolongado. Las manifestaciones poco comunes incluyen
hepatitis, miocarditis, pancreatitis y encefalitis.
Fase de convalecencia
• Se inicia la reabsorción de los
líquidos extravasados y los derrames. El estado hemodinámico se estabiliza y
sobreviene la diuresis. El hematocrito se estabiliza o puede disminuir debido
al efecto de dilución del líquido reabsorbido. El recuento de glóbulos blancos
suele comenzar a aumentar, seguido de una recuperación del recuento de
plaquetas.
• La erupción en la fase de convalecencia
puede descamarse y ser pruriginosa.
• Si bien, en la fase crítica, la
hemorragia o el sangrado pueden producir shock, debe entenderse que el paciente
con dengue puede tener shock SIN sangrado, solo por el mismo dengue.
La enfermedad
se puede clasificar como Dengue Febril sin signos de alarma, Dengue Febril con
signos de alarma y Dengue Grave. Esta clasificación tenía una sensibilidad y un
valor predictivo negativo altos, pero una especificidad y un valor predictivo
positivo bajos. En la Figura 5, se presentan los signos y síntomas de cada tipo
de dengue.
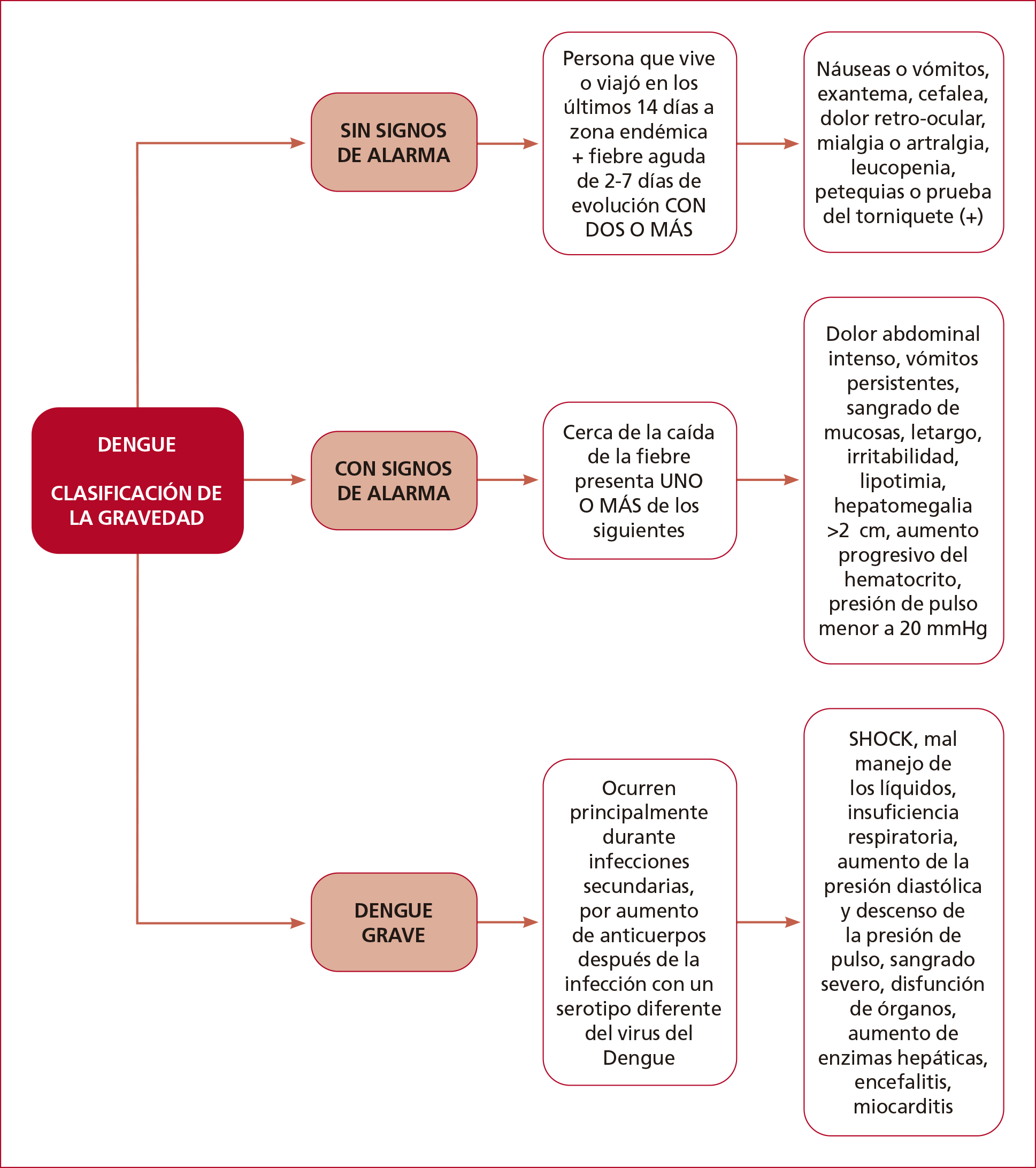
Figura 5.
Clasificación de la gravedad del dengue.10,11
2.1. Manifestaciones clínicas del dengue grave
Se define como aquel que provoca
cualquiera de las siguientes manifestaciones clínicas: fuga grave de plasma que
causa shock o acumulación de líquido, con dificultad respiratoria, sangrado
severo o insuficiencia orgánica grave, como hepatitis (transaminasas elevadas
≥1000 UI/l), alteración de la conciencia o insuficiencia cardíaca.11
El paradigma actual describe que los
casos graves de dengue ocurren principalmente durante infecciones secundarias,
esto puede suceder hasta muchos años después de la infección primaria, debido
al aumento de anticuerpos después de la infección por un serotipo diferente del
virus del dengue. Por otra parte, los títulos de anticuerpos neutralizantes del
dengue son significativamente más bajos en las infecciones primarias que en las
infecciones secundarias (p ≤0,0001).8 Estos últimos hallazgos cuestionan
la asociación con infecciones secundarias y enfatizan la importancia de
desarrollar vacunas o tratamientos para proteger a las poblaciones que no han
estado expuestas al dengue.12
Durante el dengue grave, aumenta la
permeabilidad vascular, con hemorragia o sin ella. En la etapa inicial del
shock, el mecanismo de compensación que mantiene normal la presión sistólica
también produce taquicardia y vasoconstricción periférica con reducción de la
perfusión de la piel, extremidades frías y llenado capilar enlentecido. De
forma única, el valor de la presión diastólica se acerca al de la presión
sistólica y la presión de pulso disminuye a medida que aumenta la resistencia
vascular periférica. Los pacientes en shock por dengue, a menudo, permanecen
conscientes y lúcidos; además, la presión sistólica puede ser normal y se puede
malinterpretar el estado crítico del paciente. Finalmente, llega la
descompensación y las dos presiones caen de forma abrupta. La hipotensión, a
menudo, se complica debido a un sangrado masivo.11
Los pacientes con dengue grave pueden
presentar alteraciones de la coagulación, aunque generalmente no son
suficientes para causar un sangrado masivo. Cuando ocurre un sangrado masivo,
casi siempre, se asocia con el shock grave, ya que, junto con la trombocitopenia,
la hipoxia y la acidosis, puede conducir a insuficiencia multiorgánica y a
coagulación intravascular diseminada. Puede ocurrir un sangrado masivo si el
paciente ha ingerido ácido acetilsalicílico, ibuprofeno o corticosteroides.11
Las manifestaciones menos frecuentes
pueden ser: insuficiencia hepática aguda, encefalopatía y miocardiopatía. Sin
embargo, la mayoría de las muertes por dengue ocurren en pacientes en shock
grave, sobre todo, si la situación se ha complicado por la sobrecarga de
líquidos.11
Paraná et al analizaron los factores de
riesgo asociados al dengue grave en América Latina, y hallaron los siguientes:
infección secundaria por dengue, sexo femenino, etnia blanca, y signos y
síntomas específicos, como cefalea, mialgia o artralgia, vómitos/náuseas, dolor
o sensibilidad abdominal, diarrea, postración, letargo, fatiga o similares.
Para el desenlace de muerte, los síntomas respiratorios y la edad <18 años
se identificaron como factores de riesgo. Por otro lado, en las mujeres, una
prueba del torniquete positiva, un recuento de plaquetas <100.000/μl y
síntomas de fragilidad capilar en el diagnóstico precoz se asociaron con una
menor probabilidad de muerte.13
Por otro lado, Arora et al, en un
estudio realizado en adultos, hallaron otros factores asociados a la
presentación de dengue grave: esplenomegalia, edema periorbitario, aumento de
la uremia y la creatinina, descenso de proteínas y albúmina, y los siguientes
hallazgos al ingresar en el hospital: anemia severa (hemoglobina <7 g/dl),
trombocitopenia (<50.000/dl), uremia elevada (>40 mg/dl), creatinina
elevada (>1,0 mg/dl), proteinemia baja (<6,0 g/dl) e hipoalbuminemia
(<2,0 g/dl).14 Estos datos resaltan la importancia del
cribado temprano de los pacientes.
Un signo precoz del escape importante
de líquidos es la disminución de la presión de pulso (diferencia entre la
presión sistólica y diastólica de 20 mmHg o menos), que se ha relacionado como
un marcador de gravedad. Por ello, es importante buscarlo. Se considera que un
paciente está en shock si la presión de pulso (es decir, la diferencia entre
las presiones sistólica y diastólica) es de 20 mmHg o menos, o si hay signos de
mala perfusión capilar (extremidades frías, llenado capilar lento o pulso
rápido y débil) en niños y en adultos. Debe tenerse en cuenta que, en los
adultos, la presión de pulso de 20 mmHg o menos puede indicar un shock más
grave. La hipotensión suele asociarse con shock prolongado que, a menudo, se
complica por un sangrado importante.
En pacientes pediátricos, también se
han identificado letargo, presión arterial sistólica <90 mmHg, tiempo de
llenado capilar >2 segundos, ascitis y hepatomegalia como factores de riesgo
clínico independientes asociados con dengue grave.15 Por otro lado, en algunos estudios, se
sostiene que el examen ecográfico de la vesícula también puede predecir el
dengue grave ante un engrosamiento de su pared.16,17
Así también, se han descrito múltiples
polimorfismos en los genes del sistema inmune que fueron marcadores tempranos
de la progresión del dengue en pacientes latinoamericanos. Los polimorfismos
del gen FNT-alfa tendrían un papel crítico en la patogenia del dengue.18
Un hallazgo importante, descrito por
Bongsebandhu-Phubhakdi et al, fue que los niveles de cortisol en el grupo con
dengue grave son más altos que en el grupo con dengue no grave, durante el
primer día de consulta. Se plantea la posibilidad de utilizar los niveles de
cortisol como un biomarcador potencial de la gravedad. Los niveles elevados de
cortisol (>18,2 µg/dl) predijeron dengue grave con una sensibilidad del
65,4% y una especificidad del 62,3%. El valor predictivo del cortisol sérico
aumentó hasta un 72% cuando se combinó con factores del modelo clínico, como el
día de fiebre y los vómitos persistentes.19
3. Manejo del dengue grave en Pediatría
3.1. Herramienta de triaje inicial.
Código Dengue
En los últimos años, se ha tornado
necesario el desarrollo de procesos estandarizados de diagnóstico para aquellas
enfermedades consideradas dependientes del tiempo que se tarda en reconocer.
Por lo tanto, es esencial establecer procesos para la detección precoz y la
aplicación estructurada de un conjunto de medidas basadas en la evidencia
existente, que permitan mejorar el pronóstico de los pacientes con enfermedades
críticas.
Así surge el concepto de Código
Dengue, que se suma a los existentes para otras enfermedades dependientes
del tiempo, como el “Código Infarto” o el “Código Ictus” o el “Código Sepsis”.
Esta herramienta tiene como objetivo identificar e iniciar oportunamente el
tratamiento en los pacientes con Dengue Grave.
La herramienta desarrollada está
compuesta por pasos que conducen a:
• Desencadenar alertas en diferentes
niveles de evaluación.
• Otorgar un nivel de triaje.
• Determinar el sitio de atención.
• Alertar al médico encargado, quien debe
evaluar al paciente y decidir el inicio de las medidas terapéuticas.
En los siguientes párrafos, se abordan
los pasos sugeridos. Cabe señalar que el Código Dengue propuesto tiene
coincidencias con las herramientas del Código Sepsis (Figura 6).
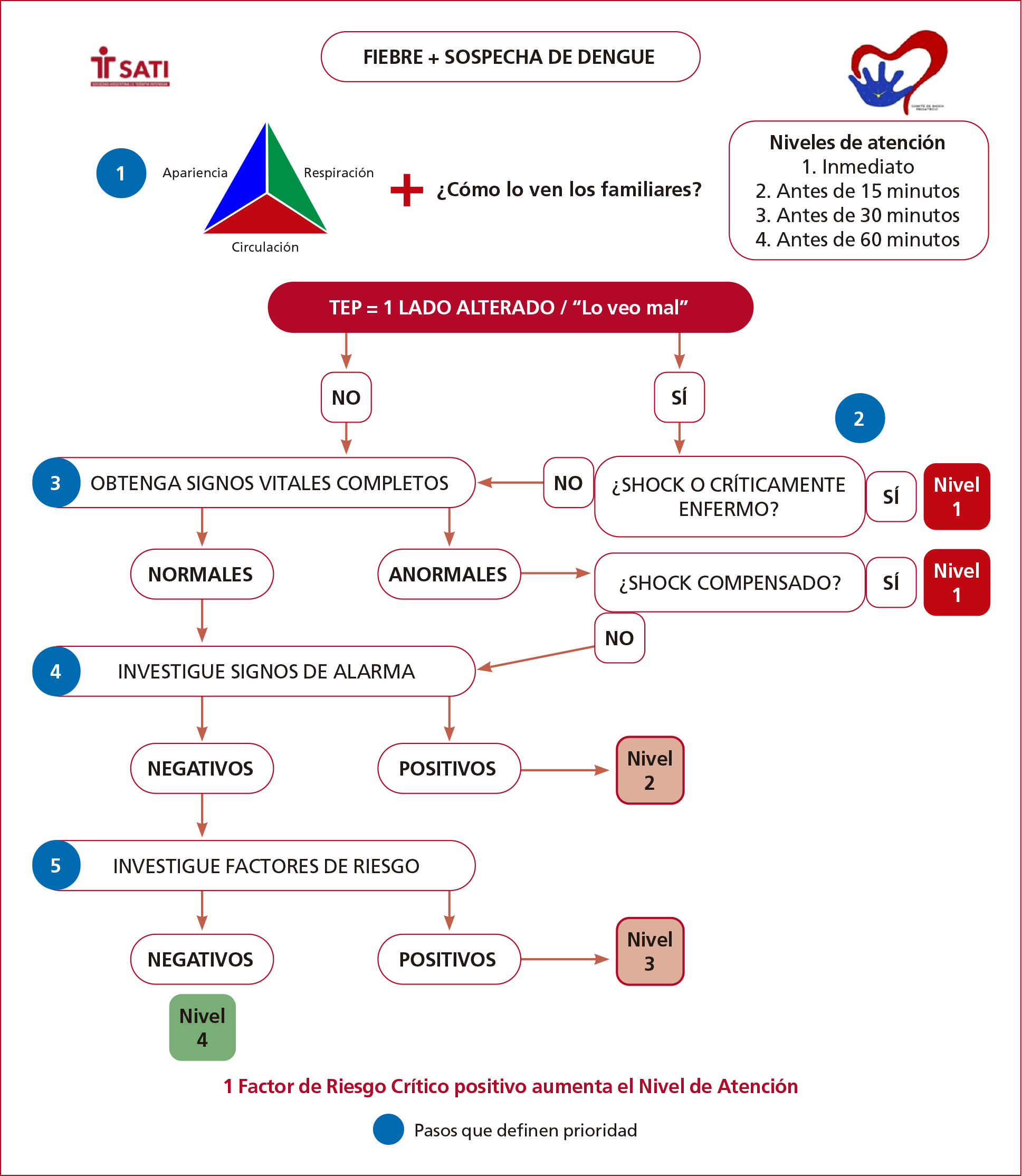
Figura 6. Algoritmo “Código Dengue” de elaboración propia de los autores.
Los pasos sugeridos son:
Paso 1
Se realiza la primera evaluación del
paciente. Para determinar la continuación del triaje a través de la herramienta
de activación de Código Dengue, se deben valorar los siguientes puntos:
1) Triángulo de Evaluación
Pediátrica (Tabla 3).
2) Preocupación de los cuidadores.
3) Evaluación de factores de riesgo
críticos (Tabla 4).
4) Hemograma con recuento de
plaquetas, función renal, función hepática y medio interno, durante la
evaluación de todo paciente con sospecha de dengue.
|
TABLA 3 Componentes del Triángulo de Evaluación Pediátrica20 |
||
|
Apariencia |
Circulación |
Respiratorio |
|
Aspecto Tono Actividad Conexión/Consolable Mirada Llanto/Palabras Somnolencia |
Coloración de la piel • Palidez • Piel moteada • Cianosis |
Mecánica • Retracciones • Aleteo nasal • Ruidos respiratorios anormales • Posición anormal para respirar |
TABLA 4
Factores de riesgo críticos
|
Factores de riesgo críticos • Paciente oncológico • Inmunosuprimido • Desnutrido grave • Neonato |
Se continuará con los pasos del Código
Dengue si:
• El Triángulo de Evaluación Pediátrica
muestra alteraciones en la circulación o en la apariencia.
• Los cuidadores expresan preocupación
porque consideran que el paciente no se encuentra bien.
• La fiebre más un factor de riesgo
crítico implica la necesidad de evaluar para detectar dengue grave por lo que
la herramienta es positiva y se activa la alerta.
Se finalizará
esta parte del Código Dengue si:
• El Triángulo de Evaluación Pediátrica
no muestra alteraciones en la circulación ni en la apariencia,
• No se identifica preocupación en los
padres.
• El paciente no tiene factores de riesgo
críticos.
Paso 2
Se busca identificar rápido a los
enfermos más graves, es decir, aquellos con shock descompensado o hipotensivo.
Por ello, en los pacientes que cumplen con los criterios para continuar
utilizando el Código Dengue, se evalúa primero si parece críticamente enfermo
según la percepción de quien realiza el triaje.
• Si la respuesta es afirmativa, se
activa el Código Dengue (herramienta positiva) y el paciente se clasifica como
nivel I para recibir atención inmediata.
Paso 3
En caso de que el paciente no tenga
shock descompensado/hipotensivo o que no se encuentre críticamente enfermo se
identifican los signos vitales en su totalidad.
• Si el paciente no parece críticamente
enfermo, deben observarse todos sus signos vitales. Si estos están alterados,
se lo ubica en el Nivel 1 (debe recibir atención inmediata) sobre todo, valorar
el estado hemodinámico.
• Si se considera que el paciente está en
shock compensado, se activa la alerta de Código Dengue (herramienta positiva) y
se lo clasifica como Nivel I para recibir atención inmediata.
• Siempre se busca identificar los
criterios clínicos que señalen la necesidad de una supervisión más estricta.
• Si el paciente no parece críticamente
enfermo y no está hipotenso, se evalúan:
Los demás criterios clínicos (Tabla 5):
- Frecuencia cardíaca
- Frecuencia respiratoria
- Estado mental
- Temperatura de la piel
- Llenado capilar
TABLA 5
Criterios clínicos
|
Criterios clínicos • Taquicardia • Taquipnea • Estado mental alterado • Piel moteada, fría, petequias • Relleno capilar anormal |
Paso 4
Se identifican los signos de alarma
(Tabla 6).
• Si el paciente no parece críticamente
enfermo, no está en shock, tiene signos vitales estables, pero presenta signos
de alarma, se lo ubica en el Nivel 2 (debe recibir atención antes de los 15
minutos).
• Un signo de alarma en un paciente con
los parámetros antes mencionados normales aumenta la prioridad de la atención
incrementando su nivel de triaje.
TABLA 6
Signos de alarma
|
Signos de alarma 1. Dolor abdominal intenso y continuo 2. Vómitos persistente (más de 3 veces en 1 hora) 3. Sangrado activo de mucosas 4. Hepatomegalia 5. Acumulación de líquidos 6. Aumento del hematocrito a. <2 años: >42% b. 2-12 años: >44% c. 13-18 años: i. Mujeres: >46% ii. Hombres: >50% 7. Plaquetopenia: <100.000 |
Paso 5
En los pacientes que no tuvieron puntos
positivos en el triaje, se identifican los factores de riesgo que señalan la
necesidad de una supervisión más estricta.
• Si tiene factores de riesgo positivos,
se lo ubica en el Nivel 3 (debe recibir atención antes de los 30 minutos).
• Si NO tiene factores de riesgo
positivos, se lo ubica en el Nivel 4 (debe recibir atención antes de los 60
minutos).
• En caso de que los puntos anteriores
sean negativos y, ante un paciente con fiebre y sospecha de dengue, evaluar:
- Los factores no críticos (Tabla
7).
- Si el paciente cumple dos
criterios clínicos o un criterio clínico más un factor de riesgo no crítico, se
activa la alerta de Código Dengue (herramienta positiva) y se lo clasifica como
Nivel 2, con atención prevista en los siguientes 15 minutos.
TABLA 7
Factores de riesgo no críticos
|
Factores de riesgo no
críticos • Enfermedad crónica • Dispositivos invasivos • Retraso del neurodesarrollo • Alto riesgo social • Cirugía reciente • Edad <6 meses |
Niveles de atención
Los niveles de atención señalados se
refieren al tiempo en que deben ser atendidos los pacientes debido al estadio.
Los niveles de atención sugeridos son:
• Nivel 1: Atención inmediata
• Nivel 2: Atención dentro de los 15
minutos
• Nivel 3: Atención dentro los 30 minutos
• Nivel 4: Atención dentro de los 60
minutos
3.2. Manejo propiamente dicho
3.2.1. Conceptos que considerar para el
manejo
Fisiopatología
Los mecanismos que conducen a las
manifestaciones graves de las infecciones por dengue probablemente sean
multifactoriales.
En el paciente con dengue crítico, el
endotelio vascular es el principal afectado. Todos los serotipos del virus del
dengue pueden replicarse activamente en las células endoteliales. Tanto el
virus como la proteína NS1 del dengue se adhieren al heparán sulfato de las
células endoteliales produciendo lesiones en ellas y en el glucocáliz. Además,
compromete células del sistema inmune (monocitos, macrófagos, células
dendríticas, linfocitos CD4+ y CD8+). Esta respuesta inmune, que está destinada
a controlar la infección, en ocasiones, se desregula produciendo una liberación
de citoquinas que conllevan a la lesión del endotelio y el glucocáliz, lo que
aumenta la permeabilidad capilar y provoca la fuga plasmática hacia el
intersticio de todos los órganos. La mayoría de los mediadores que aumentan la
permeabilidad vascular afectan la organización de las uniones adherentes, una
red compleja de proteínas de adhesión vinculadas al citoesqueleto intracelular,
esto provoca la retracción de las células endoteliales y la apertura de
espacios intercelulares.
Este aumento de la permeabilidad y de
fuga capilar también puede acompañarse de hipoalbuminemia y proteinuria, lo que
favorece aún más la extravasación de líquidos. Estos procesos son los
responsables de la ascitis, el derrame pleural y el edema (intestinal,
pulmonar, cerebral).
La lesión del endotelio también afecta
su importante función en la respuesta de coagulación tras una inflamación
sistémica grave. La interrupción de la interacción plaqueta-células
endoteliales puede llevar a una mayor fragilidad vascular y al desarrollo de
hemorragias.
El dengue crítico es, sobre todo, una
entidad de afectación multisistémica (Tabla 8).
TABLA 8
Manifestaciones multisistémicas
|
Sistema nervioso |
Convulsiones febriles Encefalopatía metabólica Encefalitis Meningitis aséptica Encefalomielitis diseminada aguda Síndrome de Guillain-Barré Hemorragia intracraneal Delirio y depresión |
|
Sistema respiratorio |
Derrame pleural masivo Síndrome de dificultad respiratoria aguda Hemorragia pulmonar |
|
Sistema cardiovascular |
Disfunción miocárdica Shock séptico resistente Arritmias (taquicardia supraventricular y bloqueo) Miocarditis Derrame pericárdico |
|
Sistema gastrointestinal |
Apendicitis
Pancreatitis
Peritonitis Hepatitis Hepatitis
fulminante Colecistitis alitiásica |
|
Sistema renal |
Insuficiencia renal aguda Síndrome urémico hemolítico |
|
Sistema hematológico |
Coagulación intravascular diseminada Sangrado visceral Hemorragias inusuales (hematuria, metrorragia, sangrado digestivo) |
|
Sistema muscular |
Rabdomiólisis Miositis |
Tratamiento (Figuras 7 y 8)
El manejo prudente de líquidos
es la piedra angular del tratamiento en la fase crítica del dengue, por eso
debe abordarse meticulosamente para restaurar el volumen intravascular sin
exacerbar la fuga de plasma.
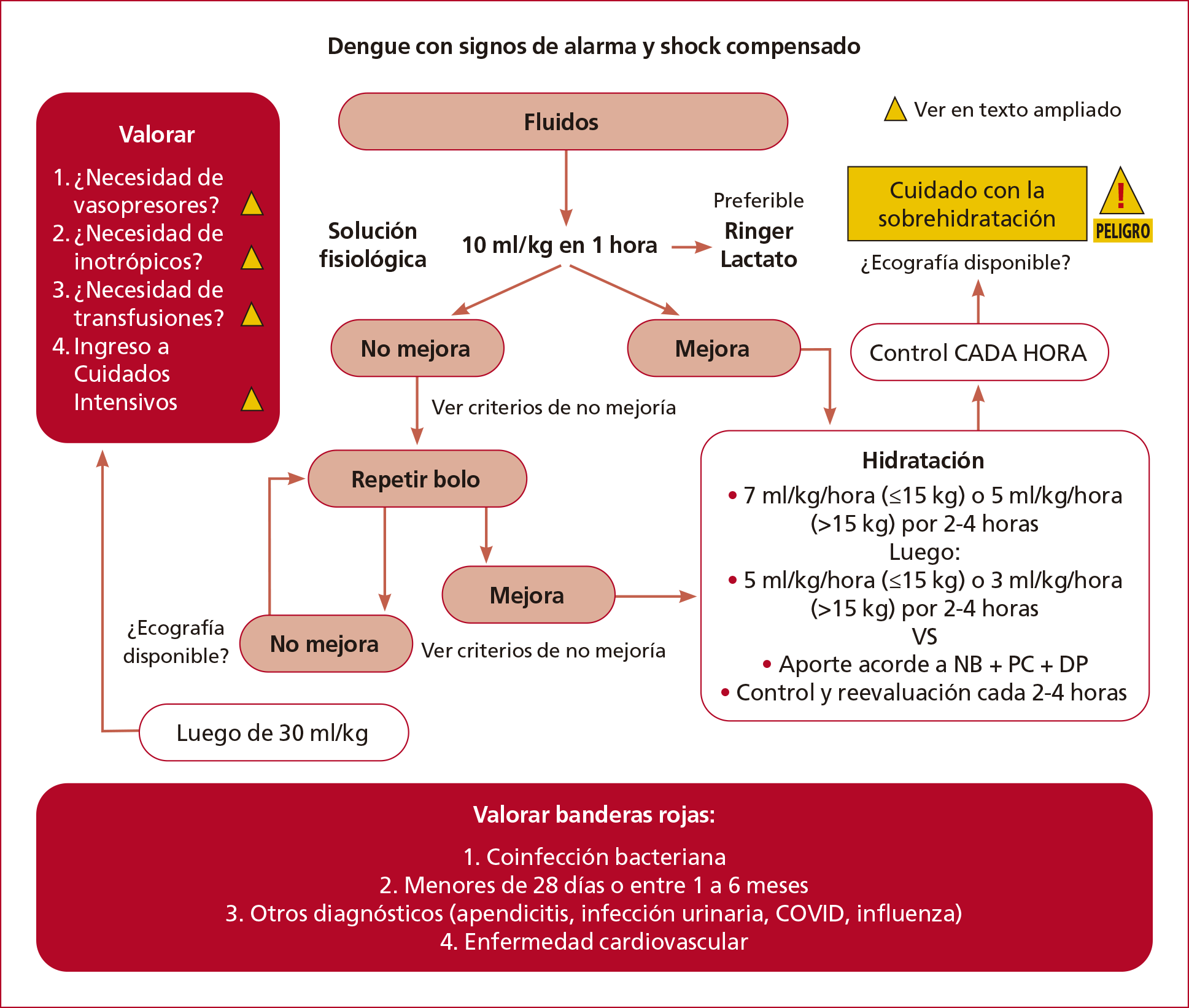
Figura 7. Algoritmo de Tratamiento del Dengue con shock compensado o con signos de alarma (Elaboración propia de los autores).
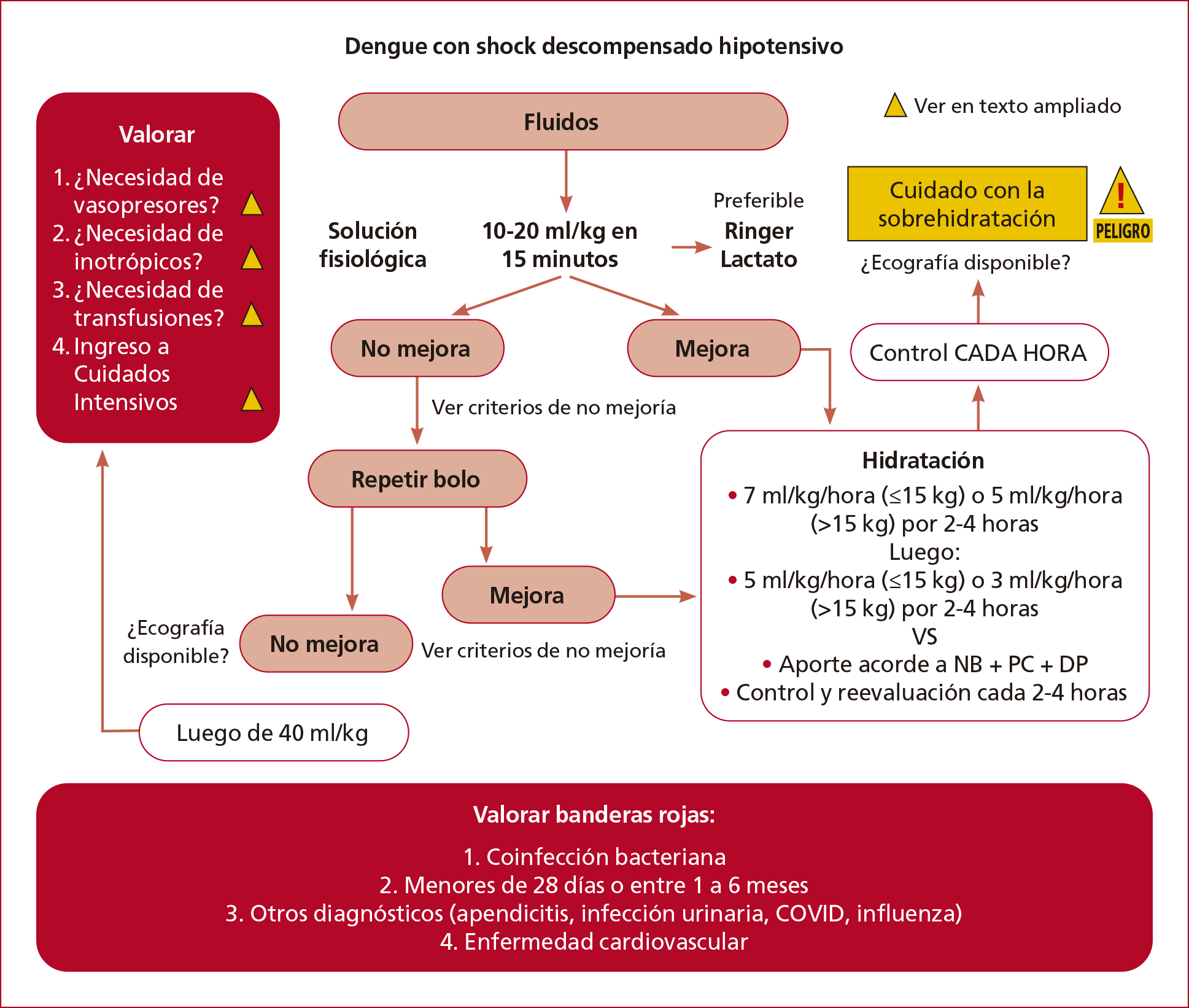
Figura 8. Algoritmo de Tratamiento del Dengue con shock descompensado/hipotensivo (Elaboración propia de los autores.)
El shock temprano se caracteriza por
signos de mala perfusión periférica (extremidades frías y llenado capilar
lento), precedido de hemoconcentración y plaquetopenia, lo que indica el
momento de iniciar la reanimación hídrica.
La fuga de plasma es el
principal mecanismo del shock en el dengue, y ocurre alrededor del momento de
la defervescencia.
Los síntomas pueden empeorar
bruscamente debido al aumento de la permeabilidad capilar.
La corrección del shock por dengue
tiene 2 fases.
• La fase 1 apunta a revertir el shock
con la rápida restauración del volumen de circulación efectivo (p. ej., dengue
grave del Grupo C-).
• La fase 2 tiene como objetivo mantener
la normovolemia, es decir, compensar el escape capilar continuo. Un problema
específico que se presenta en este estadio es la tendencia a la sobrecarga de
líquidos. En esta fase, el objetivo es tener un volumen circulatorio aceptable.
La respuesta a la reanimación con
líquidos debe guiarse por parámetros clínicos, sobre todo, para mantener una
buena perfusión y una diuresis de, al menos, 1 ml/kg/hora.
La reanimación inicial es con
cristaloides, no hay ninguna ventaja clínica del coloide sobre el cristaloide.
Administrar la terapia hídrica de mantenimiento con dextrosa en lactantes para
evitar la hipoglucemia, dado que suelen presentar rechazo del alimento. Además,
el agregado de sodio y potasio para lograr soluciones isotónicas.
El balance minucioso de ingresos y
egresos es la clave para el manejo adecuado de los fluidos en un paciente
pediátrico con dengue grave, durante la fase crítica.
Habitualmente se requieren fluidos
intravenosos por 24-48 horas.
Un ritmo diurético >3 ml/kg/h puede
ser un marcador temprano de sobrecarga hídrica. A partir de 2 ml/kg/h se
puede ir disminuyendo la infusión de líquidos para evitar la sobrecarga.
Una vez que se restablece la
estabilidad hemodinámica, se debe continuar administrando líquidos intravenosos
asegurándose de aportar el déficit previo más el mantenimiento de las
necesidades basales, a fin de garantizar la normohidratación.
Reducir los fluidos intravenosos
gradualmente cuando la gravedad del escape de fluidos disminuye. Esto ocurre al
final de la fase crítica donde se observa:
• Diuresis e ingesta oral de fluidos
adecuadas.
• Disminución del hematocrito por debajo de la línea de base en un
paciente estable.
El shock suele ser recurrente durante la fase crítica, un paciente
estabilizado requiere de una monitorización constante y revaluación frecuente.
Cuando un paciente no responde a las
medidas iniciales, es esencial detectar la variante fisiopatológica de
presentación mediante estudios complementarios, como la ecografía al lado de la
cama del paciente.
3.2.2. Manejo de fluidos
Los pacientes en quienes la herramienta
Código Dengue determinó la necesidad de tratarlo como Código Sepsis deben ser atendidos
de acuerdo con los niveles señalados antes. Luego, se recomiendan los
siguientes puntos:
1. Administración de oxígeno
(objetivo de saturación 92-95%).
2. Establecer un acceso venoso
periférico.
3. En pacientes con dengue con shock
descompensado o hipotensivo, administrar bolo de fluidos con Ringer lactato
(preferentemente) o solución fisiológica a 10-20 ml/kg en 15 minutos.
4. En pacientes con dengue con shock
compensado o signos de alarma, administrar bolo de fluidos con Ringer
lactato o solución fisiológica a 10 ml/kg en 1 hora.
REVALUAR
Si NO hay mejoría clínica
• Persisten los signos de alarma.
• La diuresis es <1 ml/kg/hora.
- Si continúa en shock
descompensado o hipotensivo, repetir la administración de Ringer lactato o
solución fisiológica a 10-20 ml/kg en 15 minutos.
- Si continúa en shock
compensado o con signos de alarma, repetir la administración de Ringer
lactato o solución fisiológica a 10 ml/kg en 30 minutos.
REVALUAR
• Si no mejora.
• Si persisten los signos de alarma.
• Si la diuresis <1 ml/kg/hora.
• Si se completaron 40 ml/kg en shock
descompensado o hipotensivo.
• Si se completaron 30 ml/kg en shock
compensado o con signos de alarma.
◦ Evaluación con ecografía (si se
dispone) para:
- Determinar la función cardíaca (necesidad
de inotrópicos/vasoactivos).
- Determinar el volumen
intravascular (necesidad de administrar más bolos de fluidos).
- Determinar si hay derrame
pericárdico o congestión pulmonar.
◦ Evaluación para:
- La infusión de albúmina 0,5-1
g/kg.21
- La necesidad de vasopresores/inotrópicos
si no se han iniciado (véase el punto 3.2.3.)
- La necesidad de transfusiones
(sangre entera, glóbulos rojos, plaquetas).
- La necesidad de asistencia
respiratoria mecánica.
• Considerar la necesidad de traslado a
la Unidad de Cuidados Intensivos (UCI).
• Considerar banderas rojas
- Coinfección bacteriana
- Menores de 28 días o entre 1 y 6
meses
- Otros diagnósticos (apendicitis,
infección urinaria, COVID, influenza)
- Enfermedad cardiovascular
Si HAY mejoría clínica
Durante el análisis con los expertos en
dengue grave, se presentaron dos estrategias tendientes al aporte de fluidos
luego de que el paciente haya tenido una mejoría clínica y no se encuentre en
shock. Estas pueden ser valoradas por cada institución de acuerdo con los
recursos o con las consideraciones sobre cuál de ellas es más pertinente.
• Comenzar con un plan hídrico parenteral
según la edad y el peso.
• En los pacientes obesos tomar el peso
ideal como parámetro para los cálculos.
Opción A:
Iniciar goteo a:
• 7 ml/kg/h (≤15 kg) o 5 ml/kg/h (>15
kg) por 2-4 horas
• Control y reevaluación cada 1-2 h y,
luego, si hay mejoría clínica, disminuir a:
• 5 ml/kg/h (≤15 kg) o 3 ml/kg/h (>15
kg) por 2-4 horas
• Control y revaluación cada 1-2 h y,
luego, si persiste la mejoría clínica, disminuir a:
• 3 ml/kg/h (≤15 kg) o 2
ml/kg/h (>15 kg) por 2-4 horas
Continuar
hasta que el paciente mejore y tolere la vía oral, con la precaución de no
sobrecargar de líquidos.
Opción B:
Aporte según las Necesidades Basales
(NB) + Pérdidas Concurrentes (PC) + Déficit Previo (DP).
• Control y revaluación cada 1-2 h y,
luego, disminuir el aporte según lo evaluado (NB + PC + DP).
REVALUAR
Si reaparecen los signos de hipovolemia
intravascular, REVALORAR.
3.2.3. Manejo inicial de inotrópicos y vasoactivos
Adrenalina: se indica en presencia de shock “frío”
(mala contractilidad cardíaca y vasoconstricción periférica), a una dosis
inicial de 0,05-0,1 µg/kg/min, para optimizar la contractilidad cardíaca. Con
la ecografía se observan: líneas B POCUS Pulmonar, vena cava inferior (VCI)
congestiva, contractilidad cardíaca inadecuada.
Noradrenalina: se indica si hay shock “caliente”
(vasoplejía periférica), a una dosis inicial de 0,1 µg/kg/min en adelante,
aumentando la vasoconstricción. Con la ecografía se observan: líneas A POCUS
pulmonar, VCI normal, contractilidad cardíaca normal.
Ambas catecolaminas pueden
administrarse por vía periférica: en este caso, se sugiere utilizar el
siguiente cálculo:
• 0,6 x peso del paciente (en kg) =
cantidad en mg de medicación diluida en 300 ml de dextrosa al 5% (o solución
fisiológica), que equivale a 0,03 µg/kg/min en una infusión a 1 ml/h (1 = 0,03
µg/kg/min)
Por ejemplo, para un paciente de
10 kg es igual a: 10 x 0,6 = 6 mg de adrenalina en 300 de solución que si se lo
coloca a 3 ml/h equivale a 0,09 µg/kg/minuto.
Si se dispone de una vía central
se priorizará ese acceso. En este caso, se sugiere utilizar el siguiente
cálculo para la administración:
• 0,6 x peso del paciente (en kg) =
cantidad en mg de medicación diluida en 100 ml de dextrosa al 5% (o solución
fisiológica), que equivale a 0,1 µg/kg/min en una infusión a 1 ml/h (1 = 0,1
µg/kg/min).
3.2.4. Monitorización
• Signos vitales en forma continua hasta
finalizada la fase crítica.
- Frecuencia cardíaca
- Frecuencia respiratoria
- Pulsos distales y centrales
- Tiempo de relleno capilar
- Temperatura
• Realizar un detallado balance de
ingresos y egresos (Horario).
• Diuresis horaria hasta 4-6 h de
finalizada la fase crítica.
• Análisis de laboratorio (Tabla 9)
- Hematocrito o hemograma completo
basal (sin retrasar el inicio de la hidratación).
- Solicitar, en forma repetida,
según decisión médica, si la clínica del paciente así lo sugiera, pero no para
guiar la fluidoterapia.
TABLA 9
Análisis clínicos
|
|
Ingreso |
Días posteriores |
|
Hematocrito |
Al ingreso Luego de la primera expansión Cada 12 h |
Cada 24 h si el paciente no está en shock |
|
Hemoglobina |
Al ingreso |
Cada 24 h si el paciente no está en shock |
|
Recuento de glóbulos blancos |
Al ingreso |
Según criterio médico |
|
Recuento de plaquetas |
Al ingreso Cada 12 h |
Cada 24 h si el paciente no está en shock |
|
Estado ácido base |
Al ingreso Cada 12 h o según criterio médico |
Según criterio médico |
|
Coagulograma |
Al ingreso |
Cada 24 h si el paciente no está en shock |
|
Ferritina |
Al ingreso (según disponibilidad) |
Según criterio médico |
|
Función renal (urea y creatinina) |
Al ingreso |
Cada 24 h si el paciente no está en shock |
|
Hepatograma |
Al ingreso |
Según criterio médico |
|
Albúmina |
Al ingreso |
Según criterio médico |
|
Ácido láctico |
Al ingreso (según disponibilidad) |
Cada 24 h si el paciente no está en shock |
|
Proteína C reactiva |
Al ingreso (según disponibilidad) |
Según criterio médico |
- Al ingresar en la UCI, solicitar
las siguientes determinaciones:
◦ Gases arteriales
◦ Ionograma sérico
◦ Glucemia
◦ Urea sérica
◦ Creatinina sérica
◦ Transaminasas
◦ Si se dispone, solicitar:
* Lactato
* Albúmina
* Troponina
* Ferritina
◦ Radiografía de tórax
◦ Ecografía torácica y abdominal
◦ Ecocardiograma
◦ Electrocardiograma
En los
pacientes críticos con dengue grave, tanto el lactato sanguíneo como el
cociente [lactato/bicarbonato (L/B)] tuvieron altos valores predictivos de
mortalidad. El cociente L/B tiene un mejor valor pronóstico que el modelo de
lactato, y debería considerarse un posible biomarcador pronóstico de uso
clínico para predecir la mortalidad hospitalaria de niños ingresados en la UCI pediátricos con dengue grave.22
La mejoría consiste en:
• La desaparición de los signos de
alarma.
• La remisión progresiva de la
sintomatología.
3.2.5. Manejo de la sobrecarga de líquidos
3.2.5.1. Generalidades
Las causas de la sobrecarga de líquidos
en la infección por dengue incluyen:
• La infusión excesiva o demasiado rápida
de líquidos intravenosos.
• El uso incorrecto de soluciones
cristaloides hipotónicas en lugar de isotónicas.
• El uso inadecuado de grandes volúmenes
de líquidos intravenosos en pacientes con sangrado grave no reconocido.
• La transfusión inadecuada de plasma
fresco congelado, concentrados de plaquetas y crioprecipitados.
• Continuar administrando líquidos
intravenosos después de que se haya resuelto la pérdida de plasma (24-48 h
después de la defervescencia).
• Las condiciones comórbidas, como
cardiopatía congénita, enfermedad pulmonar crónica y enfermedad renal.
• La sobrecarga de líquidos también puede
ocurrir en pacientes con pérdida significativa de líquidos.
Durante la recuperación, el líquido que
se ha perdido regresará al compartimento vascular y puede causar una sobrecarga
de volumen.
La sobrecarga de líquidos se puede
prevenir interrumpiendo los líquidos intravenosos en las siguientes
situaciones:
• Cesación de los signos de pérdida de
plasma, como lo sugiere la presión arterial estable, el volumen del pulso y la
perfusión periférica; y disminución del hematocrito en presencia de un buen
volumen del pulso.
• Ausencia de fiebre durante más de 24-48
h sin el uso de antipiréticos.
• Resolución de los síntomas
intestinales/abdominales.
• Mejoría de la diuresis.
• Sobrecarga de líquidos con estado
hemodinámico estable y paciente fuera de la fase crítica (más de 24-48 h de
defervescencia):
- Se deben suspender los líquidos
intravenosos, pero es necesario continuar con una estrecha vigilancia.
- Si es necesario, se puede
administrar furosemida oral o intravenosa 0,1-0,5 mg/kg/dosis, 1 o 2 veces por
día, o una infusión continua de furosemida 0,1 mg/kg/hora.
- Evaluar el uso de albúmina 0,5-1
g/kg, sobre todo, si la albúmina sérica está disminuida.21
- Se debe controlar el potasio
sérico y se debe corregir cualquier hipocalemia.
• Sobrecarga de líquidos con estado
hemodinámico estable, pero el paciente todavía está en una fase crítica:
- Los líquidos intravenosos se
deben reducir gradualmente.
- Se deben evitar los diuréticos
durante la fase de fuga de plasma, porque pueden provocar una depleción del
volumen intravascular.
- Los pacientes que permanecen en
estado de shock con niveles de hematocrito bajos o normales, pero muestran
signos de sobrecarga de líquidos pueden tener una hemorragia oculta.
- La infusión adicional de grandes
volúmenes de líquidos intravenosos por sí sola se asocia a mal pronóstico.
- Preferir una transfusión
cuidadosa de sangre fresca lo antes posible.
• Si el paciente permanece en estado de
shock y el hematocrito está elevado, se pueden administrar pequeños bolos
repetidos de una solución coloidal.
3.2.6. Manejo de hemorragias
3.2.6.1 Conceptos
La hemorragia secundaria al dengue
grave resulta de una compleja interacción entre factores virales, inmunológicos
y hemostáticos. A continuación, se presenta un resumen de los mecanismos
fisiopatológicos, basado en evidencia científica:
• Factores virales y daño endotelial
- El virus del dengue afecta
directamente al endotelio vascular, promoviendo un aumento en la permeabilidad
capilar y disrupción de la barrera vascular. Esto contribuye a la fuga de
plasma y, en casos graves, a la hemorragia.
- El virus también induce
apoptosis de células endoteliales, agravando el daño vascular.
• Inflamación e inmunopatogenia
- Tormenta de citoquinas: la
infección activa una liberación masiva de citoquinas proinflamatorias (IL-6,
FNT-alfa) que alteran la homeostasis hemostática.
- Anticuerpos facilitadores de
infección: en infecciones secundarias, los anticuerpos no neutralizantes pueden
facilitar la entrada del virus en células mononucleares, amplificando la
replicación viral y la respuesta inflamatoria.
- La activación de complemento
genera un daño tisular adicional y contribuye al desarrollo de coagulopatías.
• Trombocitopenia
- La disminución de plaquetas
(<150,000/mm3) es un hallazgo cardinal en el dengue
grave y ocurre por:
◦ Destrucción periférica: debido a
anticuerpos antiplaquetarios inducidos por el virus.
◦ Supresión medular transitoria:
infección directa de progenitores hematopoyéticos en la médula ósea.
◦ Secuestro esplénico: amplificado por
una respuesta inflamatoria generalizada.
• Disfunción plaquetaria
- Además de su disminución, las
plaquetas tienen una funcionalidad alterada debido al daño inducido por el
virus del dengue y al efecto de las citoquinas inflamatorias. Esto limita la
formación de coágulos efectivos.
• Coagulopatía
- Consumo de factores de
coagulación: el dengue grave puede desencadenar una coagulación intravascular
diseminada, reduciendo los niveles de fibrinógeno y factores, como el VIII y
IX.
- La activación desregulada del
sistema fibrinolítico agrava el riesgo de hemorragia severa.
• Fuga de plasma y shock
- La extravasación masiva de
plasma reduce el volumen intravascular y lleva al shock, lo que incrementa la
hipoxia tisular. Esta hipoxia puede exacerbar la fragilidad capilar y
desencadenar sangrados espontáneos, especialmente en mucosas y el tracto gastrointestinal.
• Otros factores predisponentes de
hemorragias graves:
- Las infecciones secundarias, el
uso de medicamentos anticoagulantes, el daño hepático y los cuadros comórbidos
(úlceras gástricas o nefropatías) aumentan la vulnerabilidad a la hemorragia.
3.2.6.2. Manejo propiamente dicho de
las hemorragias (Tabla 10)
TABLA 10
Criterios de administración de hemoderivados
|
Administración |
Situación |
Cantidad de plaquetas para transfundir |
|
Terapéutica |
Hemorragia activa por trombocitopenia |
Menos de 50.000/mm3 |
|
Profiláctica |
Cirugía ocular o sistema nervioso central |
Menos de 100.000/mm3 |
|
|
Otros procedimientos invasivos |
Menos de 50.000/mm3 |
|
Con factores de hiperconsumo de plaquetas |
Fiebre, infección secundaria, leucemia aguda |
Menos de 20.000/mm3 |
|
Sin factores de hiperconsumo |
Evaluar riesgos y beneficios* |
Menos de 10.000/mm3 |
* No transfundir solo por el valor de laboratorio.
• Cuando se produce una disminución
súbita del hematocrito, que no esté acompañada de mejoría del paciente, se
debe pensar que ha ocurrido alguna hemorragia importante y se debe considerar
la necesidad de transfundir glóbulos rojos (5-10 ml/kg), cuyos volúmenes pueden
repetirse según la evolución del paciente.
• Hay poca evidencia de la utilidad de
transfundir plasma en sangrados severos, por lo que es necesario evaluar la
coagulación del paciente a través del tiempo de protrombina (TP), el tiempo
parcial de tromboplastina activada (TTPa) y el fibrinógeno. Si existen datos
clínicos de sangrado y de laboratorio de coagulación intravascular diseminada
(fibrinógeno <100 mg/dl, TP y TTPa >1,5 veces el valor normal) se podrá
transfundir plasma fresco congelado a 10 ml/kg en 30 minutos (son situaciones
puntuales y según el criterio clínico).
• La trombocitopenia en un paciente con
dengue no es necesariamente un factor predictivo de sangrado, por lo cual no
está indicado el uso profiláctico de plaquetas. En caso de trombocitopenia
grave sin una hemorragia significativa, la transfusión de plaquetas no altera
el resultado.
• En caso de disponibilidad, se sugiere
realizar una tromboelastografía para un manejo más objetivo de la hemorragia.
- La tromboelastografía (TEG) y la
tromboelastometría (TEM) describen la interacción de los distintos componentes
de la coagulación, factores de la coagulación, plaquetas, fibrinógeno y sistema
fibrinolítico. Se evalúa, en tiempo real, la cinética y viscoelasticidad del
coágulo.
- Los parámetros que se miden en
los trazados de la TEG o la TEM son:
◦ Tiempo de coagulación (TEM) o tiempo de
reacción (TEG). Es el tiempo que transcurre desde el comienzo de la prueba (en
el que se agrega el activador de la coagulación) hasta el momento que alcanza
una amplitud de 2 mm. Es la rapidez de inicio de la formación de fibrina, que
es una medida de velocidad de la formación de la trombina. Depende de los
factores de la coagulación y anticoagulantes.
◦ Tiempo de la formación del coágulo
(TEM) o tiempo de apertura (TEG). Es el tiempo entre 2 mm y 20 mm de amplitud
de la señal de coagulación. Es la cinética de la formación de un coágulo
estable por la acción de la trombina generada, las plaquetas activadas por ella
y la fibrina. Los factores principales son la cantidad de trombina generada, la
cantidad de plaquetas, el nivel de fibrinógeno.
◦ Ángulo alfa: ángulo entre el
eje medio y la tangente de la curva de coagulación que atraviesa el punto de
amplitud de 2 mm.
◦ Firmeza máxima del coágulo (TEM) o
amplitud máxima (TEG). Mide la firmeza del coágulo y, por lo tanto, su calidad.
Factores influyentes son plaquetas, fibrinógeno y presencia de fibrinólisis.
◦ Valores A (x); firmeza del coágulo a un
cierto tiempo x después del CT (clotting time - tiempo de coagulación).
◦ Para su interpretación se recomienda
buscar asesoramiento con un especialista en hemoterapia.
Algoritmo de manejo del sangrado en el paciente con
dengue grave
Evaluar al paciente inicialmente.
¿El paciente presenta sangrado?
NO
Prevenir el sangrado:
• Reposo absoluto.
• Evitar traumatismos, procedimientos
invasivos [inyecciones intramusculares, sonda vesical o nasogástrica, catéteres
venosos] y el uso de AINE.
• Revaluar periódicamente.
SÍ
Continuar la evaluación.
• Clasificar la gravedad del sangrado.
- ¿Es un sangrado leve o moderado?
- ¿O es un sangrado grave?
Hemorragia leve o moderada
Ejemplos: epistaxis, gingivorragia,
petequias o equimosis sin inestabilidad hemodinámica.
• Control local del sangrado
(compresión).
• Hidratación adecuada según la fase
clínica.
• Monitoreo frecuente del hemograma y
coagulograma (cada 6-12 h).
• Evitar el uso de corticoides o
inmunoglobulina intravenosa.
• Revaluar constantemente.
Hemorragia grave
Signos de gravedad:
• Hematemesis, melena,
sangrado vaginal importante.
• Inestabilidad hemodinámica
(taquicardia, hipotensión).
• Descenso del hematocrito a pesar de la
reanimación.
Manejo inicial:
• Acceso venoso inmediato.
• Reposición inicial con solución
isotónica (véase Manejo de líquidos)
• Solicitar hemograma, coagulograma (TP,
TTPK, fibrinógeno). Pruebas viscoelásticas (TEG) en caso de disponer.
Manejo específico del sangrado grave:
Glóbulos rojos: se debe evitar esperar a que los
niveles de hemoglobina sean muy bajos antes de transfundir (p. ej., <7
g/dl), tal como se recomienda en otras situaciones, ya que, en el dengue, la
hemoconcentración puede enmascarar la gravedad del sangrado.
Dosis: 10-15 ml/kg
Plaquetas: los pacientes estables sin sangrado o
con sangrado leve, aun con recuentos <100.000/mm3 pueden solo guardar reposo, evitar traumatismos a fin de reducir el
riesgo y realizar control.
Dosis: 1 unidad por cada 5-10 kg de
peso o 10 ml por kg de peso.
Crioprecipitados:
Con fibrinógeno <100 mg/dl (con
sangrado) y <150-200 mg/dl (sin sangrado).
Dosis: 1 o 2 unidades cada 10 kg de
peso. Una unidad por cada 10 kg de peso eleva la concentración de fibrinógeno
objetivo 50 mg/dl aproximadamente.
Plasma fresco congelado: si el fibrinógeno es >150-200 mg/dl
y el control de la RIN, el TP o el TTPa >1,5 del valor normal, considerar
transfusión de plasma fresco congelado.
Dosis: 10 ml/kg.
En general, la administración de 1
ml/kg aumenta el TP aproximadamente un 1%.
Ácido
tranexámico: puede utilizarse en cualquier tipo de hemorragia, principalmente en
hemorragia de mucosas, como complemento de los hemoderivados.
Dosis: 10 mg/kg, cada 8-12 horas.
Complejo protrombótico: se recomienda en pacientes con
tratamiento previo antivitamina K para revertir rápidamente su efecto. No
emplear si la RIN es <1,5 (utilizar con RIN >2).
Dosis: 25 UI/kg asociadas a 10 mg de
vitamina K.
Luego del tratamiento específico, ¿el
paciente sigue inestable y con hemorragia activa?
• Reevaluar los parámetros de
coagulación. Coagulación intravascular diseminada presente: manejo
multidisciplinario; considerar hemoderivados adicionales según los parámetros.
• Valorar el uso de factor VII
recombinante en hemorragias masivas no controladas (dosis según protocolo
institucional).
• Monitorear continuamente la volemia
para evitar la sobrecarga de líquidos.
• En caso de sangrado digestivo, evaluar
soporte adicional. (Si se sospecha úlcera péptica o sangrado del tracto
digestivo alto, se administran inhibidores de la bomba de protones por vía
intravenosa, como omeprazol o pantoprazol, para disminuir la producción de
ácido gástrico y promover la hemostasia).
La endoscopia
temprana es controversial, pero puede ser crucial en algunos casos. Según
estudios recientes: identifica y trata lesiones específicas, como úlceras o
erosiones hemorrágicas, mediante métodos, como la aplicación de hemoclips,
inyección de adrenalina diluida o agentes térmicos. Aunque tradicionalmente se
evitaba por temor a agravar el sangrado, nuevas técnicas y equipos han
demostrado ser seguros en manos experimentadas.
NOTAS CLAVE
• Priorizar la prevención del shock como
medida clave para evitar hemorragias graves.
• Evitar procedimientos invasivos a menos
que sean absolutamente necesarios.
• Personalizar las decisiones basadas en
las características del paciente y el contexto clínico.
• Consultar a Hematología pediátrica si
surgen complicaciones severas.
3.2.7 Ecografía crítica en el punto de atención (Point of Care Ultrasound, POCUS)
El uso de la ecografía en áreas
críticas por profesionales de la salud ha demostrado aumentar la precisión de
la práctica clínica. En el contexto del dengue, la ecografía puede brindar
información válida que se integra al resto de la evaluación clínica.
Signos Prácticos para la Identificación temprana de
Dengue En Riesgo por Ecografía Rápida-Enfocada (SPIDDER-DEN) (elaboración de
Javier Ponce)
El protocolo se plantea con el objetivo
de rastrear los signos de alarma en pacientes con dengue. Se centra en
reconocer las acumulaciones patológicas de líquido en las cavidades corporales,
que son marcadores de signos de alarma en pacientes con dengue. Además,
busca identificar cambios en la pared de la vesícula biliar, hallazgo con alta
precisión para determinar un aumento de la permeabilidad vascular en pacientes
con dengue, considerado como un posible marcador de gravedad.
Siguiendo el enfoque POCUS se responden
preguntas binarias por ventana de exploración (Figuras 9 y 10):
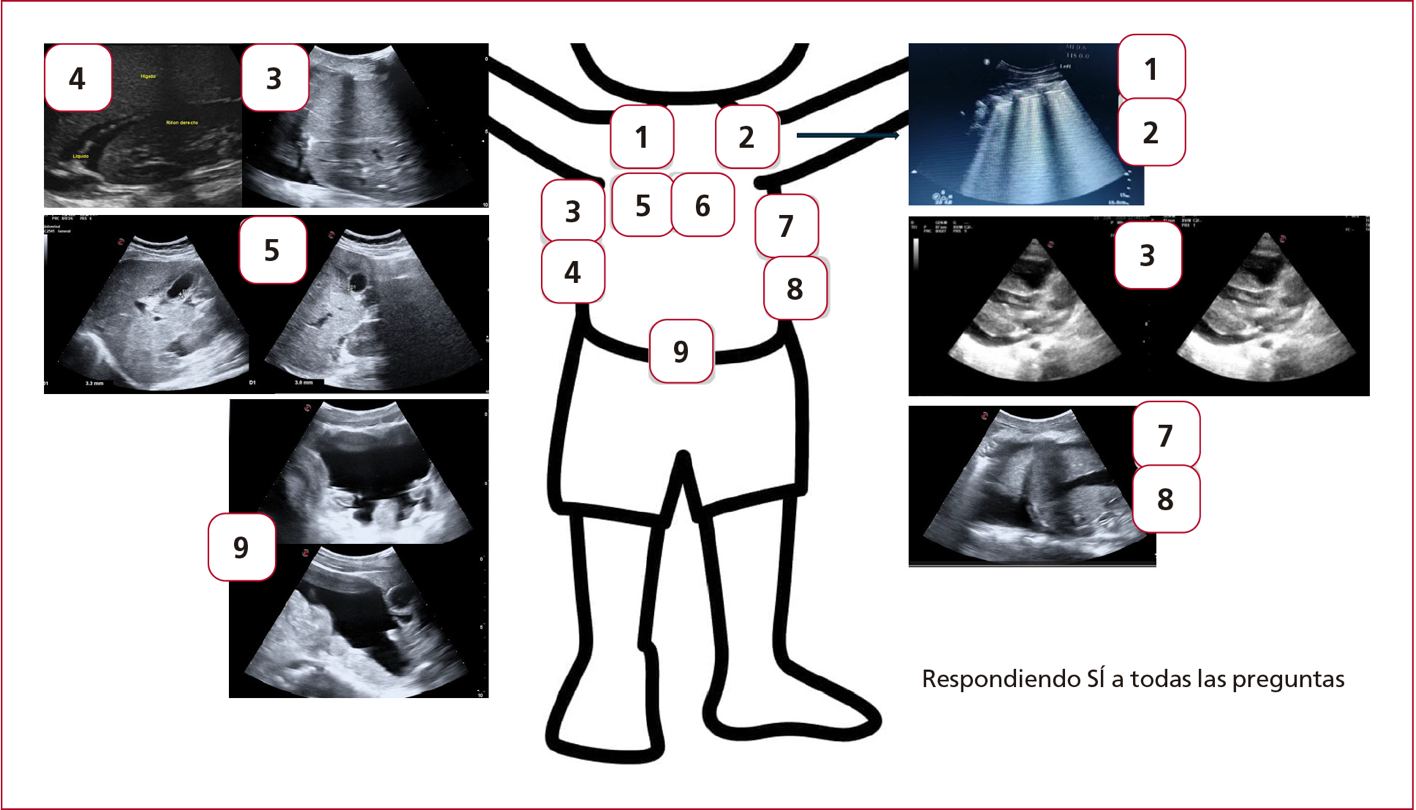
Figura 9. Ventanas de exploración. (Elaboración de Javier Ponce.)
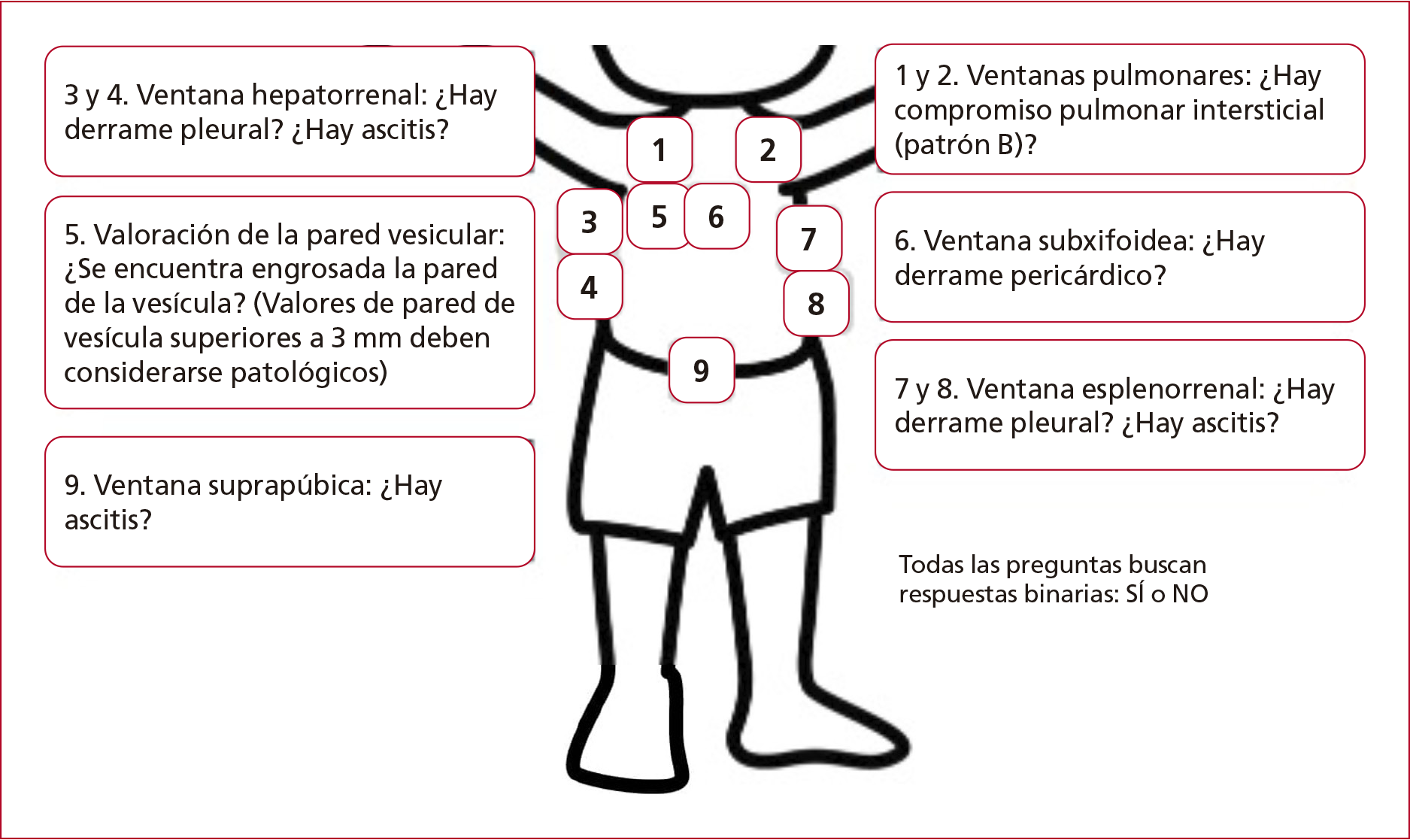
Figura 10. Preguntas para realizarse en los sitios ecográficos de exploración. (Elaboración de Javier Ponce.)
• POCUS y hemodinamia
El empleo de la ecografía en el
soporte hemodinámico de los pacientes críticos es una práctica habitual. En el
contexto del dengue grave, nos puede brindar información acerca de la precarga,
la contractilidad cardíaca y la sobrecarga hídrica.
• Evaluación de la contractilidad
cardíaca
El profesional con experiencia en POCUS desde una visualización
ecocardiográfica puede estimar la función sistólica del ventrículo
izquierdo.
La función sistólica se evalúa cuantitativamente mediante la fracción de
acortamiento (FA), la fracción de eyección (FEy) o el Doppler tisular. Se debe
tener en cuenta que un paciente hipovolémico puede tener una FA seudonormal, ya
que esta es afectada por la precarga.
Una FA <30% y una FE <45% pueden corresponder a una disfunción
sistólica del ventrículo izquierdo. La alteración diastólica del ventrículo
izquierdo se evalúa a través del Doppler transmitral y el Doppler tisular, una
E/A <1 o >2, e’ <0,8 y E/e´ <10 pueden ser signos de
disfunción.
Es recomendable cotejar las mediciones ecocardiográficas con percentiles
acordes a la edad y la masa corporal.
• Alteración de la volemia
A través de la evaluación de la
VCI, el corazón, el pulmón y el abdomen, podemos evaluar las situaciones de
hipovolemia y las de sobrecarga.
Signos de hipovolemia
• Colapso de la VCI >50% en pacientes
sin asistencia ventilatoria mecánica. Una distensibilidad >18% en pacientes
ventilados indica respuesta a fluidos.
• Signo de kissing ventricular (FA
>60%).
• Esto se acompaña de pulmones con patrón
A, si no hay una enfermedad concomitante.
Signos de sobrecarga hídrica
• VCI que no colapsa (colapso <30%),
en pacientes sin asistencia ventilatoria mecánica y sin disfunción cardíaca,
taponamiento cardíaco, ni neumotórax. VCI con distensibilidad baja,
pacientes con asistencia ventilatoria mecánica.
• Pulmón con patrón B.
• Líquido libre en cavidades.
• Flujo bifásico portal.
• Variación de la velocidad del flujo
aórtico baja (<18%).
La ecografía
a la hora de reanimar con fluidos a un paciente con dengue grave es útil para
diferenciar en quiénes mejorará el gasto cardíaco con las expansiones
(respondedores a fluidos) y quiénes no se perjudicarán con las expansiones,
pese a la respuesta (tolerantes a fluidos) (Tabla 11).
TABLA 11
Parámetros del POCUS
|
Parámetros |
|
|
Interpretación |
|
VCI |
Índice de colapso |
[(Dmáx-Dmín)/Dmáx] x 100 |
>55% sugiere la administración de líquidos |
|
|
Índice de distensibilidad |
[(Dmín-Dmáx)/Dmín] x 100 |
>18% indica que el paciente podría responder favorablemente a la administración de líquidos |
|
|
VCI/Ao |
Dmáx VCI/Dmáx Ac |
Un valor ≤1,3 podría indicar hipovolemia o una posible necesidad de reanimación con líquidos |
|
Pulmón |
Patrón B |
3 o más líneas B por campo de observación |
Puede corresponder a sobrecarga hídrica |
|
Corazón |
FEVI o FEy VI |
[(VTdVI-VTsVI)/VTdVI] x 100 |
Normal: >60% Disfunción leve: 40-59% Disfunción moderada: 30-39% Disfunción grave: <30% |
|
|
FAVI |
[(DdVI-DsVI)/DdVI] x 100 |
Normal: 25-45% Disfunción leve: 20-24% Disfunción moderada: 15-19% Disfunción grave: <15% |
|
|
VTI aórtico |
|
Variación de la velocidad con la respiración >18%: indica que el paciente podría responder favorablemente a la administración de líquidos |
Es importante tener en cuenta que, pese
a que determinemos que el paciente va a responder a fluidos (aumento del
volumen sistólico con la expansión), considerar la tolerancia a estos. Hay
factores que determinan una pobre tolerancia a fluidos, como:
• Insuficiencia diastólica
• Hipertensión abdominal
• Patrón B pulmonar
• Hipertensión venosa sistémica (flujo
portal, renal, suprahepático)
3.2.8. Aspectos especiales
3.2.8.1. Encefalopatía23
Alrededor del 10% de los pacientes con
dengue puede presentar alteraciones neurológicas durante la infección o
después, asociadas a la replicación viral en el tejido, a la respuesta
inmunológica local, a la disfunción endotelial y a signos hemorrágicos en el
sistema nervioso.
Los niños con encefalopatía aguda por
dengue suelen tener un estado de conciencia disminuido, que puede deberse a
factores subyacentes, como shock prolongado, hipoxia, edema cerebral,
hemorragia, anomalías metabólicas y enfermedad hepática aguda o insuficiencia
renal. El análisis del líquido cefalorraquídeo suele ser normal. El pronóstico
es variable. El manejo es de sostén haciendo énfasis en corregir las anomalías
metabólicas y hemodinámicas subyacentes.
Los niños con encefalitis por dengue
pueden presentar disminución de la conciencia, cefalea, convulsiones y déficits
neurológicos focales. Las características clínicas pueden ser indistinguibles
de las de la encefalopatía por otras causas.
La detección del virus del dengue
mediante reacción en cadena de la polimerasa, antígeno NS1 o anticuerpo IgM
contra el dengue en el líquido cefalorraquídeo es útil para el diagnóstico
diferencial. El análisis del líquido cefalorraquídeo puede revelar hiperproteinorraquia
y pleocitosis aumentada, asociadas, en la mayoría de los casos, a una glucosa
normal.
El líquido cefalorraquídeo puede ser
normal hasta en el 30% de los casos. Las características de los estudios de
neuroimágenes son inespecíficas, el edema cerebral es el hallazgo más común. Se
recomienda el tratamiento de soporte.
3.2.8.2. Insuficiencia respiratoria
En un estudio retrospectivo, la
incidencia de insuficiencia respiratoria aguda entre los niños con dengue grave
fue alta (43%). Más del 15% de acumulación de líquido durante las primeras 72
horas después del ingreso en la UCI pediátricos fue un factor de riesgo
independiente de insuficiencia respiratoria aguda.
Es necesaria una evaluación cuidadosa
del estado de hidratación y el equilibrio de líquidos. La atención debe
centrarse no solo en la ingesta de líquidos, sino también en su eliminación
excesiva para mitigar el riesgo de acumulación e insuficiencia respiratoria
aguda en el paciente con dengue grave.24
3.2.8.3. Miocardiopatía
La afectación cardíaca puede ser
consecuencia del efecto citotóxico directo del virus del dengue o de la exacerbación
de la respuesta inmune del huésped, que conduce a una mayor expresión de
citoquinas, que lesiona los tejidos del corazón.
El espectro clínico de disfunción
cardíaca varía desde pacientes con síntomas escasos hasta aquellos con
insuficiencia cardíaca congestiva, shock cardiogénico, arritmias, derrame
pericárdico, pericarditis y miocarditis (esta última reportada como poco frecuente,
aunque su incidencia real podría estar subestimada).
La bradicardia es el efecto cardíaco
más frecuente, de carácter benigno y transitorio. Otros hallazgos en el
electrocardiograma pueden ser taquicardia sinusal que persiste a pesar de la
corrección del shock, complejos QRS de bajo voltaje, aplanamiento del segmento
ST y la onda T. Además, puede haber alteraciones, como CPK-MB alta, elevación
de troponina T o hallazgos anormales en el ecocardiograma, por ejemplo, una FE
<50% o disminución de la FA.
Si la anormalidad cardíaca es
funcional, esta se resuelve espontáneamente sin tratamiento específico.
Se debe tener en cuenta la posibilidad
de miocardiopatía dilatada inducida por dengue si un paciente presenta shock
resistente asociado a signos y síntomas de insuficiencia cardíaca congestiva.
La evaluación objetiva de la función cardíaca puede utilizarse, de manera
eficaz, para guiar la terapia inotrópica. Algunos de los pacientes con dengue
pueden tener disfunción diastólica que puede mejorar con agentes lusitrópicos,
como la milrinona,
3.2.8.4. Hepatopatía25
La disfunción hepática por dengue es
común en niños. La prevalencia es mayor en la categoría más grave de infección.
El espectro de compromiso hepático varía desde una elevación leve de enzimas
hepáticas, generalmente transitoria y de buen pronóstico, hasta insuficiencia
hepática aguda y fulminante. Los valores de GOT se elevan con una frecuencia y
en una proporción mayor que los de GPT, lo que podría explicarse debido al
compromiso del virus en el sistema musculoesquelético.
La hepatitis por dengue es un cuadro
grave y puede haber un aumento exagerado de enzimas hepáticas superior a 10
veces el valor normal e ictericia. Este aumento en las pruebas de función
hepática se asocia con una enfermedad más grave, con más admisiones a la UCI
pediátrica y mayor mortalidad. También se presentan trastornos de la
coagulación (particularmente, prolongación del TP) y manifestaciones
neurológicas. Por todo ello, la evidencia indica claramente que se deben
incluir las pruebas de función hepática en la investigación de rutina para
comprender la gravedad de la enfermedad y el pronóstico.26
Los pacientes con insuficiencia
hepática aguda o fulminante deben ser monitorizados en una unidad de cuidados
críticos.
Se debe enfatizar en:
• Reconocer, en forma temprana, la
afectación hepática grave.
• Estabilizar el estado hemodinámico.
• Evitar los medicamentos hepatotóxicos,
incluido el paracetamol.
• Realizar una estrecha vigilancia de los
parámetros neurológicos.
3.2.8.5. Síndrome compartimental abdominal
En el paciente pediátrico, la
hipertensión intrabdominal se define como la elevación patológica sostenida
>10 mmHg de presión intrabdominal. El síndrome compartimental agudo
abdominal se define por una hipertensión intrabdominal >10 mmHg, asociada a
disfunción o falla de algún órgano nuevo.
El síndrome compartimental agudo
abdominal asociado a dengue se ha informado con poca frecuencia, lo cual puede
estar subestimado. La fuga de plasma que conduce a ascitis y aumento de la presión
intrabdominal puede desarrollarse rápidamente. Se puede sospechar su progresión
a síndrome compartimental agudo ante la alteración de los parámetros
circulatorios, la hipoxemia, la oliguria y empeoramiento de la acidosis.
Para más detalles sobre el monitoreo y
el tratamiento se sugiere revisar otros sitios.21
3.2.8.6. Insuficiencia renal
La hipoperfusión, la rabdomiólisis y la
hemólisis, además de los efectos directos del virus del dengue y la lesión
inmunomediada, pueden provocar insuficiencia renal en el paciente con dengue.
El tratamiento incluye una
administración juiciosa de líquidos para alcanzar una producción de orina
>0,5 ml/kg/h y una terapia de reemplazo renal temprana cuando esté indicada.27
3.2.8.7. Prácticas recomendadas y no recomendadas en
el paciente con dengue (Tabla 12)
TABLA 12
Prácticas recomendadas y no recomendadas en el paciente con dengue
|
|
Prácticas SÍ recomendadas |
Prácticas NO recomendadas |
|
1 |
Administrar volúmenes de líquidos intravenosos suficientes para mantener una circulación efectiva durante el período de extravasación de plasma, en pacientes con dengue grave |
Administración excesiva o prolongada de líquidos intravenosos a los pacientes con dengue grave |
|
2 |
Valoración clínica del estado hemodinámico antes de cada administración en bolo (cargas de líquidos) y después |
No hacer seguimiento de la respuesta de los pacientes con terapia de líquidos |
|
3 |
Uso de soluciones isotónicas en pacientes con dengue grave |
Uso de soluciones hipotónicas en pacientes con dengue grave |
|
4 |
Ajustar el tratamiento con líquidos intravenosos de acuerdo con la vigilancia de los signos vitales, la condición del paciente y la medición del hematocrito |
Mantener una velocidad fija de infusión de líquidos intravenosos y no modificarlos de acuerdo con los cambios en la vigilancia y los niveles de hematocrito en pacientes con dengue grave |
|
5 |
Detener o disminuir el tratamiento intravenoso cuando se consiga la estabilización hemodinámica del paciente |
No revaluar y continuar con el tratamiento de líquidos intravenosos después de la estabilización hemodinámica |
|
6 |
Monitorización invasiva (p. ej., presión arterial continua) y no invasiva (p. ej., POCUS en pacientes con dengue grave) |
No monitorizar a los pacientes con dengue grave |
|
7 |
Uso de drogas vasoactivas/inotrópicas en pacientes con shock persistente |
Continuar con la administración de líquidos en gran cantidad a pesar de la sobrecarga en pacientes con dengue grave |
Adaptada del
Programa Nacional de Prevención y Control de Dengue, Bolivia.28
Agradecimiento
A los doctores Pilar Arias y Ramiro Gilardino,
por sus invalorables sugerencias, aportes y guía para el proceso de
publicación.
4. Bibliografía
1.
Organización Panamericana de la Salud. Dengue: guías para la atención de enfermos en la región de las Américas, 2ª. ed.
Washington DC: OPS; 2016. Disponible en: https://iris.paho.org/handle/10665.2/28232
[Consulta: 7 de enero, 2025]
2.
Beceyro
AC. Distribución geográfica del dengue en Argentina. Boletín SEA 2009; 20(1-2): 1-4. Disponible en: https://seargentina.myspecies.info/sites/seargentina.myspecies.info/files/Bol.SEA20r_0.pdf
3.
Ministerio
de Salud. Boletín Epidemiológico Nacional 29. Argentina. 2024. Disponible
en: https://www.argentina.gob.ar/sites/default/files/2024/04/ben_714_se_29_vf.pdf
[Consulta: 7 de enero, 2025]
4.
Ministerio
de Salud. Boletín Epidemiológico Nacional 45. Argentina. 2024. Disponible
en: https://www.argentina.gob.ar/sites/default/files/2024/04/ben_730_se_45_vf_0.pdf
[Consulta: 7 de enero, 2025]
5.
Ministerio
de Salud. Boletín Epidemiológico Nacional 49. Argentina. 2024. Disponible
en: https://www.argentina.gob.ar/sites/default/files/2024/04/ben_734_se_49_vf.pdf
[Consulta: 7 de enero, 2025]
6.
Hill V, Cleemput S,
Pereira JS, Gifford RJ, Fonseca V, Tegally H, et al. A new lineage nomenclature
to aid genomic surveillance of dengue virus. PLoS Biol 2024; 22(9):
e3002834. https://doi.org/10.1371/journal.pbio.3002834
7.
Ministerio
de Salud. Plan de preparación y
respuesta integral a epidemias de dengue. Argentina. 2024. Disponible en: https://www.argentina.gob.ar/sites/default/files/2024/08/plan_de_preparacion_arbovirus_2782024.pdf
[Consulta: 7 de enero, 2025]
8.
Ministerio
de Salud. Materiales para equipos de salud. Argentina. 2024. Disponible en: https://www.argentina.gob.ar/salud/dengue/materiales-para-equipos-de-salud
[Consulta: 7 de enero, 2025]
9.
Ministerio
de Salud. Guía preliminar en revisión de dengue para el equipo de salud.
Argentina. 2024. Disponible en: https://www.argentina.gob.ar/sites/default/files/bancos/2020-11/Anexo-6-Guia-dengue-02-09.pdf
[Consulta: 7 de enero, 2025]
10. Sociedad
Argentina de Infectología (SADI). Guía para el Equipo de Salud sobre Dengue.
Argentina. 2015. Disponible en: https://www.sadi.org.ar/rss/item/713-guia-para-el-equipo-de-salud-sobre-dengue
[Consulta: 7 de enero, 2025]
11. Organización Mundial de la Salud. Dengue guías para el diagnóstico, tratamiento,
prevención y control: nueva edición. Washington, EE.UU.; 2009. Disponible en:
https://iris.who.int/handle/10665/44504
[Consulta: 7 de enero, 2025]
12. Aggarwal C, Ahmed H, Sharma P, Reddy ES, Nayak K,
Singla M, et al. Severe disease during both primary and secondary dengue virus
infections in pediatric populations. Nat
Med 2024; 30(3): 670-674. https://doi.org/10.1038/s41591-024-02798-x
13. Paraná VC, Feitosa CA, da
Silva GCS, Gois LL, Santos LA. Risk factors associated with severe dengue in
Latin America: A systematic review and meta-analysis. Trop Med Int Health 2024;
29(3): 173-191. https://doi.org/10.1111/tmi.13968
14. Arora SK, Nandan D, Sharma A, Benerjee P, Singh DP.
Predictors of severe dengue amongst children as per the revised WHO
classification. J Vector Borne Dis 2021; 58(4): 329-334. https://doi.org/10.4103/0972-9062.318312
15. Idrus NL, Md Jamal S, Abu Bakar A, Embong H, Ahmad NS. Comparison of clinical and laboratory characteristics
between severe and non-severe dengue in paediatrics. PLoS Negl Trop Dis 2023; 17(12): e0011839. https://doi.org/10.1371/journal.pntd.0011839
16. Castañeira CM, Mendoza DF. Hallazgos
ultrasonográficos en pacientes
diagnosticados con dengue con signos de alarma; Hospital Provincial Clínico Quirúrgico
Saturnino Lora Torres, 2022. Rev Científica Estud
UNIMED 2023; 5(3): 346. Disponible en: https://revunimed.sld.cu/index.php/revestud/article/view/346
17. Galindo Dávila JD, Gómez
Sandoval DM, Ardila Gómez IJ, Salgado García DM Ecografía en
dengue: 10 hallazgos claves. Acta Colomb Cuid Intensivo 2024; 24: 404-412.
Disponible en: http://www.elsevier.es/es-revista-acta-colombiana-cuidado-intensivo-101-avance-resumen-ecografia-dengue-10-hallazgos-claves-S0122726224000430
[Consulta: 7 de enero, 2025]
18. Salazar Flórez JE, Segura Cardona ÁM, Restrepo Jaramillo BN, Arboleda Naranjo M,
Giraldo Cardona LS, Echeverri Rendón ÁP. Immune
system gene polymorphisms associated with severe dengue in Latin America: a
systematic review. Rev Inst Med Trop Sao
Paulo 2023; 65: e58. https://doi.org/10.1590/S1678-9946202365058
19. Bongsebandhu-Phubhakdi C, Supornsilchai V,
Aroonparkmongkol S, Limothai U, Tachaboon S, Dinhuzen J, et al. Serum cortisol
as a biomarker of severe dengue. Trop Med Infect Dis 2023; 8(3): 146. https://doi.org/10.3390/tropicalmed8030146
20. American Academy of Pediatrics, American College of
Emergency Physicians. APLS: The
Pediatric Emergency Medicine Resource. 5th
ed. Massachusetts, EE.UU.: Jones and Bartlett Learning; 2012.
21. Ranjit S, Ramanathan G, Ramakrishnan B, Kissoon N.
Targeted interventions in critically ill children with severe dengue. Indian J
Crit Care Med 2018; 22(3): 154-161. https://doi.org/10.4103/ijccm.IJCCM_413_17
22. Nguyen Tat T, Vo Hoang-Thien N, Nguyen Tat D, Nguyen
PH, Ho LT, Doan DH, et al. Prognostic values of serum lactate-to-bicarbonate
ratio and lactate for predicting 28-day in-hospital mortality in children with
dengue shock syndrome. Medicine (Baltimore)
2024; 103(17): e38000. https://doi.org/10.1097/MD.0000000000038000
23. Shokeen P, Yadav S, Verma CR, Masand R. Neurological
complications in dengue fever. International Journal of Contemporary Pediatrics
2018; 5(3): 983-987. https://doi.org/10.18203/2349-3291.ijcp20181526
24. Preeprem N, Phumeetham S. Paediatric dengue shock
syndrome and acute respiratory failure: a single-centre retrospective study. BMJ
Paediatr Open 2022; 6(1): e001578. https://doi.org/10.1136/bmjpo-2022-001578
25. Chele-Choez
VE, LalvayArpi JM, Alcocer-Díaz S.
Disfunción hepática asociada a infección por virus dengue: estado del arte. Revisión sistemática.
Kasmera [Internet] 2021; 49(Supl. 1): e49S136423. https://doi.org/10.5281/zenodo.5588292
26. Avuthu OPR, Mishra A, Patil MG, Tandur BS, Salunkhe S,
Kumar G, et al. Association of liver function tests with the severity and
outcome of dengue fever in children. Cureus
2024; 16(8): e67700. https://doi.org/10.7759/cureus.67700
27. Tayal A, Kabra SK, Lodha R. Management of dengue: An
updated review. Indian
J Pediatr 2023; 90(2): 168-177. https://doi.org/10.1007/s12098-022-04394-8
28. Ministerio
Salud de Bolivia. Programa Nacional de Prevención y
Control de Dengue. Bolivia. 2017. Disponible en: https://www.asuss.gob.bo/wp-content/uploads/2023/02/459-Normas-diagnostico-y-Manejo-Clinico-del-Dengue.pdf
[Consulta: 7 de enero, 2025]