Carcinoma tímico avanzado con complicación
infecciosa: reporte de un caso
[Infected Thymic Carcinoma with Infectious
Complication: A Case Report]
Iris C. Portillo
Salazar,* Brunella Lusich
Servicio de Terapia Intensiva, Hospital
Interzonal General “Dr. José Penna”, Bahía Blanca, Buenos Aires, Argentina
* Correspondencia: iris.portillo.salazar@gmail.com
Las autoras no
declaran conflictos de intereses.
https://doi.org/10.64955/jratiy2025x874
Resumen
Se presenta el caso de una
paciente de 27 años con diagnóstico reciente de tumor de mediastino. Ingresó en
la unidad de terapia intensiva tras una intervención quirúrgica para intentar
resecar el tumor, que resultó irresecable debido a la alta infiltración en
grandes vasos. La biopsia reveló un carcinoma tímico de células escamosas.
Durante el seguimiento posoperatorio, se identificó una infección secundaria en
el tumor. Se detallan los hallazgos radiológicos, las decisiones terapéuticas y
el resultado.
Palabras clave: Carcinoma de timo; infección tumoral; tumor de
mediastino; carcinoma de células escamosas; complicaciones infecciosas.
Abstract
We present a 27-year-old female patient with
recent diagnosis of a mediastinal tumor. She was admitted to the intensive care
unit following a surgical attempt to resect the tumor, which turned out to be
unresectable due to extensive infiltration into large vessels. The biopsy
revealed squamous cell thymic carcinoma. During postoperative follow-up, a
secondary infection in the tumor was identified. Radiological findings,
therapeutic decisions, and the outcome are detailed.
Keywords: Thymic carcinoma; tumor infection; mediastinal
tumor; squamous cell carcinoma; infectious complications.
Introducción
El
carcinoma tímico es uno de los tumores epiteliales de timo que representan
alrededor del 0,2% al 1,5% de todas las neoplasias malignas.1 Dentro de los tumores epiteliales de timo, el
carcinoma tímico representa aproximadamente el 20%,2 y su presentación asociada con complicaciones
infecciosas es aún más infrecuente.
En la mayoría de los casos, los pacientes con carcinoma tímico son asintomáticos en el momento del diagnóstico.3 A diferencia de los timomas, el carcinoma tímico no se asocia con enfermedades paraneoplásicas autoinmunitarias.4 Un tercio de los pacientes tiene síntomas derivados del tumor o de las enfermedades paraneoplásicas, si las hay. Los signos clínicos más comunes son tos, disnea, dolor torácico, ronquera, parálisis del nervio frénico y manifestaciones clínicas sugestivas de síndrome de la vena cava superior.5 Para el diagnóstico y la estadificación del carcinoma tímico, es esencial realizar un examen físico minucioso, contar con una historia clínica detallada, radiografías de tórax y tomografía computarizada con contraste intravenoso que resulta útil para determinar el tamaño del tumor, su localización y la invasión a vasos sanguíneos, pericardio y pulmones.6 La tomografía computarizada también puede proporcionar indicios sobre el tipo histológico del tumor.7 Además, se emplean otras modalidades de imágenes, como la tomografía por emisión de positrones y la resonancia magnética.
El
diagnóstico diferencial del carcinoma tímico incluye diversas neoplasias
extratímicas, como tumores de células germinativas, linfomas, cáncer de pulmón,
tumores de estroma, tumores metastásicos y afecciones tímicas no neoplásicas,
por ejemplo, la hiperplasia tímica y los quistes tímicos.7,8 El carcinoma tímico puede
metastatizar a ganglios linfáticos regionales,
huesos, hígado, cerebro, pulmones y pleura, por lo que es pertinente realizar
una evaluación exhaustiva de los sitios de
posibles metástasis. El grado de invasión tumoral y el estadio del cáncer son
generalmente los factores más determinantes para predecir la supervivencia
global.7,9,10
Los carcinomas tímicos suelen estar en estadios avanzados cuando se diagnostican.11,12 Estos tumores tienen una mayor tendencia a invadir la cápsula tímica, metastatizar y recidivar que los timomas. Los pacientes con carcinoma tímico tienen un pronóstico más desfavorable que aquellos con timoma.13 El pronóstico depende de la invasión tumoral de la arteria braquiocefálica.12 La tasa de supervivencia a los 5 años de los pacientes con carcinoma tímico localmente avanzado e inoperable es del 24%.14
El tratamiento principal es la cirugía, mientras que la quimioterapia y la radioterapia se utilizan para tratar la enfermedad localmente avanzada. La terapia sistémica solo se indica si hay metástasis.1
Se describe un caso de carcinoma tímico avanzado con infección secundaria, situación que plantea un desafío diagnóstico y terapéutico importante.
Caso clínico
Mujer de 27 años, con antecedente de disnea de tres meses de evolución, tratada inicialmente como asma resistente al tratamiento, quien consulta al servicio de urgencias por disnea de clase funcional III. Se realiza una tomografía computarizada de tórax (Figura 1) que revela una masa tumoral heterogénea y de gran volumen en el mediastino, con efecto de masa en el lóbulo superior derecho desplazando grandes vasos hacia la izquierda e infiltrando el tronco braquiocefálico.
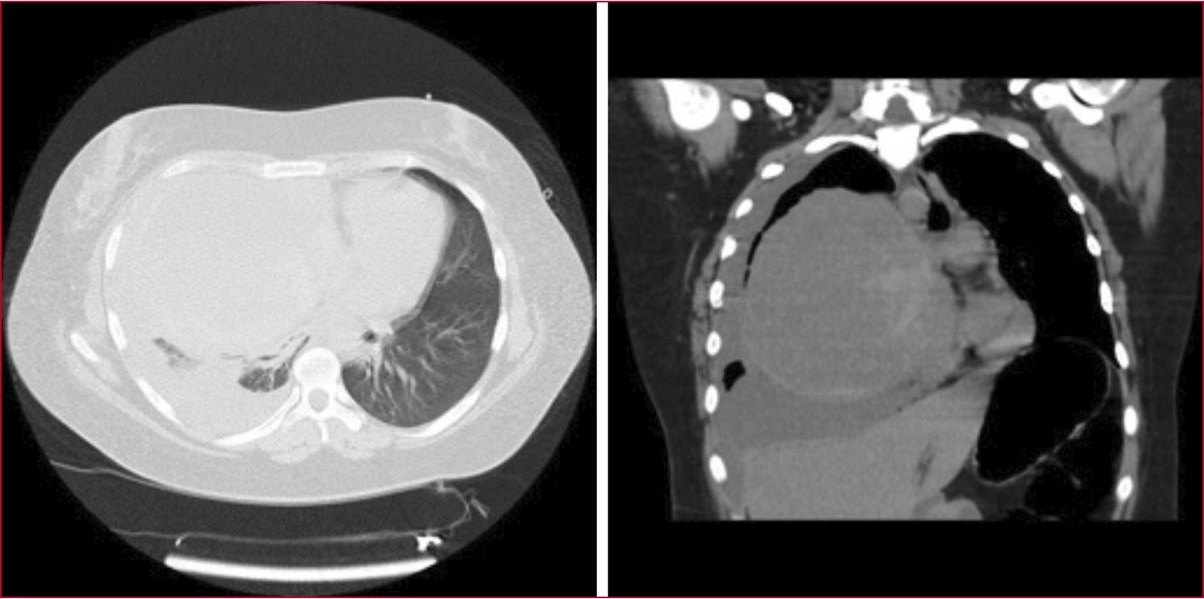
Figura 1. Tomografía computarizada de tórax. Se observa un mediastino levemente desviado hacia la izquierda, debido a una formación ubicada en el mediastino anterior, de paredes gruesas, con algunas calcificaciones aisladas y contenido líquido, de aproximadamente 130 x 118 mm. La imagen también muestra un derrame pleural derecho y líquido laminar perihepático.
Después de su estabilización, se decide la internación con un plan quirúrgico para la toma de biopsia programada. Junto con los estudios prequirúrgicos, se solicitan marcadores tumorales (CA 19-9, CA 125, alfa-fetoproteína, antígeno carcinoembrionario), que fueron negativos.
En las primeras 24 horas de internación, la paciente tiene insuficiencia respiratoria y requiere oxigenoterapia a alto flujo; también tiene inestabilidad hemodinámica y fiebre. Ante la progresión del cuadro clínico, ingresa, de urgencia, en el quirófano con el plan de resección tumoral. Durante la intervención, se observa un tumor cavitado de aproximadamente 20 x 10 cm, con infiltración a estructuras vasculares que compromete la aurícula derecha, la vena cava superior y los vasos subclavios. En la pleura, se detecta invasión en la cara anterior del pulmón, sin un plano de clivaje, con formaciones mamelonadas de tejido irregular y áreas de necrosis. Se toman múltiples biopsias y se envía una muestra a congelación, la cual revela la presencia de neoplasia. Posteriormente, las muestras fueron enviadas a anatomía patológica para análisis diferido y citometría de flujo. También se colocaron un drenaje K225 a la cavidad tumoral y un tubo de drenaje pleural derecho.
La paciente ingresa en la unidad de terapia intensiva hemodinámicamente inestable, con requerimientos de vasopresores a altas dosis, por lo que se mantiene bajo sedoanalgesia y conectada a asistencia respiratoria mecánica. Se solicita una radiografía de tórax de control (Figura 2).
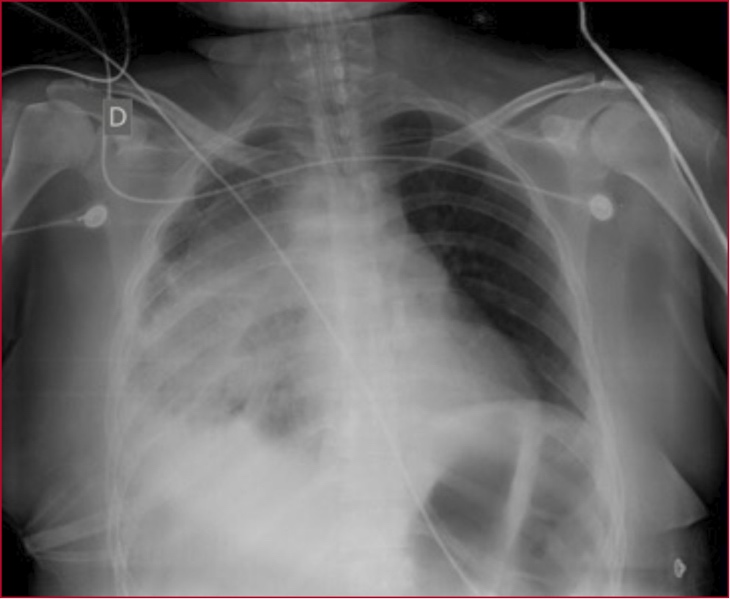
Figura 2. Radiografía de tórax de control posoperatorio. Se observa radiopacidad en el hemitórax derecho correspondiente a la zona del tumor, con ocupación del ángulo costofrénico debido al derrame pleural asociado.
Debido a las características purulentas del líquido pleural y tumoral, se decide iniciar un tratamiento antibiótico empírico con ampicilina y sulbactam. A los dos días de la cirugía, se recibe el informe de los cultivos de líquido proveniente de la masa mediastinal, que resultaron positivos para Escherichia coli y Salmonella sp., así como el del cultivo de líquido pleural que también era positivo para Salmonella sp. Según el antibiograma, todos los gérmenes eran sensibles a ampicilina y sulbactam, por lo que se continuó con el mismo esquema antibiótico.
Surgieron dificultades para la ventilación mecánica debido al aumento de las presiones en las vías aéreas por la compresión extrínseca a causa del tumor. Esta situación resultó particularmente compleja, ya que la obstrucción y la restricción de las vías aéreas como consecuencia de un efecto de masa que no puede ser abordado mediante técnicas convencionales de ventilación. En este contexto, se adoptó un enfoque ventilatorio que consideró tanto la obstrucción física de las vías aéreas como las dificultades para expandir adecuadamente los pulmones. La ventilación controlada por presión, en combinación con una estrategia de ventilación ultraprotectora (volumen corriente de 4-6 ml/kg de peso teórico), resultó ser una herramienta valiosa, pues permitió manejar, de manera más adecuada, las variaciones en la distensibilidad respiratoria generadas por la presión ejercida por el tumor en las vías aéreas. No obstante, la paciente desarrolló un síndrome de dificultad respiratoria aguda asociado a shock séptico, lo que empeoró su pronóstico y complicó más la toma de decisiones terapéuticas.
A pesar del esfuerzo multidisciplinario, la paciente falleció debido a un shock resistente e insuficiencia multiorgánica. El resultado de la biopsia, informado semanas después, confirmó la presencia de un carcinoma tímico de células escamosas (Figura 3).
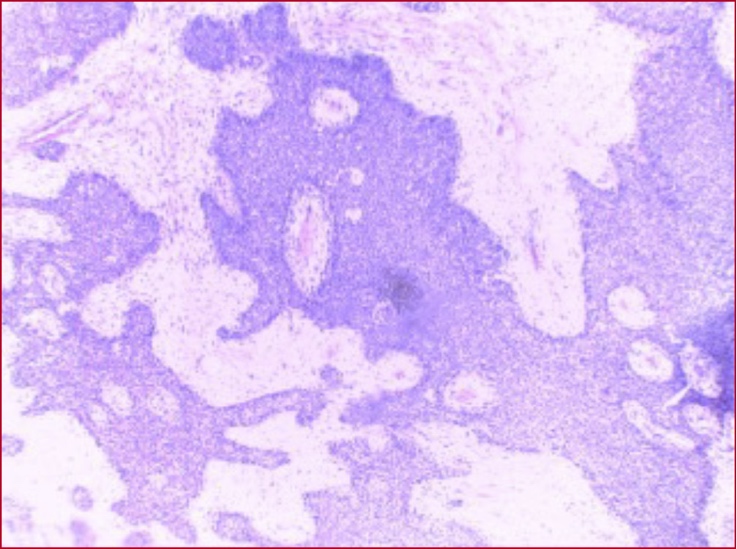
Figura 3. Corte histológico de la biopsia diferida. Se observan fragmentos tisulares compuestos por tejido fibroso y músculo estriado, en los cuales se identifica una proliferación de células escamosas monomorfas con atipia moderada, acompañada de focos de necrosis e infiltrados inflamatorios mixtos.
Discusión
El carcinoma tímico es una neoplasia rara y agresiva que se origina en el timo y el subtipo más frecuente es el carcinoma de células escamosas.15 Este tipo de carcinoma es, en general, asintomático en sus primeras etapas y su diagnóstico es más común en pacientes de entre 40 y 60 años de edad.16 Sin embargo, los casos en pacientes jóvenes, como el presentado aquí, son inusuales, lo que resalta la importancia de un diagnóstico temprano y una evaluación exhaustiva. Uno de los enfoques iniciales es el uso de estudios por imágenes que pueden revelar una masa mediastínica.17 No obstante, cabe destacar que estos estudios por sí solos no son suficientes para confirmar el diagnóstico. Se necesita una biopsia para tomar una muestra de tejido y realizar un examen histológico y molecular detallado.15
En este caso, la paciente de 27 años tenía disnea progresiva que inicialmente fue tratada como asma resistente. Sin embargo, la tomografía computarizada de tórax reveló una masa mediastínica de gran tamaño con infiltración a grandes vasos, lo que alertó sobre una posible neoplasia. El diagnóstico final de carcinoma tímico de células escamosas fue confirmado tras la biopsia posoperatoria. La intervención quirúrgica de urgencia también puso en evidencia una complicación infecciosa del tumor debido a la proliferación de múltiples tipos de bacterias. En cuanto a las infecciones asociadas al carcinoma tímico, los casos reportados son poco frecuentes. Estas infecciones se pueden atribuir a la supresión del sistema inmunológico causada por el propio tumor.
La cirugía es el enfoque principal, pero según el subtipo y la etapa de la enfermedad, puede ser necesario complementar con tratamientos adicionales, como radioterapia o quimioterapia.15 Además, es importante destacar la necesidad de adoptar un enfoque multidisciplinario en el diagnóstico y tratamiento del carcinoma tímico. La colaboración entre patólogos, oncólogos, radiólogos y cirujanos es esencial para obtener una evaluación integral y precisa de cada caso individual.
La dificultad en la ventilación mecánica
debido al aumento de la presión en las vías aéreas, secundaria a la compresión
extrínseca del tumor, es un desafío significativo en el manejo de estos
pacientes. El tumor mediastínico puede ejercer presión sobre estructuras
pulmonares y mediastínicas, especialmente los grandes vasos y la tráquea;
además, puede modificar la distribución del volumen pulmonar, incrementar la
heterogeneidad de la ventilación y aumentar el riesgo de lesiones pulmonares
inducidas por la ventilación mecánica (VILI, ventilator-induced lung injury),
como se describió en este caso. La elección de la ventilación controlada por
presión fue adecuada, ya que este modo de ventilación ayuda a controlar las
presiones máximas y mejorar la distensibilidad respiratoria,18 lo
cual es crucial cuando hay una obstrucción o compresión de las vías aéreas.
Esta modalidad combinada con la ventilación ultraprotectora favorece la
protección pulmonar al limitar los volúmenes corriente y las presiones pico,
algo esencial en pacientes con obstrucción tumoral significativa, reduciendo el
riesgo de barotrauma y volutrauma, y ayudando a mantener la oxigenación y
ventilación adecuadas.19
A pesar de la intervención quirúrgica y el manejo ventilatorio adecuado, la paciente desarrolló un síndrome de dificultad respiratoria aguda asociado a shock séptico, que complicó aún más el cuadro clínico. El síndrome de dificultad respiratoria aguda es una complicación común en pacientes críticos con insuficiencia respiratoria grave, especialmente aquellos con tumores malignos avanzados que pueden predisponer a infecciones secundarias, como en este caso, la infección por Escherichia coli y Salmonella sp., microorganismos aislados del cultivo de la masa mediastínica y del líquido pleural. Estas infecciones complicaron el pronóstico, porque contribuyeron al shock séptico y a la progresión hacia la insuficiencia multiorgánica.
Este caso pone de manifiesto la importancia de adoptar un enfoque multidisciplinario en el manejo de los tumores mediastínicos complejos. La combinación de cirugía, manejo ventilatorio especializado y tratamiento antibiótico, aunque no pudo evitar el desenlace fatal, permitió a los médicos proporcionar cuidados paliativos adecuados para manejar las complicaciones respiratorias y sistémicas.
El pronóstico de los pacientes con carcinoma tímico, especialmente cuando se presenta en etapas avanzadas e inoperables como en este caso, es generalmente pobre.16 Esto resalta la necesidad de una intervención temprana para identificar estos tumores antes de que lleguen a estadios tan avanzados, y la importancia de un enfoque integral para tratar tanto el tumor primario como las complicaciones derivadas.
Este caso también subraya la importancia de considerar el carcinoma tímico en el diagnóstico diferencial de masas mediastínicas, particularmente en pacientes jóvenes, y la necesidad de estar alertas ante complicaciones infecciosas que pueden agravar el estado clínico.
Conclusiones
El caso presentado resalta la complejidad del manejo de los pacientes con carcinoma tímico especialmente en etapas avanzadas e inoperables. La compresión extrínseca de las vías aéreas por el tumor, junto con las dificultades en la ventilación mecánica, planteó un desafío importante en el tratamiento.
La ventilación mecánica puede ser un desafío cuando hay una gran masa tumoral que afecta la distensibilidad pulmonar y dificulta la expansión adecuada de los pulmones durante la ventilación mecánica, lo que puede resultar en una ventilación ineficiente. Además, se produce un aumento de la resistencia al flujo de aire, porque una masa tumoral en las vías respiratorias o cerca de ellas puede provocar una obstrucción parcial o completa, que puede dificultar la entrega de aire durante la ventilación mecánica y requerir presiones más altas para superar la obstrucción. La aplicación de presiones elevadas durante la ventilación mecánica cuando hay una masa tumoral y una disminución de la distensibilidad pulmonar puede incrementar el riesgo de barotrauma, es decir, lesiones pulmonares causadas por una presión excesiva en los tejidos pulmonares.
A pesar de la intervención quirúrgica y la atención multidisciplinaria, las complicaciones infecciosas, como la septicemia por Salmonella sp., empeoraron el pronóstico y contribuyeron al desenlace fatal. Este informe subraya la importancia del diagnóstico temprano y el manejo integral para abordar tanto el tumor primario como las complicaciones asociadas, así como la necesidad de una evaluación constante de los pacientes con tumores mediastínicos complejos. Asimismo, destaca la importancia de considerar infecciones poco comunes en el contexto de tumores raros, porque pueden alterar, de manera significativa, la evolución clínica y el tratamiento.
Bibliografía
1.
Kelly RJ,
Petrini I, Rajan A, Wang Y, Giaccone G. Thymic malignancies: from clinical
management to targeted therapies. J Clin Oncol 2011; 29(36): 4820-4827. https://doi.org/10.1200/JCO.2011.36.0487
2.
Carter
BW, Benveniste MF, Madan R, Godoy NC, Groot PM, Truong MT, et al. IASLC/ITMIG
Staging System and Lymph Node Map for Thymic Epithelial Neoplasms.
Radiographics 2017; 37(3): 758-776. https://doi.org/10.1148/rg.2017160096
3.
Schmidt-Wolf
IG, Rockstroh JK, Schüller H,
Hirner A, Grohe C, Müller-Hermelink
HK, et al. Malignant thymoma: current status of classification and
multimodality treatment. Ann Hematol 2003; 82(2): 69-76. https://doi.org/10.1007/s00277-002-0597-6
4.
Padda SK,
Yao X, Antonicelli A, Riess JW, Shang Y, Shrager JB, et al. Paraneoplastic
syndromes and thymic malignancies: An examination of the International Thymic
Malignancy Interest Group Retrospective Database. J Thorac Oncol 2018; 13(3):
436-446. https://doi.org/10.1016/j.jtho.2017.11.118
5.
Rajan A,
Giaccone G. Treatment of advanced thymoma and thymic carcinoma. Curr Treat
Options Oncol 2008; 9(4-6): 277-287. https://doi.org/10.1007/s11864-009-0083-7
6.
Sperling
B, Marschall J, Kennedy R, Pahwa P, Chibbar R. Thymoma: a review of the
clinical and pathological findings in 65 cases. Can J Surg 2003; 46(1): 37-42.
PMID: 12585792
7.
Rosai J. Histological
typing of tumours of the thymus. 2nd ed. Berlin:
Springer-Verlag; 1999. https://doi.org/10.1007/978-3-642-60157-6_2
8.
Strollo
DC, Rosado-de-Christenson ML. Tumors of
the thymus. J Thorac Imaging 1999; 14(3): 152-171. https://doi.org/10.1097/00005382-199907000-00002
9.
Okumura
M, Ohta M, Tateyama H, Nakagawa K, Matsumura A, Maeda H, et al. The World Health Organization histologic
classification system reflects the oncologic behavior of thymoma: a clinical
study of 273 patients. Cancer 2002; 94(3): 624-632. https://doi.org/10.1002/cncr.10226
10. Chen G, Marx A, Wen-Hu C, Yong J, Puppe B, Stroebel P,
et al. New WHO histologic classification predicts prognosis of thymic
epithelial tumors: a clinicopathologic study of 200 thymoma cases from China. Cancer
2002; 95(2): 420-429. https://doi.org/10.1002/cncr.10665
11. Ogawa K,
Toita T, Uno T, Fuwa N, Kakinohana Y, Kamata M, et al. Treatment and prognosis of thymic carcinoma: a retrospective analysis of
40 cases. Cancer 2002; 94(12): 3115-3119. https://doi.org/10.1002/cncr.10588
12. Blumberg D, Burt ME, Bains MS, Downey RJ, Martini N,
Rusch V, et al. Thymic carcinoma: current staging does not predict prognosis. J
Thorac Cardiovasc Surg 1998; 115(2): 303-308; discussion 308-309. https://doi.org/10.1016/S0022-5223(98)70273-9
13. Eng TY, Fuller CD, Jagirdar J, Bains Y, Thomas CR Jr.
Thymic carcinoma: state of the art review. Int J Radiat Oncol Biol Phys 2004;
59(3): 654-664. https://doi.org/10.1016/j.ijrobp.2003.11.021
14. Kondo K, Monden Y. Therapy for thymic epithelial
tumors: a clinical study of 1,320 patients from Japan. Ann Thorac Surg. 2003
Sep;76(3):878-84; discussion 884-5. https://doi.org/10.1016/s0003-4975(03)00555-1
15. Girard N, Ruffini E, Marx A, Faivre-Finn C, Peters S;
ESMO Guidelines Committee. Thymic epithelial tumours: ESMO Clinical Practice
Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 Suppl 5:
v40-55. https://doi.org/10.1093/annonc/mdv277
16. Ahmad U, Yao X, Detterbeck F, Huang J, Antonicelli A,
Filosso PL, et al. A thymic carcinoma outcomes and prognosis: results of an
international analysis. J
Thorac Cardiovasc Surg 2015; 149(1): 95-100, 101.e1-2. https://doi.org/10.1016/j.jtcvs.2014.09.124. Erratum
in: J Thorac Cardiovasc Surg 2016; 151(4):1220.
17. Marom EM,
Milito MA, Moran CA, Liu P, Correa AM, Kim ES, et al. Computed tomography findings predicting invasiveness of thymoma. J
Thorac Oncol 2011; 6(7): 1274-1281. https://doi.org/10.1097/JTO.0b013e31821c4203
18. Marik PE, Krikorian J. Pressure-controlled ventilation
in ARDS: a practical approach. Chest 1997; 112(4): 1102-1106. https://doi.org/10.1378/chest.112.4.1102
19. Regunath H, Moulton N, Woolery D, Alnijoumi M,
Whitacre T, Collins J. Ultra-protective mechanical ventilation without
extra-corporeal carbon dioxide removal for acute respiratory distress syndrome.
J Intensive Care Soc 2019; 20(1): 40-45. https://doi.org/10.1177/1751143718774712