Neumonía asociada a ventilación mecánica.
Actualización y consenso intersociedades, Sociedad Argentina de Infectología –
Sociedad Argentina de Terapia Intensiva 2024
[Ventilator-associated pneumonia. Update and intersociety consensus, Argentine Society of
Infectology – Argentine Society of Intensive Therapy 2024]
Wanda Cornistein,1*+^ Yanina Nuccetelli,2*^ Emilio F. Huaier
Arriazu,3* Mónica Lares,2+ María Cecilia
García,2+ Ana Laura González,2+ Norma Cudmani,4* Marco Flores
Montes,5+ Laura De Aguilar,6* Analía De
Cristófano,3* Miriam Blanco7+
1Hospital Universitario Austral, Buenos Aires; 2Hospital Interzonal General de Agudos San
Martín, Buenos Aires; 3Hospital Italiano de Buenos Aires, Buenos
Aires; 4Ministerio de Salud de Tucumán, Tucumán; 5Hospital Dr. Francisco J. Muñiz, Buenos Aires;
6Hospital Interzonal
General de Agudos Eva Perón, San Martín, Buenos Aires; 7Hospital de Alta Complejidad en Red El Cruce,
Dr. Néstor Kirchner, Buenos Aires, Argentina
* Comisión de Infecciones Asociadas a los
Cuidados de la Salud, Sociedad Argentina de Infectología
+ Comité de Infectología Crítica, Sociedad
Argentina de Terapia Intensiva
^ INVERA (Investigación en Resistencia
Antimicrobiana)
* Correspondencia: wandacornistein@gmail.com
https://doi.org/10.64955/jratiy2025x981
Resumen
Representantes de la Sociedad Argentina de
Infectología (SADI) y la Sociedad Argentina de Terapia Intensiva (SATI) se
unieron para desarrollar un consenso sobre el diagnóstico, tratamiento y
prevención de la neumonía asociada a ventilación mecánica (NAVM). La
metodología empleada consistió en un análisis cualitativo de la evidencia
publicada desde la última actualización en 2018, complementado con la opinión
de expertos y datos locales.
Este documento actualiza la incidencia y
epidemiología de la NAVM, aborda las limitaciones del diagnóstico clínico y
explora el rol de la ecografía pulmonar. Además, analiza las ventajas y
desventajas de los biomarcadores, así como los métodos de identificación
microbiológica rápida para optimizar el diagnóstico. Se incluyen las opciones
terapéuticas de elección para el tratamiento empírico y dirigido, divididas en
tratamientos preferentes y alternativos, y se establece la duración óptima del
tratamiento. Finalmente, se resume la evidencia disponible sobre la prevención
de la NAVM y la implementación de paquetes de medidas para reducir su
incidencia.
El trabajo conjunto de ambas sociedades,
infectólogos e intensivistas, pone en evidencia la preocupación por el manejo
de la NAVM y la importancia de velar por la mejora en las prácticas cotidianas.
A través de este consenso se han acordado
pautas locales para optimizar el diagnóstico, tratamiento y prevención de la
NAVM con el objeto de disminuir el impacto de esta infección en los pacientes
internados en unidades de cuidados críticos.
Palabras clave: neumonía, ventilador, diagnóstico,
tratamiento, prevención.
Abstract
Representatives from the Argentine Society of
Infectology (SADI) and the Argentine Society of Intensive Care (SATI) joined
forces to develop a consensus on the diagnosis, treatment, and prevention of
ventilator-associated pneumonia (VAP). The methodology used consisted of a
qualitative analysis of the evidence published since the last update in 2018,
complemented by expert opinions and local data.
This document updates the incidence and
epidemiology of VAP, addresses the limitations of clinical diagnosis, and
explores the role of lung ultrasound. It also analyzes the advantages and
disadvantages of biomarkers, as well as rapid microbiological identification
methods to optimize diagnosis. The document includes the preferred and
alternative therapeutic options for empirical and targeted treatment, and
establishes the optimal duration of treatment. Finally, it summarizes the
available evidence on VAP prevention and the implementation of measure bundles
to reduce its incidence. The joint work of both societies, including infectious
disease specialists and intensivists, highlights the concern for managing VAP
and the importance of improving daily clinical practices.
Through this consensus, local guidelines have
been agreed to optimize the diagnosis, treatment, and prevention of VAP, aiming
to reduce the impact of this infection on patients hospitalized in critical
care units.
Key words: pneumonia, ventilator, diagnosis, treatment,
prevention.
Nota del editor:98
Este artículo fue publicado originalmente en Medicina (Buenos
Aires):
Cornistein W, Nuccetelli Y, Huaier Arriazu EF,
Lares M, García MC, González AL, Cudmani N, Flores Montes M, De Aguilar L, De
Cristófano A, Blanco M. Neumonía asociada a ventilación mecánica.
Actualización y consenso intersociedades, Sociedad Argentina de Infectología – Sociedad Argentina de Terapia Intensiva 2024 [Ventilator-associated pneumonia. Update and intersociety consensus, Argentine Society
of Infectology – Argentine Society of Intensive Therapy 2024]. Medicina (B Aires). 2025;85(3):556-571.
Spanish. PMID: 40577143.
Republicado en RATI con la autorización de los editores y de
los autores.
|
Puntos clave Conocimiento
actual • La
neumonía asociada a ventilación mecánica aumenta la morbimortalidad, costos y
el uso de antimicrobianos, favoreciendo la resistencia. • El
diagnóstico es dificultoso siendo las muestras microbiológicas un pilar
fundamental para el diagnóstico etiológico. • El tratamiento adecuado disminuye la mortalidad de los pacientes ventilados. Contribución del artículo • El
artículo actualiza datos sobre incidencia y microorganismos causales. • Incluye
rol de la ecografía pulmonar, biomarcadores y métodos de identificación
rápida para el diagnóstico, algoritmo de tratamiento, nuevos antimicrobianos
para organismos resistentes y duración óptima. • Detalla
medidas preventivas y estrategias para reducir esta infección. |
La neumonía asociada a ventilador (NAVM), continúa siendo una de las infecciones intrahospitalarias más frecuentes en las Unidades de Cuidados Intensivos (UCI), afecta hasta al 20% de los pacientes críticamente enfermos1.
Esta condición se asocia con un aumento de la morbimortalidad, una prolongación de la estancia hospitalaria (que puede oscilar entre 7 y 30 días), un mayor riesgo de complicaciones y un incremento en el consumo de antimicrobianos, lo que tiene un impacto significativo en la aparición de resistencia antimicrobiana (RAM), en los costos hospitalarios y en los resultados clínicos de los pacientes1,2.
Diversos estudios han reportado tasas de mortalidad asociada a la NAVM que varían entre el 13% y el 31.4%3, con un costo atribuible aproximado de U$S 40 144 (con un rango de U$S 36,286 a U$S 44 220)3,4. El aumento de los gastos hospitalarios se debe principalmente a los días adicionales de internación y a los procedimientos diagnósticos y terapéuticos necesarios para su tratamiento, tales como cultivos y el uso de antimicrobianos5.
En Argentina, durante la pandemia de COVID-19 (entre 2020 y 2021), la tasa de NAVM alcanzó 21.88 por cada 1000 días de ventilación mecánica (VM) en las unidades dedicadas exclusivamente al tratamiento de pacientes con COVID-196. Según los informes del Programa Nacional de Vigilancia de Infecciones Hospitalarias de Argentina (Programa VIHDA), en 2023 la tasa se redujo a 16.42 por cada 1000 días de VM en las Unidades de Cuidados Intensivos de Adultos (UCIA) polivalentes, siendo la NAVM la principal causa de infección asociada a dispositivos en las UCI7.
La persistencia de estas altas tasas de infección resalta la necesidad urgente de un enfoque interdisciplinario para abordar esta problemática, estableciendo su manejo como una prioridad en la mejora de la atención en unidades cerradas. Este documento tiene como objetivo principal actualizar las estrategias de manejo y prevención de la NAVM, basándose en la mejor evidencia disponible y en la experiencia de los expertos locales.
Métodos
Este
documento actualiza la publicación de 20182 y es el resultado del trabajo colaborativo entre los miembros del Comisión
de Infecciones Asociadas al Cuidado de la Salud y Seguridad del Paciente
(IACS-SP) de la Sociedad Argentina de Infectología (SADI) y el Comité de
Infectología Crítica (CIC) de la Sociedad Argentina de Terapia Intensiva
(SATI), centrado en el enfoque y control de las infecciones en las Unidades de
Terapia Intensiva de Adultos (UTI).
Para su elaboración, se llevó a cabo una búsqueda sistemática y análisis cualitativo de la literatura, consultando bases de datos como Medline, PubMed, Embase, Lilacs, Ovid y Cochrane. Se emplearon palabras clave y términos MeSH, tanto en español como en inglés, correspondientes al período 2018-2024. Los estudios analizados incluyeron guías clínicas, revisiones sistemáticas, ensayos clínicos aleatorizados y estudios observacionales.
Este documento ha sido diseñado para asistir a los médicos tratantes (residentes, becarios, médicos de planta, infectólogos), así como al personal de enfermería y de kinesiología respiratoria en la atención de pacientes adultos en ventilación mecánica.
El contenido del documento se organiza en las siguientes secciones: (1) Definición y diagnóstico, (2) Tratamiento, y (3) Medidas recomendadas para la prevención.
Definiciones y diagnóstico
La NAVM
ocurre en pacientes conectados a VM durante al menos 48 horas, afecta al 10-25%
de todos los pacientes ventilados8. Se divide en temprana, que se presenta dentro de los cuatro días de la
ventilación y tardía, a partir del quinto día. Esta distinción se realiza con
el objetivo de considerar como agentes causales de la infección los
microorganismos de la comunidad en la temprana, y los intrahospitalarios en la
tardía. Es importante considerar, más allá de los días de VM, los factores de
riesgo para microorganismos resistentes (MOR) como uso de antibióticos previos
(ATB), colonización e internación prolongada9.
El diagnóstico de NAVM se define tradicionalmente por la presencia concomitante de los tres criterios siguientes: sospecha clínica, sospecha radiológica y estudios microbiológicos positivos de muestras del tracto respiratorio inferior2,10.
Diagnóstico clínico
La NAVM debe sospecharse en pacientes con signos clínicos de infección, con al menos dos de los siguientes criterios: aparición de fiebre, secreciones endotraqueales purulentas, leu-cocitosis o leucopenia, deterioro de la función respiratoria, disminución de la oxigenación y/o mayor necesidad de vasopresores para mantener la presión arterial. Estos signos, sin embargo, no son específicos de NAVM y a menudo se pueden observar en muchas afecciones que imitan la NAVM (p. ej., edema agudo de pulmón, contusión pulmonar, hemorragia pulmonar, atelectasia, enfermedad tromboembólica)10.
Si bien el examen clínico es esencial, tiene una sensibilidad del 66.4% (IC 95% 40.7-85.0) y especificidad del 53.9% (IC 95% 34.5-72.2) para el diagnóstico de NAVM11.
El CPIS (Clinical Pulmonary Infection Score) es una herramienta clínica ampliamente utilizada para evaluar la probabilidad de neumonía asociada a ventilación mecánica, pero es importante señalar que, aunque sigue siendo relevante, también ha sido objeto de discusión y adaptación en los últimos años. Estudios recientes sugieren que su eficacia puede mejorar al combinarlo con otras técnicas diagnósticas más modernas, como los biomarcadores y las técnicas moleculares. La interpretación del CPIS debe realizarse con cautela y en el contexto de una evaluación clínica completa12.
Diagnóstico radiológico
Tiene como objetivo identificar la presencia de inflamación y secreciones a nivel alveolar. Las neumonías presentan infiltrados nuevos o progresivos, que se manifiestan como áreas de opacidades pulmonares con broncograma aéreo o áreas de mayor atenuación descritas como infiltrados en vidrio esmerilado. Técnicas como la radiografía simple de tórax (Rx), la tomografía computarizada (TC) o la ecografía pulmonar, generalmente se combinan con criterios clínicos para respaldar un diagnóstico de NAVM.
La radiografía de tórax presenta baja sensibilidad y especificidad para el diagnóstico de NAVM. Una revisión sistemática reciente reportó una sensibilidad del 88,9% (IC 95%: 73.9-95.8) y una especificidad del 26.1% (IC 95%: 15.1-41.4), destacando además una significativa discrepancia en su interpretación, lo que aumenta el riesgo de diagnósticos tardíos o erróneos11. Tiene como ventaja ser portátil, evitando los riesgos asociados con el traslado del paciente. Sin embargo, aunque relativamente económica y práctica, la interpretación de la Rx suelen ser un desafío en pacientes críticamente enfermos debido a la superposición de otras enfermedades comunes que se presentan con infiltrados pulmonares, como contusiones pulmonares, atelectasia, edema pulmonar o síndrome de distrés respiratorio (SDRA).
La TC es el gold standard ya que proporciona una imagen tridimensional de orientación anatómica y patológica sin superposición anatómica y alta resolución de diferentes densidades de tejido. Aunque útil, no se utiliza de forma rutinaria para diagnosticar NAVM debido a riesgos que implica el traslado, la necesidad de sedación y bloqueo neuromuscular adicional y la carga de radiación. Por eso, se reserva para NAVM con dificultad diagnóstica11.
La ecografía pulmonar cuenta con evidencia creciente que respalda su utilidad en la detección y el seguimiento de la NAVM, caracterizada por hallazgos como consolidaciones subpleurales o broncograma dinámico. Esta técnica ofrece ventajas significativas al ser portátil, rápida y no invasiva. Un metaanálisis reportó una sensibilidad del 88% y una especificidad del 89%. No obstante, su correcta aplicación requiere experiencia y formación especializada, además de presentar limitaciones en pacientes con obesidad, enfisema subcutáneo o edema de la pared torácica, lo que puede dificultar su visualización.
Biomarcadores
La recomendación de utilizar procalcitonina (PCT) o proteína C reactiva (PCR) debe basarse en evidencia que demuestre mejoras en los resultados clínicos. Sin embargo, no existen estudios que informen sobre los resultados en pacientes relacionados con el uso de biomarcadores para diagnosticar la NAVM13.
Tanto la PCT como PCR no han demostrado tener suficiente sensibilidad o especificidad para ser recomendadas de manera generalizada en el diagnóstico de la NAVM13. La PCR, en particular, no se utiliza para diagnosticar ni guiar el tratamiento antibiótico en la NAVM debido a su baja especificidad. No obstante, algunos estudios han encontrado que las variaciones en los niveles de PCR a lo largo del tiempo (delta PCR) pueden ser un indicador para predecir la evolución clínica de los pacientes14.
En cuanto a la PCT, un importante ensayo clínico aleatorizado15 realizado en UCI con pacientes con sospecha de infección bacteriana demostró una disminución significativa en los días de tratamiento antibiótico cuando se utilizó la PCT de manera seriada. En este estudio, la duración mediana del tratamiento en el grupo guiado por PCT fue de 5 días, en comparación con los 7 días de tratamiento en el grupo de tratamiento estándar. Además, los pacientes que fueron guiados por PCT mostraron una mayor supervivencia (razón de riesgo 1.26; IC 95%, 1.07–1.49). No obstante, la aplicabilidad de estos resultados a la NAVM sigue siendo incierta.
Un metaanálisis reciente realizado por Schuetz et al.16 mostró una reducción significativa en la mortalidad y en la duración del tratamiento antibiótico en infecciones respiratorias agudas, de 8.1 a 5.7 días. Las guías europeas sugieren que el uso de PCT en estos casos, con el objetivo de reducir la duración del tratamiento antibiótico, constituye una buena práctica clínica, especialmente en hospitales con tratamientos prolongados.
En resumen, no existe un único criterio clínico, biomarcador o score que ofrezca una precisión suficiente para el diagnóstico definitivo de NAVM. Por consiguiente, la NAVM debe sospecharse ante la aparición de nuevos signos de deterioro respiratorio potencialmente atribuibles a una infección, como fiebre, esputo purulento, leucocitosis, empeoramiento de la oxigenación o incremento en los requerimientos de vasopresores, en presencia de infiltrados pulmonares nuevos o progresivos. Una vez planteada la sospecha clínica, el siguiente paso consiste en recolectar muestras para estudio microbiológico y dar inicio a una terapia antimicrobiana empírica adecuada, con una reevaluación sistemática del diagnóstico y el tratamiento dentro de las primeras 72 h.
Diagnóstico microbiológico
Los datos de cultivos microbiológicos siguen siendo un aspecto importante, y el microbiólogo clínico juega un rol vital en la orientación de la selección de antibióticos al abordar los criterios de pruebas y muestras apropiadas, proporcionar datos oportunos de susceptibilidad y orientación sobre la interpretación precisa de los resultados17.
Se recomienda la toma de hemocultivos para los pacientes con sospecha de NAVM. El 15% de los pacientes presentan bacteriemia por lo que los hemocultivos pueden ser útiles para identificar el patógeno responsable, especialmente si los cultivos respiratorios no son reveladores. Además, hasta el 25% de los hemocultivos de este grupo permiten identificar patógenos que reflejan una fuente secundaria de infección18.
Aún no hay acuerdo en cuanto a la mejor muestra y el mejor método para el cultivo de muestras respiratorias. Las guías norteamericanas recomiendan utilizar muestras no invasivas y cultivos semicuantitativos (débil recomendación, evidencia de baja calidad)19; en cambio, las guías europeas/latinoamericanas recomiendan muestras invasivas y métodos cuantitativos (previo a cualquier tratamiento con antibióticos)20, para reducir la exposición a antibióticos en pacientes estables con sospecha de NAVM y mejorar la precisión de los resultados (recomendación débil, baja calidad de la evidencia)19. La evidencia de los ensayos incluidos en una amplia revisión, indica que no existe ventaja clínica en el uso de cultivos cuantitativos sobre los cualitativos, ni en el uso de métodos de diagnóstico invasivos sobre los no invasivos21.
Consideramos
que la mayor ventaja en la obtención de muestras respiratorias para estudios
microbiológicos antes de iniciar o modificar terapia antimicrobiana, reside en
suspender el antibiótico ante un resultado negativo o desescalar el
tratamiento. Puede analizarse cualquier tipo de muestra (distal o proximal)
priorizando la que se encuentre disponible en el momento de sospecha de
neumonía, considerando siempre muestras representativas y cultivos
cuantitativos o semicuantitativos para diferenciar infección de colonización
con los puntos de corte recomendados (Tabla 1). El diagnóstico etiológico por
cultivo convencional requiere aproximadamente de 48 a 72 horas. Hasta disponer
de resultados definitivos, el enfoque del tratamiento es empírico, con la
administración de antibióticos de amplio espectro para cubrir los patógenos
potenciales. Con la aparición de organismos resistentes a múltiples fármacos es
necesario implementar nuevas estrategias para reducir el tiempo de
identificación del patógeno y lograr un inicio precoz del tratamiento apropiado
o un cambio más rápido al tratamiento específico, reduciendo el uso de
antibióticos de amplio espectro y un mejor cumplimiento de los programas de
optimización de antimicrobianos.
|
Tabla 1 Puntos de corte y celularidad de muestras
respiratorias representativas40 |
||
|
Muestras |
Puntos de corte |
Celularidad de muestras representativas por campo de 1000 x |
|
Aspirado traqueal (muestra obtenida sin
broncoscopia) |
≥105 UFC/ml |
> 25 leucocitos PMN < 10 células
epiteliales |
|
Lavado broncoalveolar (BAL o MiniBal)
obtenido con o sin broncoscopia |
≥104 UFC/ml |
< 1% células epiteliales |
|
BAL con cepillo protegido obtenido con o sin
broncoscopia |
≥103 UFC/ml |
> 10% leucocitos PMN |
|
BAL: lavado broncoalveolar; PMN:
polimorfonucleares |
||
La tecnología
MALDI-TOF permite una rápida identificación de las especies involucradas con
elevada sensibilidad y especificidad, pero aún depende de las técnicas
tradicionales lentas basadas en cultivos y no ofrece datos directos de
sensibilidad antibiótica8,22.
Los paneles sindrómicos de amplificación de ácidos nucleicos en formato de microarray constan de una plataforma de diagnóstico molecular que utiliza la reacción en cadena de la polimerasa (PCR) para detectar múltiples patógenos simultáneamente y mecanismos de resistencia relevantes en el lapso de 1 hora a partir de muestras respiratorias. Es importante conocer, al comparar informes, que los resultados del intervalo semicuantitativo (copias/ ml) generados por paneles sindrómicos no son equivalentes a UFC/ml del cultivo, son en promedio aproximadamente 1 log más alto que los valores (UFC/ml)8,10,23,24.
Los métodos moleculares rápidos no deben utilizarse como reemplazo del cultivo de rutina sino como prueba complementaria. En este contexto, tal como muestran Soloaga et al.25, se puede adecuar tempranamente el tratamiento antimicrobiano del paciente (con posibilidad de escalar/desescalar), tomar decisiones respecto a la necesidad de aislamiento, salvaguardar los antibióticos de reserva y reducir costos a nivel institución. Deben implementarse en el marco de un programa institucional de optimización del diagnóstico y con resultados correctamente interpretados10,23,24,25.
Los paneles
sindrómicos pueden funcionar como una prueba en el punto de atención con
algunas ventajas y desventajas25. Como principales ventajas son: rapidez, identificación de múltiples
microorganismos (MO) incluidos los de difícil cultivo (ej. Legionella
pneumophila) y detecta genes de resistencia críticos. Las desventajas
incluyen alto costo, difícil diferenciación entre colonización e infección y no
proporciona información sobre la viabilidad de los MO detectados.
Tratamiento antimicrobiano
En caso de pacientes críticamente enfermos con NAVM es necesario comenzar un tratamiento empírico temprano, adecuado y apropiado basado en la epidemiología local considerando fundamental la reevaluación del cuadro y los aislamientos microbiológicos para adecuar la terapia inicial a las 48-72 h.
Las NAVM tempranas, desarrolladas dentro de los primeros cinco días de ventilación, suelen estar causadas por microorganismos de la comunidad, como Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis y Staphylococcus aureus meticilino-sensible (SAMS). Este último se asocia principalmente a NAVM tempranas en contextos de trauma (Tabla 2). En pacientes sin factores de riesgo para MOR, se sugiere como tratamiento empírico la ampicilina-sulbactam.
|
Tabla 2 Tratamiento empírico y dirigido para
neumonía asociada a ventilación mecánica según antibióticos disponibles en Argentina
y para pacientes con función renal normal |
|||
|
Tratamiento empírico inicial |
Preferencia |
Alternativa |
Comentario |
|
NAVM precoz sin FR MOR |
Ampicilina sulbactam 3 g cada 6 h ev |
Alérgicos a betalactámicos: levofloxacina
750 mg/d |
Agregar vancomicina en pacientes colonizados
por SAMR o con FR para SAMR |
|
NAVM tardía |
Piperacilina-tazobactam 4.5 g cada 6 h o cefepime 2 g cada 8 h o ceftazidima 2 g cada 8 h |
Alérgicos a betalactámicos: levofloxacina
750 mg/d |
La elección del b-lactámico dependerá de la sensibilidad local
de Pseudomonas spp |
|
|
+/- colistina 300 mg luego 150 mg cada 12 h |
|
Colistina solo si alta frecuencia de ABRC o PAEMR |
|
|
+/- vancomicina DC 35 mg/kg, DM 20-30 mg/kg
cada 12 h o infusión 24 h |
Linezolid 600 mg cada 12 h |
Cobertura cocos si alto entorno de SAMR |
|
NAVM con FR BLEE |
Imipenem-cilastatina 1 g cada 8 h o
meropenem 2 g cada 8 h |
Alérgicos a betalactámicos: Tigeciclina 100
mg carga luego 50 mg cada 12 h |
Elegir carbapenem por sobre otros b-lactámicos |
|
NAVM tardía en pacientes con FR para ERC |
Ceftazidima avibactam 2.5 g cada 8 h |
Combinar dos de las siguientes según S
local: Colistina 300 mg carga luego 150 mg cada 12 h |
FR ERC colonización dentro de los 3 meses o
internación prolongada en áreas con alta prevalencia de ERC |
|
|
+/- aztreonam 2 g cada 8 h si MBL |
Fosfomicina 16-24 mg/d |
|
|
|
|
Tigeciclina 200 mg luego 100 mg cada 12 h |
|
|
|
|
Amikacina 15-20 mg/kg/d |
|
|
NAVM con FR ABA |
Sulbactam 3 g cada 8 h + colistina 300 mg
carga luego 150 mg cada 12 h o tigeciclina 200 mg carga luego 100 mg cada 12
h |
AMS 6g/3g en 4 h cada 8 h + colistina 300 mg carga luego 150 mg cada
12 h o tigeciclina 200 mg carga luego 100 mg cada 12 h |
Solo cuando la prevalencia de Acinetobacter
spp es elevada (25%) |
|
NAVM con FR para PAE MR (sin carbapenemasa) |
Ceftolozano-tazobactam 3 g cada 8 h |
Colistina 300 mg carga luego 150 mg cada 12
h o Ceftazidima-avibactam 2.5 g cada 8 h o imipenem - cilastatina-relebactam
1.25 g cada 6 h |
FR PAEMR: antecedentes de infecciones
previas por PAE, uso de ATB previo, internación prolongada en áreas de alta
prevalencia |
|
Tratamiento dirigido |
Preferencia |
Alternativa |
Comentario |
|
SAMR |
Vancomicina DC 35 mg/kg, DM 20-30 mg/kg cada
12 h o infusión 24 h |
Linezolid 600 mg cada 12 h o
Trimetoprima-sulfametoxazol 8-12 mg/kg/d cada 8 h |
Las dosis de vancomicina deberán ajustarse a
riñón hiperfiltrante o LRA |
|
Enterobacterias BLEE |
Imipenem-cilastatina 1 g cada 8 h o
meropenem 2 g cada 8 h |
Tigeciclina 200 mg luego 100 mg cada 12 h |
|
|
ERC KPC |
Ceftazidima-avibactam 2.5 g cada 8 h |
Imipenem-cilastatina-relebactam 1.25 g cada
6 h |
|
|
ERC MBL |
Ceftazidima-avibactam 2.5 g cada 8 h + aztreonam 2 g cada 8 h |
Colistina 300 mg carga luego 150 mg cada 12
h + fosfomicina 6 g/ cada 6-8 h o Tigeciclina 200 mg carga luego 100 mg cada
12 h (según sensibilidad) |
|
|
PAE MR |
Ceftolozano-tazobactam 3 g cada 8 h |
Ceftazidima-avibactam 2.5 g cada 8 h o
imipenem-cilastatina-relebactam 1.25 g cada 6 h o colistina 300 mg carga luego 150
mg cada 12 h |
PAE MBL tipo VIM podría beneficiarse con la combinacion
ceftazidima avibactam + aztreonam |
|
Acinetobacter spp |
Sulbactam 3 g cada 8 h + colistina 300 mg
carga luego 150 mg cada 12 h |
AMS 6g/3g (ampicilina 6g/sulbactam 3g) en infusión
continua de 4 h cada 8 h + colistina 300 mg carga luego 150 mg cada12 h o
tigeciclina 200mg carga y 100 cada 12 h +
colistina 300 mg carga luego 150 mg cada12 h |
Elegir al menos dos ATB activos, idealmente
uno sea sulbactam |
|
Stenotrophomonas spp |
Trimetoprima-sulfametoxazol 8-12 mg/k/d cada
8 h o levofloxacina 750 mg/d |
ceftazidima-avibactam 2.5 g cada 8 h +
aztreonam 2 g cada 8 h |
Según sensibilidad En infecciones graves o en inmunosuprimidos
se podría indicar terapia combinada |
|
FR: factores de riesgo; MOR: microorganismos
multirresistentes; AMS: ampicilina-sulbactam; PTZ: piperacilina-tazobactam; SAMR:
Staphylococcus aureus meticilino resistente; BLEE: betalactamasa de
espectro extendido; ERC: enterobacteria resistente a carbapenemes; ABA: Acinetobacter
baumannii; KPC: Klebsiella pneumoniae resistente a carbapenems
(subtipo de carbapenemasa, para referir a las tipo A de la clasificación de
Amber); MBL: metalo betalactamasa (tipo de carbapenemasa para referir a las
tipo B); OXA: carbapenemasa tipo oxacilinasa (tipo D); PAE MR: Pseudomonas
aeruginosa multirresistente; DC: dosis de carga; DM: dosis de
mantenimiento; LRA: lesión renal aguda. ** no es útil para Pseudomonas spp ni Proteus
spp; Antibioticos inhalados: colistina 1 MU 2 veces al día, levofloxacina
240 mg 2 veces por día. |
|||
Por otro
lado, en las NAVM tardías, según el informe VIHDA 2023, los microorganismos más
frecuentemente asociados son Acinetobacter baumannii (21%), Pseudomonas
aeruginosa (20%), Klebsiella pneumoniae (19%) y Staphylococcus aureus (14%).
Los factores de riesgo principales para infecciones por MOR incluyen el uso
previo de antibióticos, especialmente quinolonas y carbapenémicos, la
colonización por MOR en los últimos tres meses y la hospitalización en áreas
con alta prevalencia de estos microorganismos (>25%)26,27. Asimismo, la colonización nasofaríngea previa y la edad mayor de 65 años
se asocian significativamente con el riesgo de NAVM por Staphylococcus
aureus resistente a la meticilina (SAMR)28,29.
El hisopado nasal para la detección de colonización por SAMR es una herramienta útil para optimizar el tratamiento antibiótico empírico en NAVM. Un resultado negativo tiene un alto valor predictivo negativo para infección por SAMR, aunque un resultado positivo no implica necesariamente que sea el microorganismo causal29,30. La implementación de la pesquisa de colonización nasal ha demostrado beneficios; por ejemplo, permitió suspender el uso de vancomicina en el 57 % de los pacientes del grupo postintervención dentro de las primeras 24 horas, en comparación con el 32 % en el grupo preintervención31.
En la Figura
1 se resume el manejo terapéutico inicial en pacientes con sospecha de NAVM y
en la Tabla 2 la propuesta de tratamiento empírico y dirigido.
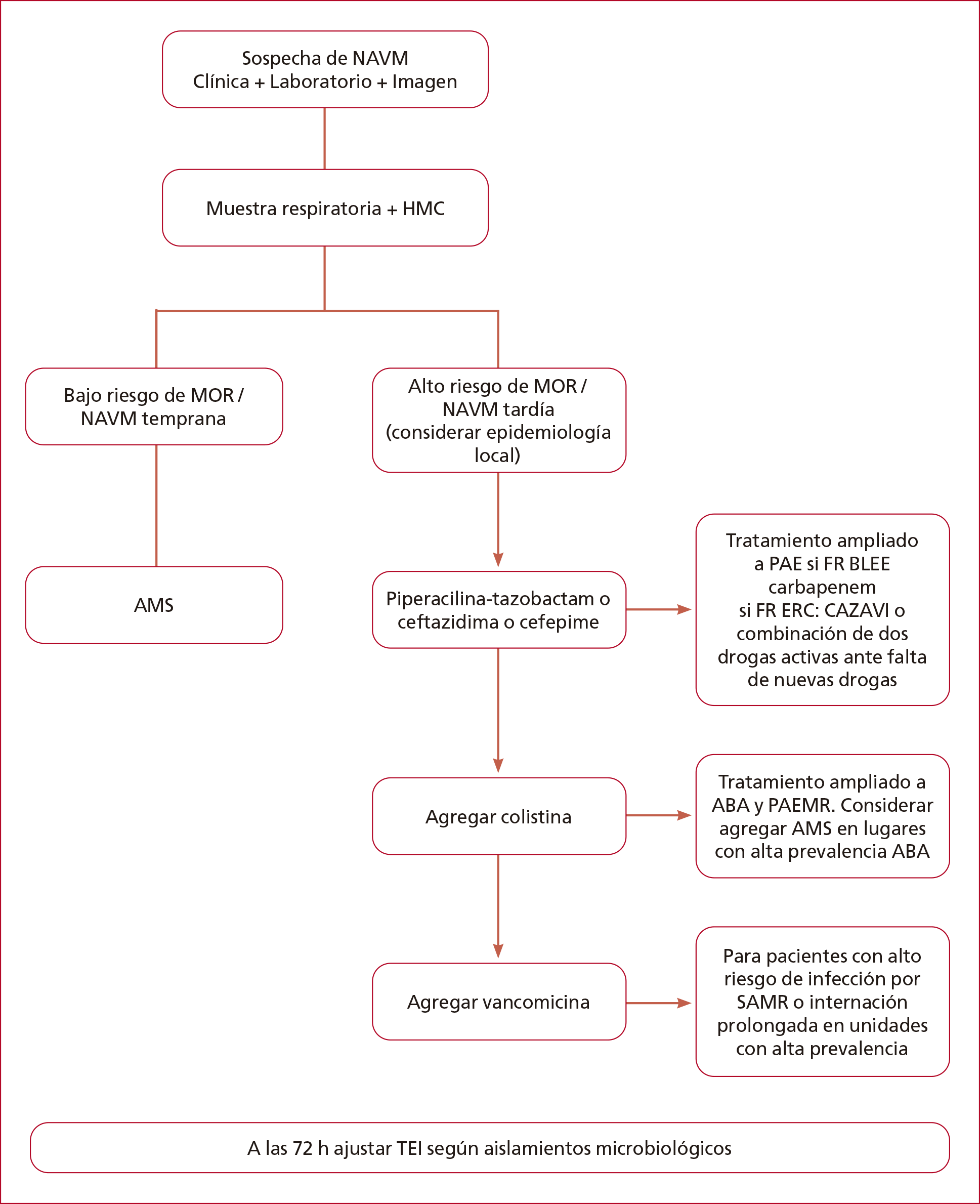
Figura 1. Algoritmo manejo de neumonía
asociada a ventilación mecánica.
NAVM: neumonía asociada a ventilación
mecánica; HMC: hemocultivos; MOR: microorganismos multirresistentes; AMS:
ampicilinasulbactam; FR: factores de riesgo; PAE: Pseudomonas aeruginosa;
BLEE: betalactamasa de espectro extendido; ERC: enterobacteria resistente a
carbapenemes; ABA: Acinetobacter baumannii; PAEMR: Pseudomonas
aeruginosa multirresistente; SAMR: Staphylococcus aureus meticilino
resistente; TEI: terapia empírica inicial.
Antibióticos inhalados
El tratamiento con antibióticos nebulizados ha surgido como una terapia complementaria para aumentar la eficacia del tratamiento y la concentración tisular de antibióticos, y para prevenir la toxicidad sistémica durante el tratamiento de infecciones respiratorias causadas por patógenos multirresistentes32. Por otro lado, los antibióticos inhalados se han utilizado para la erradicación de la primoinfección por Pseudomonas spp en pacientes con fibrosis quística33. Los antibióticos que se pueden administrar por esta vía se describen en la Tabla 2. Considerar que se requiere de un nebulizador de membrana vibratoria para lograr alcanzar concentraciones pulmonares eficientes y adecuadas.
Duración del tratamiento
En los
pacientes con NAVM, los tratamientos se han acortado basados en múltiples
trabajos científicos8,20,32,34. La duración sugerida es de 5-7 días
para la mayoría de las NAVM, estudios de no inferioridad apoyan tratamientos
cortos35,36, que tienen además una reducción significativa de eventos adversos37. En situaciones especiales la
duración podría prolongarse: pacientes con fibrosis quística, empiema, absceso
pulmonar, cavitación o neumonía necrotizante13.
Prevención
Las medidas de prevención se pueden dividir como prácticas esenciales y adicionales de acuerdo a la evidencia actual38. Las prácticas esenciales deberían aplicarse a todos los pacientes ventilados.
Bundle de prevención de NAVM
Paquete de medidas (bundle) mínimo y mandatorio recomendado para establecer como meta institucional o de la unidad, y vigilar adherencia, en prevención de NAVM:
1. Elevar la cabecera 30-45°
2. Realizar higiene oral por turno priorizando la acción mecánica con cepillado dental combinado con solución fisiológica o agua destilada
3. Implementar ventilación no invasiva siempre que sea posible
4. Realizar la interrupción diaria programada de la sedación (si no hay contraindicación)
5. Hacer prueba de ventilación espontánea diaria (si no hay contraindicación)
Según la fisiopatología de la infección, en la Tabla 3 se adjunta la recomendación para prevenir las NAVM39.
|
Tabla 3 Resumen de la evidencia para prevención de
neumonía asociada a ventilación mecánica según fisiopatología |
||
|
Mecanismo |
Recomendación |
Comentario |
|
Evitar VM |
VNI/CAFO evitar intubar y reintubar |
Reduce días de VM, estadía en UCI, estadía
hospitalaria, mortalidad, disminuye falla respiratoria pre-intubación40,41, modalidad de vacaciones de sedación en
EPOC42,43 o post extubación postquirúrgicos44 |
|
|
Considerar traqueostomía temprana (<7
días) |
La incidencia de NAVM es menor en pacientes
que se sometieron a traqueostomía temprana (<7 días) en comparación de
tardía (>10 o 13-14)45. Mejora la comodidad del paciente, facilita
una mejor manipulación de las vías respiratorias46, además se asoció a menos días de VM y
estadía en UCI47 |
|
Reducir duración de VM |
Respiración espontánea |
Las pruebas diarias de vacación de sedación
(VS) y ventilación espontánea (PVE) previenen la NAVM en pacientes sin contraindicaciones,
y reducen los días de VM48-52 |
|
|
Interrupción diaria programada de la
sedación |
Controlar a los pacientes ventilados sin
sedantes, particularmente benzodiacepinas, es crucial para prevenir la NAVM53. Puede provocar
una mayor agitación, requiere una monitorización cuidadosa |
|
|
Movilización temprana |
El ejercicio y movilización temprana pueden
acortar la duración de la VM, la duración de la estancia en la UCI, las tasas
de NAVM y aumentar la tasa de retorno a la función independiente54,55. Estudios mediante modelos sugieren que
pueden disminuir costos también56 |
|
Reducir las aspiraciones |
Cambios de circuito |
Cambiar el circuito del ventilador sólo si
está visiblemente sucio o no funciona correctamente38. Cambios de rutina cada siete días NO
mejora las tasas de NAVM57. El uso de circuitos descartables no mostró
diferencias58. Siga las pautas del CCI y las
instrucciones de los fabricantes para el uso de esterilización y desinfección
de equipos de cuidado respiratorio59 |
|
|
Sistema de aspiración endotraqueal cerrado |
Considerar factores individuales del
paciente y costos para su uso. La succión cerrada parece ser eficaz para
mantener la higiene de las vías respiratorias sin interrumpir la ventilación60,61, y podría disminuir la incidencia de NAVM60. Se asoció con
mejores puntuaciones SOFA y CPIS, lo que podría proporcionar mejores
resultados generales para los pacientes62,63, aunque no tiene
resultados concluyentes de impacto en NAVM |
|
|
Evitar aspiración innecesaria |
Si bien la aspiración periódica puede
reducir microaspiraciones, no tiene resultados concluyentes de impacto en
NAVM64,65 |
|
|
Cabecera 30°-45° |
Medida ampliamente difundida que no provoca
daño66 |
|
|
Aspirar previo a movilización |
La aspiración de secreciones antes de
movilizar a los pacientes de la UCI puede ser beneficiosa para prevenir la
NAVM67 |
|
Disminuir la carga bacteriana en la cavidad oral |
Higiene oral con solución fisiológica o agua
destilada |
Un programa estructurado de cuidado nasal
combinado con higiene bucal reduce significativamente la incidencia de NAVM68, la carga
microbiana y minimiza la microaspiración69,70 |
|
|
|
NO recomendados: El enjuague bucal con
clorhexidina puede ser contraproducente aumentando la incidencia de NAVM71,72 y se asocia con más efectos secundarios72 |
|
|
Probióticos |
NO recomendados. Si bien son una estrategia
potencial para prevenir la NAVM con algunos resultados prometedores, la
calidad metodológica general de los estudios es baja y muchos carecen de
protocolos rigurosos. La evidencia no es lo suficientemente sólida para
realizar recomendaciones clínicas definitivas73-76 |
|
|
Tubos orogástricos |
NO recomendado. Aumento de mortalidad.
Pueden influir significativamente en la incidencia de NAVM, principalmente a
través de su papel en la colonización y aspiración gástrica77. La aspiración
del contenido gástrico hacia las vías respiratorias inferiores es un actor
crítico en el desarrollo de NAVM78 |
|
Disminuir la carga bacteriana en la vía
aérea |
Tubo con puerto de drenaje de secreciones
subglóticas |
Pacientes que requieren >48-72 h VM. Se
observó disminución en la duración de la VM y estancia en UCI, disminución de
la incidencia de NAVM y mortalidad38. Los TET pueden ser colonizados por
patógenos como Klebsiella, Pseudomonas y Acinetobacter, que a menudo son
resistentes a los antibióticos79, puertos de aspiración puede facilitar la eliminación
de secreciones y la carga de patógenos80; podría mitigar el riesgo de NAVM81 asociado a biofilm |
|
|
Tubos impregnados con plata |
NO recomendado. Tienen efecto microbicida
contra patógenos como Staphylococcus aureus82. TET impregnados con plata tienen
resultados prometedores para reducir la incidencia de NAVM83,84. No obstante, se necesitan más estudios
para establecer protocolos estandarizados para uso clínico |
|
Disminuir la colonización por patógenos
resistentes |
Higiene de manos |
Buenas prácticas de higiene de manos tienen
un impacto significativo en la incidencia de NAVM tanto en paquete de medidas
(bundle)85 como
auditorías individuales86 |
|
|
Precauciones de contacto |
Las estrategias de aislamiento en pacientes
colonizados o infectados por MOR tienen un impacto significativo en la incidencia
de NAVM al reducir la exposición a patógenos y mejorar los protocolos de
atención al paciente87 |
|
Otros |
Mantener presión del manguito del tubo
endotraqueal 20-22 cm H2O |
La presión óptima del manguito es esencial
para minimizar la microaspiración en rango de 20 a 30 cm H2O para evitar fugas de aire y garantizar un
sellado adecuado de las vías respiratorias88; mantener la presión puede reducir
significativamente la incidencia de NAVM89. El control contínuo90 o con
periodicidad excesiva91 NO
está recomendado92. Una presión excesiva (>30 cm H2O) puede provocar isquemia traqueal5 |
|
|
Alimentación con sonda postpilórica en lugar
de gástrica |
Pacientes con intolerancia o alto riesgo de
aspiración. Se ha demostrado que la nutrición enteral postpilórica reduce significativamente
el riesgo de aspiración en pacientes con alto riesgo de sufrir esta
complicación93. El tratamiento de la gastroparesia
mediante esta práctica puede mitigar aún más los riesgos de aspiración al
promover un tránsito pilórico más rápido94 |
|
|
Profilaxis de úlceras por estrés |
Su papel en la reducción de la incidencia de
NAVM no está respaldado definitivamente por la evidencia actual95,96. El uso de inhibidores de la bomba de
protones puede aumentar NAVM97 |
|
NAVM: neumonía asociada a ventilación
mecánica; VNI: ventilación no invasiva; CAFO: cánula de alto flujo; VM:
ventilación mecánica; UCI: unidad de cuidados intensivos; EPOC: enfermedad
pulmonar obstructiva crónica; NAVM: neumonía asociada a la ventilación mecánica;
CCI: comité de control de infecciones; TET: tubo endotraqueal; MOR:
microorganismos multirresistentes. |
||
Conclusión
Este documento resume la evidencia actual y la opinión de expertos intersociedades con el fin de promover un diagnóstico adecuado, el uso responsable de antimicrobianos y la implementación de estrategias de prevención que controlen las NAVM y mejoren los resultados en nuestros pacientes.
Agradecimientos
A la Sociedad Argentina de Infectología y Sociedad Argentina de Terapia Intensiva por dar apoyo a esta publicación.
Conflicto de intereses
La Dra. Wanda Cornisten se desempeñó como oradora de Pfizer, MSD, BAGO y BD. La Dra. Yanina Nuccetelli ha sido oradora de Pfizer y BAGO.
Bibliografía
1.
Papazian
L, Klompas M, Luyt CE. Ventilator-associated pneumonia in adults: a narrative
review. Intensive Care Med 2020; 46:888-906.
2.
Cornistein
W, Colque AM, Staneloni MI, et al. Neumonía asociada a la ventilación mecánica.
Actualización y recomendaciones
inter-sociedades, Sociedad Argentina de Infectología - Sociedad Argentina de Terapia Intensiva. Medicina
(B Aires) 2018; 78: 99-106.
3.
Nuccetelli
Y. Buenas prácticas para la prevención de la neumonía asociada
a la asistencia respiratoria mecánica. En: https://www.adeci.org.ar/files/
guias/Buenas%20practicas%20para%20la%20prevencion%20de%20la%20neumonia%20asociada%20a%20
la%20asistencia%20respiratoria%20mecanica.pdf; consultado octubre 2024.
4.
S.
Cicala OM, De Santo C, Mosconi C, et al. The financial burden of healthcare-associated infections: a propensity
score analysis in an Italian healthcare setting. Infect
Prev Pract 2024;
7:100406.
5.
Ortiz-Mayorga
JL, Pineda-Rodríguez IG, Dennis RJ, Porras
A. Costos atribuidos a las infecciones asociadas con la atención en salud en un hospital de Colombia,
2011-2015. Biomédica 2019; 31:
102-12.
6.
Reporte
de Vigilancia de Infecciones Asociadas al Cuidado de la Salud en Unidades COVID
2020-2021. En: http://sgc.anlis.gob.ar/handle/123456789/2447;
consultado noviembre 2024.
7.
Instituto
Nacional de Epidemiología Dr. Juan H. Jara.
Programa Nacional de Vigilancia de Infecciones Hospitalarias de Argentina
(VIHDA). Reporte Anual de Vigilancia de Infecciones Asociadas al Cuidado de la
Salud 2023. ANLIS Dr. C. G. Malbrán, 2024.
En: https://vihda.gov.ar/;
consultado noviembre 2024.
8.
Cillóniz C, Torres A, Niederman MS. Management of pneumonia in critically ill patients. BMJ
2021; 375: e065871.
9.
Wu D, Wu
C, Zhang S, Zhong Y. Risk factors of ventilator-associated pneumonia in
critically iii patients. Front Pharmacol 2019;10: 437860.
10. Papazian
L, Klompas M, Luyt C-E. Ventilator-associated
pneumonia in adults: a narrative review. Intensive Care Med 2020; 46:
888–906.
11. Howroyd F, Chacko C, MacDuff A, et al.
Ventilator-associated pneumonia: pathobiological heterogeneity and diagnostic
challenges. Nat Commun 2024; 15:6447.
12. Gaudet A, Martin-Loeches I, Povoa P, et al. Accuracy
of the clinical pulmonary infection score to differentiate
ventilator-associated tracheobronchitis from ventilator-associated pneumonia. Ann
Intensive Care 2020; 10:101.
13. Metersky ML, Kalil AC. Management of
ventilator-associated pneumonia: Guidelines. Infect Dis Clin North Am 2024;
38: 87–101.
14. Torres A, Artigas A, Ferrer R. Biomarkers in the ICU:
less is more? No. Intensive Care Med 2020; 47: 97–100.
15. Rossi M, Delamarre L, Duclos G. Compliance with a
procalcitonin-based protocol in patients with ventilation-associated pneumonia:
an observational, retrospective study. Antibiotics 2023; 12: 1208.
16. Schuetz P,
Wirz Y, Sager R, et al. Effect of
procalcitonin-guided antibiotic treatment on mortality in acute respiratory
infections: a patient level meta-analysis. Lancet Infect Dis 2018; 18:
95–107.
17. Ferrer M, Torres A. Epidemiology of ICU-acquired
pneumonia. Curr Opin Crit Care 2018; 24: 325–31.
18. Modi AR, Kovacs CS. Hospital-acquired and
ventilator-associated pneumonia: Diagnosis, management, and prevention. Cleve
Clin J Med 2020; 87: 633–9.
19. Martin-Loeches I, Rodriguez AH, Torres A. New
guidelines for hospital-acquired pneumonia/ventilator-associated pneumonia: USA
vs. Europe. Curr Opin Crit Care 2018; 24: 347–52.
20. Torres A,
Niederman MS, Chastre J, et al. International
ERS/ESICM/ESCMID/ALAT guidelines for the management of hospital-acquired
pneumonia and ventilator-associated pneumonia: Guidelines for the management of
hospital-acquired pneumonia (HAP)/ventilator-associated pneumonia (VAP) of the
European Respiratory Society (ERS), European Society of Intensive Care Medicine
(ESICM), European Society of Clinical Microbiology and Infectious Diseases
(ESCMID) and Asociación
Latinoamericana del Tórax
(ALAT). Eur Respir J 2017; 50:1700582.
21. Berton DC, Kalil AC, Teixeira PJZ. Quantitative versus
qualitative cultures of respiratory secretions for clinical outcomes in
patients with ventilator-associated pneumonia. Cochrane
Database Syst Rev 2014;
2014: CD006482.
22. Xu E, Pérez-Torres D, Fragkou PC, Zahar J-R,
Koulenti. D. Nosocomial pneumonia in the era of
multidrug-resistance: updates in diagnosis and management. Microorganisms 2021;
9:534.
23. Virk A, Strasburg AP, Kies KD, et al. Rapid multiplex
PCR panel for pneumonia in hospitalised patients with suspected pneumonia in
the USA: a single-centre, open-label, pragmatic, randomised controlled trial. Lancet
Microbe 2024;
5:100928.
24. Fernández-Ruiz M, Castón JJ, del Pozo JL, et al. ¿Cómo podemos optimizar el abordaje diagnóstico y terapéutico de
la neumonía? Recomendaciones basadas
en una opinión de expertos. Enferm
Infecc Microbiol Clin 2024; 42: 442–52.
25. Soloaga R,
Barcán L, Bettiol M, et al.
Estudio multicéntrico argentino sobre la
utilidad del panel de neumonía de
FilmArray®. Acta Bioquím Clín Latinoam 2021;
55:347-55.
26. Wang M, Xu X, Wu S, et al. Risk factors for
ventilator-associated pneumonia due to multi-drug resistant organisms after
cardiac surgery in adults. BMC Cardiovasc Disord 2022; 22: 465.
27. Nu J-N, Hu S-Q, Li Z-L, et al. Risk factors of
multidrug-resistant bacteria infection in patients with ventilator-associated
pneumonia: A systematic review and meta-analysis. J Infect Chemother 2023;
29: 942-7.
28. Alnimr A. Antimicrobial resistance in
ventilator-associated pneumonia: predictive microbiology and evidence-based
therapy. Infect Dis Ther 2023; 12: 1527-52.
29. Pickens CI, Wunderink RG. Methicillin-resistant
Staphylococcus aureus hospital-acquired pneumonia/ventilator-associated
pneumonia. Semin Respir Crit Care Med 2022; 43: 304-9.
30. Liu C, Holubar M. Should a MRSA nasal swab guide
empiric antibiotic treatment? NEJM Evid 2022; 1:
EVIDccon2200124.
31. Fenlon LA,
Fong K, Spivak ES, Imlay H. 1191. The
implementation of nasal MRSA PCR for pneumonia and association with antibiotic
use and clinical outcomes. Open Forum Infect Dis 2023;10: ofad500.1031.
32. Jung YJ, Kim EJ, Choi YH. Aerosolized antibiotics in
the treatment of hospital-acquired pneumonia/ ventilator-associated pneumonia. Korean J
Intern Med 2022;
37: 1–12.
33. Fielbaum
O. Manejo actual de la fibrosis quística. Rev Med Clin Condes 2017; 28: 60-71.
34. Rodríguez-Leal
CM, González-Corralejo C, Candel FJ, Salavert M, Medical
societies for the 5th edition of Pneumonia Day. Candent issues in pneumonia.
Reflections from the fifth annual meeting of spanish experts 2023. Rev Esp
Quimioter 2024; 37: 221-51.
35. Rosenberg K. Short-term antibiotic therapy is
noninferior to usual care for VAP. Am J Nurs 2024; 124: 56.
36. Mo Y, Booraphun S, Li AY, Domthong P, Kayastha G, Lau
YH, et al. Individualised, short-course antibiotic treatment versus usual
long-course treatment for ventilator-associated pneumonia (REGARD-VAP): a
multicentre, individually randomised, open-label, non-inferiority trial. Lancet
Respir Med 2024;12: 399-408.
37. Ellah A, ul-Hussain H, Cheema HA, et al. 937: short
versus prolonged course of antibiotics for ventilator-associated pneumonia: a
meta-analysis. Crit Care Med 2023; 51: 461.
38. Klompas M, Branson R, Cawcutt K, et al. Strategies to
prevent ventilator-associated pneumonia, ventilator-associated events, and
nonventilator hospital-acquired pneumonia in acute-care hospitals: 2022 Update.
Infect Control Hosp Epidemiol 2022; 43: 687-713.
39. Guillamet CV, Kollef MH. Is zero ventilator-associated
pneumonia achievable? Updated practical approaches to ventilator-associated
pneumonia prevention. Infect Dis Clin North Am 2024; 38: 65–86.
40. Consenso
interinstitucional sobre definiciones VIH-DA 2020. En: https://www.argentina.gob.ar/sites/default/files/ine_vihda_19_-_documento-de-consenso-definiciones-vihda-2020.pdf;
consultado noviembre 2024.
41. Ferreyro BL, Angriman F, Munshi L, et al. Association
of noninvasive oxygenation strategies with all-cause mortality in adults with
acute hypoxemic respiratory failure: a systematic review and meta-analysis. JAMA
2020; 324: 57–67.
42. Rochwerg B, Granton D, Wang DX, et al. High flow nasal
cannula compared with conventional oxygen therapy for acute hypoxemic
respiratory failure: a systematic review and meta-analysis. Intensive Care
Med 2019; 45: 563-72.
43. Granton D, Chaudhuri D, Wang D, et al. High-flow nasal
cannula compared with conventional oxygen therapy or noninvasive ventilation
immediately postextubation: a systematic review and meta-analysis. Crit Care
Med 2020; 48: e1129–e36.
44. Chaudhuri D, Granton D, Wang DX, et al. High-flow
nasal cannula in the immediate postoperative period: a systematic review and
meta-analysis. Chest 2020; 158: 1934–46.
45. Ananda P, Sony. Early tracheostomy in prolonged
mechanical ventilation due to severe head injury to prevent
ventilator-associated pneumonia (VAP). IJAR 2022; 4: 115-9.
46. Swain SK, Jena PP. Role of early tracheostomy for
preventing ventilator associated pneumonia in intensive care unit: a review. Int
J Otorhinolaryngol Head Neck Surg 2021; 7: 1083-8.
47. Chorath K, Hoang A, Rajasekaran K, Moreira A.
Association of early vs late tracheostomy placement with pneumonia and
ventilator days in critically ill patients: a meta-analysis. JAMA
Otolaryngol Head Neck Surg 2021;147: 450-9.
48. Graham ND, Graham ID, Vanderspank-Wright B, et al. A
systematic review and critical appraisal of guidelines and their
recommendations for sedation interruptions in adult mechanically ventilated
patients. Aust Crit Care 2023; 36: 889-901.
49. Klompas M. Potential strategies to prevent
ventilator-associated events. Am J Respir Crit Care Med 2015;192:
1420-30.
50. Lee Y-LL, Sims KD, Butts CC, et al. The combination of
SAT and SBT protocols may help reduce the incidence of ventilator-associated
pneumonia in the burn intensive care unit. J Burn Care Res 2017; 38:
e574–e9.
51. Klompas M, Anderson D, Trick W, et al. The
preventability of ventilator-associated events. The CDC prevention epicenters
wake up and breathe collaborative. Am J Respir Crit Care Med 2015; 191:
292-301.
52. Bulacio S. Impact of the implementation of a combo of
measures for the prevention of pneumonias associated with mechanical
ventilation. Salud,
Ciencia y Tecnología 2023;3:
548.
53. Owen RM, Chung KW. Ventilator-Associated Pneumonia. UK:
Oxford University Press, 2023.
54. Zhang L, Hu W, Cai Z, et al. Early mobilization of
critically ill patients in the intensive care unit: a systematic review and
meta-analysis. PLoS One 2019;14: e0223185.
55. Wang J, Ren D, Liu Y, Wang Y, Zhang B, Xiao Q. Effects
of early mobilization on the prognosis of critically ill patients: a systematic
review and meta-analysis. Int J Nurs Stud 2020;110: 103708.
56. Hsieh SJ, Otusanya O, Gershengorn HB, et al. Staged
implementation of awakening and breathing, coordination, delirium monitoring
and management, and early mobilization bundle improves patient outcomes and
reduces hospital costs. Crit Care Med 2019; 47: 885-93.
57. Zhang X, Zhu J, Wang L, et al. Routine (7 days) vs.
clinically indicated change of the noninvasive ventilator circuit for
prevention of hospital-acquired pneumonia: protocol for a randomized controlled
trial in 2 tertiary hospitals. Research Square Platform LLC 2022; doi:10.21203/rs.3.rs-2249098/v1
58. Songmuang J, Akatat P, Wattanagulanurak S, Rittayamai
N, Sripalakit S. Comparison study between using disposable and non-disposable
ventilator circuits on ventilator-associated pneumonia and health care costs at
a respiratory care unit, Siriraj Hospital. Siriraj Med J 2023; 75: 191–9.
59. Rutala WA, Weber DJ, Healthcare Infection Control
Practices Advisory Committee (HICPAC). Guideline for disinfection and
sterilization in healthcare facilities, 2008.:
En: https://stacks.cdc.gov/view/ cdc/134910; consultado noviembre 2024.
60. Sanaie S, Rahnemayan S, Javan S, Shadvar K, Saghaleini
S-H, Mahmoodpoor A. Comparison of closed vs open suction in prevention of
ventilator-associated pneumonia: a systematic review and meta-analysis. Indian
J Crit Care Med 2022; 26: 839-45.
61. Mulla RJ, Mohite VR. Efficacy of closed and open
endotracheal suction on prevention of ventilator-associated pneumonia on
patients admitted to critical care unit at tertiary care hospital. J Datta
Meghe Inst Med Sci Univ 2023; 18: 192-8.
62. Zangirolami
AC, Pingueiro LS, Rodrigues FMS, et al. Prevention of ventilation-associated pneumonia applying a functionalized
endotracheal tube and photodynamic therapy: a proof of principle with an
artificial intubation model. En: https://www.researchgate.net/publication/370921187;
consultado noviembre 2024.
63. Rahmalia
S, Utami S, Amir Y, et al. The
effect of close suction to prevent ventilator-associated pneu-monia based on
the sequence organ failure assessment score (sofa) and clinical pulmonary
infection score. KnE Med 2023; doi:10.18502/kme.v3i1.12708
64. Qi L, Guo X, Nie C, Lv X, Zhang M. Research on effects
of oropharyngeal aspiration on incidence of ventilator-associated pneumonia in
patients with cerebral hemorrhage in ICU. J Healthc Eng 2022; 2022:
6433666.
65. G Millot, Behal H, Jaillette E, et al. Relationship
between microaspiration and ventilator-associated events: a post-hoc analysis
of a randomized controlled trial. Intensive Crit Care Nurs 2025; 86:
103778.
66. Pozuelo-Carrascosa DP, Cobo-Cuenca AI, Carmona-Torres
JM, Laredo-Aguilera JA, Santacruz-Salas E, Fernandez-Rodriguez R. Body position
for preventing ventilator-associated pneumonia for critically ill patients: a
systematic review and network meta-analysis. J Intensive Care 2022; 10:
9.
67. Safavi A, Molavynejad S, Rashidi M, Asadizaker M,
Maraghi E. The effect of an infection control guideline on the incidence of
ventilator-associated pneumonia in patients admitted to the intensive care
units. BMC Infect Dis 2023; 23: 198.
68. Halili A, Ghafari S, Saghaei M, Atashi V. Prevention
of ventilator-associated pneumonia by a nose care program combining with oral
care among patients hospitalized in intensive care units: a single-blind
randomized controlled trial. Medicina Clinica Practica 2024; 7: 100401.
69. Grover V, Singh S Ventilator-associated pneumonia’, in Suveer Singh, Paolo Pelosi, and Andrew Conway
Morris (eds), Oxford Textbook of Respiratory Critical Care, Oxford
Textbooks in Critical Care En: https://doi.org/10.1093/med/9780198766438.003.0032; consultado noviembre 2024.
70. Mejía MBD.
Nursing care to prevent ventilator-associated pneumonias in adult patients. Community
Interculturality Dialogue 2023; 3: 69.
71. Izadi M, Bagheri M, Far AB, et al. Prevention of
ventilator-associated pneumonia in ICU patients by Ozonated water mouthwash: a
double-blind randomized clinical trial. Authorea Preprints 2024; doi:10.22541/au.170668060.05719805/v1
72. Kiabi FH, Baradari AG, Kiasari AZ, Shahheidari M. The
difference in mouthwash side effects of Persica and chlorhexidine for
preventing ventilator-induced pneumonia among patients admitted to the
intensive care unit. Open Public Health J 2023; 16: doi:10.2174/18749445-v16-e230607-2022-134
73. Chkhaidze N, Kherkheulidze M, Chkhaidze I. Probiotics
for the prevention of ventilator-associated pneumonia. Prev Ped 2024;
10: 33-8.
74. Li C, Lu F, Chen J, Ma J, Xu N. Probiotic
supplementation prevents the development of ventilator-associated pneumonia for
mechanically ventilated ICU patients: a systematic review and network
meta-analysis of randomized controlled trials. Front Nutr 2022; 9:
919156.
75. Roshanzamiri S, Alemzadeh M, Ahmadizadeh SN, et al.
Probiotic prophylaxis to prevent ventilator-associated pneumonia in children on
mechanical ventilation: a randomized double-blind clinical trial. Front
Pediatr 2022; 10: 1045941.
76. Han M, Wang K, Sun L, Liu W, Dong W. Prevention of
ventilator-associated pneumonia with probiotics: an overview of systematic
reviews. Front Microbiol 2024; 15: 1345278.
77. Rouzé A,
Jaillette E, Nseir S. Relationship between microaspiration of gastric contents
and ventilator-associated pneumonia. Ann Transl Med 2018; 6: 428.
78. Palagani Y, Sorkin E, Gupta R, Bonde P. Prevention of
ventilator associated pneumonia by gastric residual estimation using highly
coupled resonant enteric tube sensor system. J Am Coll Surg 2022; 235:
S82-3.
79. Khatri PK, Negi V, Kishoria N, Mathur N, Sharma. V.
Antibiotic susceptibility pattern of the potential pathogens of ventilator
associated pneumonia in the endotracheal tubes of critically Ill patients. Ina
J Med Lab Sci Tech 2023; 5: 123-32.
80. Marcut L,
Manescu Paltanea V, Antoniac A, et al. Antimicrobial solutions for endotracheal tubes in prevention of
ventilator-associated pneumonia. Materials 2023; 16: 5034.
81. Özdemir D, Görgün S, Çeçen A, et al. The effect of prolonged intubation on ventilator associated
pneumonia: endotracheal tube cuff is really steril or not? Kastamonu
Medical Journal 2023;
3: 60-3.
82. Da Silva
MGP, Manfroi LA, Lobo LZ, et al. Sputtering
of micro-carbon-silver film (μC-Ag)
for endotracheal tubes to mitigate respiratory infections. Biomed Mate 2023;
18: doi:10.1088/1748-605X/acba70
83. Damas P, Legrain C, Lambermont B, et al. Prevention of
ventilator-associated pneumonia by noble metal coating of endotracheal tubes: a
multi-center, randomized, double-blind study. Ann Intensive Care 2022;
12: 1-10.
84. Tincu RC, Cobilinschi C, Tincu IF, Macovei RA.
Efficacy of noble metal–alloy
endotracheal tubes in ventilator-associated pneumonia prevention: a randomized
clinical trial. Balkan
Med J 2022;
39: 167-71.
85. Liu W,
Yang Y, Jiao Y, et al. Evaluation
of the effects of applying the ventricular care bundle (VCB) method for
reducing ventilator-associated pneumonia (VAP) in the intensive care unit of a
general Chinese tertiary hospital. Ann Palliat Med 2020; 9: 2853-61.
86. Su K-C,
Kou YR, Lin F-C, et al. A
simplified prevention bundle with dual hand hygiene audit reduces early-onset
ventilator-associated pneumonia in cardiovascular surgery units: an interrupted
time-series analysis. PLoS One 2017; 12: e0182252.
87. Cotoia A, Spadaro S, Gambetti G, Koulenti D, Cinnella.
G. Pathogenesis-targeted preventive strategies for multidrug resistant
ventilator-associated pneumonia: a narrative review. Microorganisms 2020;
8: 821.
88. Wu H-L, Wu Y-H, Shen W-Q, et al. Risk factor
evaluation of cuff pressure of >30 cmH2O to stop air leakage
during mechanical ventilation: a prospective observational study. Nurs Open 2024;
11: e2187.
89. Wu Y, Zhao C, Sun M, Bu J, Hu Z, Yin Y. Efficacy of
endotracheal tube cuff modification in preventing ventilator-associated
pneumonia. J Coll Physicians Surg Pak 2023; 33: 1050-7.
90. Maertens B, Lin F, Chen Y, Rello J, Lathyris D, Blot
S. Effectiveness of continuous cuff pressure control in preventing
ventilator-associated pneumonia: a systematic review and meta-analysis of
randomized controlled trials. Crit Care Med 2022; 50: 1430-9.
91. Dat VQ, Minh Yen L, Thi Loan H, et al. Effectiveness
of continuous endotracheal cuff pressure control for the prevention of
ventilator-associated respiratory infections: an open-label randomized,
controlled trial. Clin Infect Dis 2022; 74: 1795-803.
92. Letvin A, Kremer P, Silver PC, Samih N, Reed-Watts P,
Kollef MH. Frequent versus infrequent monitoring of endotracheal tube cuff
pressures. Respir Care 2018; 63: 495–501.
93. Martinez EE, Melvin P, Callif C, Turner AD, Hamilton
S, Mehta NM. Postpyloric vs gastric enteral nutrition in critically ill
children: a single-center retrospective cohort study. JPEN J Parent Enteral
Nutr 2023; 47: 494–500.
94. Sakisaka M, Yoshii D, Sakisaka M, Inomata Y.
Modulation of tube feeding protocol to prevent aspiration pneumonia in
gastroesophageal reflux. Clinical Nutrition Open Science 2022; 43:
67-77.
95. Cook D, Deane A, Lauzier F, et al. Stress ulcer
prophylaxis during invasive mechanical ventilation. N Engl J Med 2024;
391: 9–20.
96. Elrod S, Kramer M, Marrache K, Tzarnas S, Madara JC,
Saeed R. Improving compliance with standard of care for stress ulcer
prophylaxis in intubated patients. CHEST 2023; 164: A1572
97. Chacko J, Pawar S, Seppelt I, Brar G. Stress ulcer
prophylaxis in the critically Ill. Controversies Critical Care 2023;
341-5.
98. Cornistein
W, Nuccetelli Y, Huaier Arriazu EF, Lares M, García MC, González AL, Cudmani N, Flores Montes M, De
Aguilar L, De Cristófano A, Blanco M. Neumonía asociada a ventilación mecánica.
Actualización y consenso
intersociedades, Sociedad Argentina de Infectología-
Sociedad Argentina de Terapia Intensiva 2024 [Ventilator-associated pneumonia. Update and intersociety consensus, Argentine Society
of Infectology - Argentine Society of Intensive Therapy 2024]. Medicina
(B Aires). 2025;85(3):556-571. Spanish. PMID: 40577143.