Guía de manejo de las infecciones de piel y
partes blandas
[Skin and soft tissue infections management
guideline]
Grupo de Trabajo Inter-Sociedades para la
confección de las Guías de manejo de las infecciones de piel y partes blandas
Lautaro De Vedia1, Claudia Rodríguez1, Marta Torres1, Nicolás Zujlevic1, Alicia Puscama1, Liliana Clara1, Andrés Sandor1, Corina Nemirovsky1, Eugenia Di Líbero1, Analía Mykietiuk1, Viviana Leiro2, Bernardo Kantor2, Patricia
Fernández Pardal2, María Elena Peña3, Ivana Pedraza
Salazar3, Marcelo Zylberman4, Adriana Romani4, Adolfo Savia4, Claudia Barberis5, Lucila Bonesi5, Luciana Di Cugno5, Flavia Amalfa5, Ana Matilde
Israel6, Eleonora Cunto7, Marco Flores
Montes7, Mónica Moyano1, Juan Manuel
Poggio1, Alejandra Margarí1, Flavio Rotryng1, Fernanda Barberis1, Natalia Pujato1, Gladys Ferrucci1, María Marta Greco1, Natalia Bello1
1Sociedad Argentina de Infectología, 2Sociedad Argentina de Dermatología, 3Asociación Argentina de Cirugía, 4Sociedad Argentina de Medicina, 5Asociación Argentina de Microbiología
Clínica-Sociedad Argentina de Bacteriología (SADEBAC), 6Sociedad de Medicina Interna de Buenos Aires, 7Sociedad Argentina de Terapia Intensiva,
Buenos Aires, Argentina
* Correspondencia: secreataria@sadi.org.ar
Los autores no
declaran conflictos de intereses.
https://doi.org/10.64955/jratiy2026x982
Resumen
Las infecciones de piel y partes blandas
(IPPB) son sumamente frecuentes, y si bien en una gran mayoría se trata de
casos leves, en ocasiones pueden provocar complicaciones locales y sistémicas
graves. Por tanto, su reconocimiento precoz y su adecuado manejo médico y
quirúrgico es de primordial importancia.
En el año 2009, la Sociedad Argentina de
Infectología (SADI), junto a otras sociedades científicas, publicó sus últimas
recomendaciones para el manejo de las IPPB. La presente Guía fue desarrollada
por especialistas pertenecientes a la Sociedad Argentina de Infectología (SADI)
y discutidas en una reunión plenaria con la participación de representantes de
otras seis Sociedades Científicas: Sociedad Argentina de Dermatología,
Asociación Argentina de Cirugía, Sociedad Argentina de Medicina, Asociación
Argentina de Microbiología Clínica, Sociedad de Medicina Interna de Buenos
Aires y Sociedad Argentina de Terapia Intensiva, en razón de su experiencia en
esta temática. En cada uno de los capítulos se mencionan recomendaciones
basadas en evidencia científica y en la opinión de expertos, incluyendo
herramientas útiles para el diagnóstico, con especial hincapié en la
apreciación clínica y los diagnósticos diferenciales, y la terapia
antimicrobiana con la atención puesta en el uso responsable de los
antibióticos.
Palabras clave: infecciones de piel y partes blandas,
infecciones necrosantes de tejidos blandos, infecciones necrosantes.
Abstract
Skin and soft tissue infections (SSTIs) are
extremely common, and while the vast majority are mild, they can occasionally
lead to serious local and systemic complications. Therefore, early recognition
and appropriate medical and surgical management are of primary importance.
In 2009, the Argentine Society of Infectious
Diseases (SADI), along with other scientific societies, published its latest
recommendations. This Guide was developed by specialists from the Argentine
Society of Infectious Diseases (SADI) and discussed in a plenary meeting with
the participation of representatives from six other Scientific Societies:
Argentine Society of Dermatology, Argentine Association of Surgery, Argentine
Society of Medicine, Argentine Association of Clinical Microbiology, Buenos
Aires Society of Internal Medicine, and Argentine Society of Intensive Care,
based on their experience in this subject. Each chapter contains
recommendations based on scientific evidence and expert opinion, including
useful diagnostic tools, with special emphasis on clinical assessment and
differential diagnoses, and antimicrobial therapy, with attention to the
responsible use of antibiotics.
Key words: skin and soft-tissue infections, necrotizing
soft-tissue infections, necrotizing infections.
Nota del editor:299
Este artículo fue publicado
originalmente en Medicina (Buenos Aires): De Vedia L, Rodríguez C,
Torres M, Zujlevic N, Puscama A, Clara L, Sandor A, Nemirovsky C, Di Líbero E,
Mykietiuk A, Leiro V, Kantor B, Fernández Pardal P, Peña ME, Pedraza Salazar I,
Zylberman M, Romani A, Barberis C, Bonesi L, Di Cugno L, Amalfa F, Israel AM,
Cunto E, Flores Montes M, Moyano M, Poggio JM, Margarí A, Rotryng F, Barberis
F, Pujato N, Ferrucci G, Greco MM, Bello N. Guía de manejo de las
infecciones de piel y partes blandas [Skin and soft tissue infections management
guideline]. Medicina (B Aires). 2025 May;85 Suppl 3:14-76.
Spanish. PMID: 40434403. Republicado en RATI con la autorización de los
editores y de los autores.
Las infecciones de
piel y partes blandas (IPPB) son sumamente frecuentes, y si bien en una gran
mayoría se trata de casos leves, en ocasiones pueden provocar complicaciones
locales y sistémicas graves. Por tanto, su reconocimiento precoz y su adecuado
manejo médico y quirúrgico es de primordial importancia1.
Las IPPB
representan una de las causas más frecuentes de consulta al sistema de salud a
nivel mundial2-4. Un estudio llevado a cabo en los EE. UU., que analizó la incidencia
de las IPPB entre los años 2010 y 2020, señaló que, durante ese período, 5.4
millones de personas experimentaron 9.1 millones de episodios, con una
incidencia de 77.5 casos por 1000 personas-año5. El estudio mostró que la incidencia anual de IPPB
fue de 32.1 casos por 1000 pacientes-año entre aquellos sujetos sin
antecedentes, frente a 113.5 casos por 1000 pacientes-año entre los que tenían
comorbilidades. La tasa de mortalidad asociada en los 30 días posteriores al
episodio ascendió del 2.6% en 2010 hasta el 4.6% en 2020, y la tasa de
recurrencia alcanzó el 26.3%5. El costo promedio de cada episodio fue de U$D
3334, y fue sustancialmente mayor en las infecciones del sitio quirúrgico (ISQ)5.
En cuanto a su
etiología, la mayoría de las infecciones están dadas por cocos Gram positivos
(CGP) aerobios, en especial Staphylococcus aureus y Streptococcus pyogenes, aunque,
en determinadas circunstancias clínicas o epidemiológicas, muchos otros
microorganismos pueden ser responsables6. En las últimas décadas, la aparición del S.
aureus con resistencia a la meticilina de origen comunitario (SAMR-Co) se
ha instalado como uno de los principales patógenos causantes de IPPB7. Según se describe en el capítulo de microbiología,
la etiología dependerá entre otros factores, de la epidemiología del paciente,
con lo cual resulta relevante recabar información que incluya su estado inmune,
comorbilidades (como diabetes, obesidad mórbida, insuficiencia vascular
periférica), historia de mordedura animal o traumatismos, viajes recientes y
exposición a antibióticos previos.
Las IPPB pueden
generar desde cuadro superficiales simples hasta infecciones necrosantes
graves, por lo que no es sencillo adoptar una clasificación única.
A los fines
prácticos, se las puede dividir, de acuerdo con las características clínicas,
en infecciones supuradas o no supuradas, y en función de la gravedad, en leves,
moderadas y graves8, 9.
Entre las IPPB no
supuradas se encuentran el impétigo, la erisipela y la celulitis no purulenta.
Estas dos últimas son los que generan un mayor número de consultas9, 10. El diagnóstico suele establecerse de manera
clínica, y la etiología más común suele ser S. aureus o S. pyogenes.
Sin embargo, en la mayoría de los episodios no se realiza el cultivo de partes
blandas, lo que dificulta la identificación precisa de la etiología9. De acuerdo con la presentación clínica pueden ser
clasificadas como leves, moderadas o graves9, 11, 12. Debido a que su
diferenciación en la práctica clínica es muchas veces, dificultoso, y, por otra
parte, el manejo de ambas tiene, en términos generales, aspectos muy similares,
en estas recomendaciones serán abordadas en conjunto.
Las IPPB supuradas
incluyen la forunculosis, el ántrax y los abscesos cutáneos, y en todos ellos,
el agente etiológico predominante es S. aureus9. En estos casos,
el desbridamiento suele ser el tratamiento de elección y el agregado de
antibióticos solo debe considerarse en ciertas situaciones9, 12, 13.
Las IPPB graves,
también conocidas como necrosantes, constituyen un grupo de entidades de
elevada morbimortalidad y que requieren un complejo tratamiento quirúrgico.
Incluyen cuadros como la fascitis necrosante, mionecrosis y gangrena gaseosa12, 13.
En el año 2009, la
Sociedad Argentina de Infectología (SADI), junto a otras sociedades
científicas, publicó sus últimas recomendaciones para el manejo de las IPPB10, 13, 14. Esta nueva versión aporta recomendaciones
actualizadas para el manejo clínico y quirúrgico apropiado de las IPPB,
incluyendo herramientas útiles para el diagnóstico, con especial hincapié en la
apreciación clínica y los diagnósticos diferenciales, y la terapia
antimicrobiana, con la atención puesta en el uso responsable de los
antibióticos.
Metodología
La presente Guía, y
sus recomendaciones fueron desarrolladas por especialistas pertenecientes a la
Sociedad Argentina de Infectología (SADI) y discutidas en una reunión plenaria
con la participación de representantes de otras seis Sociedades Científicas:
Sociedad Argentina de Dermatología, Asociación Argentina de Cirugía, Sociedad
Argentina de Medicina, Asociación Argentina de Microbiología Clínica, Sociedad
de Medicina Interna de Buenos Aires y Sociedad Argentina de Terapia Intensiva,
en razón de su experiencia en el manejo de las IPPB.
El proceso se
inició en abril de 2024, con la conformación de un Grupo de Trabajo (GT)
integrado por 7 infectólogos, pertenecientes a la Comisión de Uso Adecuado de
Recursos de la SADI, quienes tuvieron a su cargo la selección de los capítulos
a incluir, la metodología de búsqueda bibliográfica a emplear y la elección del
sistema a utilizar para la valoración de la evidencia.
El GT definió la
estructura de capítulos que aquí se presenta. Los miembros del GT se dividieron
en equipos de 2 ó 3 integrantes para la revisión de la literatura, la
evaluación de la evidencia y la redacción de cada uno de los capítulos. Cada
uno de ellos fue discutido en reuniones plenarias, en las que se acordó la
redacción del documento base (DB).
Para la búsqueda de
bibliografía se revisaron los estudios publicados en idioma inglés y español
relacionados con la etiología, el diagnóstico, el tratamiento y la prevención
de las IPPB en diferentes poblaciones adultas. Los mismos fueron identificados a
través de búsquedas en la base PubMed, LILACS, LATINDEX, Biblioteca Cochrane, y
la revisión de las referencias de los artículos más relevantes que permitiera
identificar otros estudios de valor para cumplir con el objetivo planteado. Los
estudios revisados incluyeron ensayos clínicos prospectivos y aleatorizados,
estudios prospectivos de cohortes, estudios de casos y controles y otros tipos
de estudios descriptivos. Se excluyeron estudios cuyos resultados, por adolecer
de una pobre validez interna y externa, no permitían obtener conclusiones
generalizables. Además, se revisaron otras Guías de Práctica Clínica y
Recomendaciones internacionales.
Las recomendaciones
de esta Guía se basan en evidencia científica y en la opinión de expertos. Cada
declaración de recomendación incluye una letra (A, B o C) que representa la
fuerza de la recomendación y un número (I, II o III) que representa la calidad
de la evidencia que respalda la recomendación.
Fuerza de la recomendación
A: Recomendación
fuerte, B: Recomendación moderada, C: Recomendación débil.
Calidad de la evidencia
I: Uno o más
estudios aleatorios con resultados clínicos y/o resultados de laboratorio
validados, II: Uno o más ensayos no aleatorios bien diseñados o estudios
observacionales de cohortes con resultados clínicos a largo plazo, III: Opinión
de expertos.
Una vez finalizado,
el DB fue enviado el 2 de octubre de 2024 a las autoridades de las Sociedades
Científicas invitadas y a todos los socios de SADI inscriptos para participar
en la Reunión Plenaria (RP), a fin de que cada uno hiciera su evaluación.
La RP se llevó a
cabo el día 1 de noviembre de 2024, en la sede de SADI, en la ciudad de Buenos
Aires. Se presentaron y discutieron cada uno de los capítulos, y se acordó la
redacción de la versión final que aquí se presenta.
En cada uno de los
capítulos se mencionan recomendaciones para el diagnóstico, tratamiento y
prevención de las IPPB. Es de hacer notar que, en relación con los
antimicrobianos, solo se mencionan los mismos, sin
las dosis o ajustes habituales. En la Tabla 1
se puede encontrar el listado conteniendo las dosis para adultos y niños de los
antibióticos mencionados, así como la recomendación para su adaptación en
situaciones especiales, como obesidad o insuficiencia renal15, 16.
|
TABLA 1 Dosis
de los antimicrobianos para adultos y niños, ajuste por sobrepeso y necesidad
de ajuste por fallo hepático y renal15,16 |
|||||
|
Antimicrobiano |
Dosis en adultos |
Dosis pediátrica |
Ajuste por sobrepeso |
Ajuste por fallo hepático |
Ajuste por fallo renal |
|
Amikacina |
15-20
mg/kg c/24 h Dosis máxima: 1.5 g |
15
mg/kg/día c/12-24 h Dosis máxima: 1500 mg/día |
Dosis
según peso ajustado (valor de C=0.4) |
No
requiere |
FG 50-10 ml/min: 7.5 mg/kg c/24 h o 15 mg/kg c 48 h FG ≤10 ml/min 7.5 mg/kg c/48-72 h HD: 7.5 mg/kg c/48-72 h. Los días de diálisis administrar post-HD |
|
Amoxicilina |
500
mg c/8 h 875 mg c/12 h |
Infecciones moderadas: 40 mg/kg/día c/8 h
Infecciones graves: 75-100 mg/kg/día c/8-12 h |
No
requiere. Se recomienda usar las dosis máximas |
No
requiere |
FG 50-30 ml/min 500 mg c/8-12 h FG 10-30
ml/min 500 mg c/12 h FG ≤10 ml/min
500 mg c/24 h HD:
500 mg c/24 h Los días de HD administrar
post-HD |
|
Amoxicilina- ácido
clavulánico |
875/125
mg c/8-12 h |
20-40
mg/kg/día de amoxicilina, c/8 h |
No
requiere. Se recomienda usar las dosis máximas |
No
requiere |
FG 50-30 ml/min 850/125 mg c/8-12 h FG 10-30 ml/min
500/125 mg c/12 h FG
≤10 ml/min 500/125 mg c/24 h HD: 500/125 mg c/24 h Los días de HD administrar
post-HD |
|
Ampicilina |
1-2
g c/6 h Infecciones graves: hasta 2 g c/4 h |
100
mg/kg/día c/6 h Dosis máxima: 12 g/día |
No
requiere. Se recomienda usar las dosis
máximas Utilidad de infusiones prolongadas |
No
requiere |
FG 50-30 ml/min 1-2 g c/6-8 h FG
10-30 ml/min 1-2 g c/8-12
h FG ≤10 ml/min 1-2 g c/12-24 h HD: 1-2 g c/12-24 h Los días de HD administrar
post-HD |
|
Ampicilina
sulbactam |
1-2
g c/6 h (Dosificación en base a ampicilina) |
150
mg (ampicilina + sulbactam) /kg/día c/6 h Dosis máxima: 6 g/día (ampicilina+ sulbactam) |
No
requiere. Se recomienda usar las dosis
máximas Utilidad de infusiones prolongadas |
No
requiere |
FG 50-30 ml/min 1-2 g c/6-8 h FG
10-30 ml/min 1-2 g c/8-12
h FG ≤10 ml/min 1-2 g c/12-24 h HD: 1-2 g c/12-24 h. Los días de HD administrar
post-HD |
|
Azitromicina |
500
mg c/24 h durante 3 días |
≤
6 meses: 10 mg/kg/día c/24 h durante 5 días ≥ 6 meses: 1er día 10 mg/kg/día Dosis máxima: 500 mg, luego 5 mg/kg/día (máximo 250 mg) hasta completar 5 días |
No
requiere |
No
requiere |
No
requiere |
|
Cefadroxilo |
500
mg-1 g c/12 h |
30
mg/kg/día, dividido en 2 dosis. |
No
requiere |
No
requiere |
FG
10-30 ml/min 1 g inicial, luego 500
mg-1 g c/24 h FG ≤10 ml/min 1 g inicial,
luego 500 mg-1 g c/36 horas HD: 1 g c/72, con dosis suplementaria de 1 g post-HD |
|
Cefazolina |
1-2 g c/8 h |
25 a 50 mg/kg/día,
repartidos en 3-4 dosis. Dosis máxima: 100 mg/kg/día. |
No requiere. Se recomienda usar las dosis
máximas Utilidad de infusiones prolongadas |
No requiere |
FG
10-30 ml/min 500-100 mg c/12 h FG
≤10 ml/min 1 g c/24 h HD:
1 g c/24-48 h. Los días de HD administrar
una dosis post-HD |
|
Cefalexina |
500-1000
mg c/6 h |
25-50
mg/kg/día c/6 h Infecciones graves: 50-100 mg/kg/día c/6 h Dosis máxima: 3 g/día |
No
requiere Se recomienda utilizar dosis máximas |
No
requiere |
FG 50-30 ml/min 500-1000 mg c/8-12 h FG 10-30 ml/min 500-1000 mg c/8-12
h FG
≤10 ml/min 500-1000 mg c/24 h HD: 500-1000 mg c/24 h Los días de HD administrar
post-HD |
|
Cefepime |
1-2
g c/8 h |
50
mg/kg cada 8-12 h |
No
requiere. Se recomienda usar las dosis
máximas Utilidad de infusiones prolongadas |
No
requiere |
FG 50-30 ml/min 1-2 g c/12 h FG 10-30 ml/min 1 g c/12-24 h FG
≤10 ml/min 500 mg-1 g c/24 h HD: 1 g c/24 h. Los días de HD administrar
post-HD |
|
Ceftarolina |
600
mg c/8-12 h |
Neonatos
hasta 2 meses: 6 mg/kg/dosis c/8 h ≥2 meses a ≤2 años: 8 mg/kg/dosis c/8 h ≥2 años a ≤12 años: 12 mg/kg/dosis (máximo 400
mg c/8 h) Adolescentes 12 a ≤18 años con peso ≤33 kg: 12 mg/kg/dosis (máximo 400
mg c/8 h) Adolescentes entre 12 a ≤18 años con peso ≥33 kg: 600
mg/dosis c/12 h |
No
requiere ajustes Considerar administración cada 8 horas |
No
requiere |
FG 50-30 ml/min 400 mg c/8-12 h FG
10-30 ml/min 300 mg c/8-12 h FG
≤10 ml/min 200 mg c/8-12
h HD: 200 m g c/8-12 h |
|
Ceftriaxona |
1-2
g c/12-24 h |
Infecciones
leves y moderadas: 50-75 mg/kg/día, c/24 h Infecciones graves: 100 mg/kg/día c/24 h Dosis máxima: 2 g/día |
No
requiere. Se recomienda usar las dosis
máximas Utilidad de infusiones prolongadas |
No
requiere |
No
requiere |
|
Ciprofloxacina |
VO: 500 mg c/12 h EV:
200-400 mg c/12
h |
20-30
mg/kg/día c/12 h Dosis máxima: VO: 500 mg/dosis EV: 400 mg/dosis |
Dosis
según peso ajustado C = 0.45 |
No
requiere |
VO FG
10-30 ml/min 500 mg c/24 h FG
≤10 ml/min 500 mg c/24 h HD: 500 g c/24 h Los días de HD administrar
post-HD EV FG
10-30 ml/min 200-400 mg c/24 h FG
≤10 ml/min 200-400 mg c/24 h HD: 200-400 mg c/24 h Los días de HD administrar
post-HD |
|
Claritromicina |
500
mg c/12 h |
Niños
15 mg/kg/día, c/12 h Adolescentes: 500 mg c/12 h Dosis máxima 1 g/día |
Dosis
según peso ideal |
No
requiere |
FG 10-30 ml/min 250 mg c/12 h FG
≤10 ml/min 250 mg c/12 h HD: 250 g c/12 h |
|
Clindamicina |
VO: 300
mg c/6-8 h EV
600 mg c/6-8 h |
Recién
nacidos: según edad y peso. ≥1 mes y niños: 30 mg/kg/día, c/6-8 h Dosis máxima: EV: 4.8 g/día VO 1.8 g/día Adolescentes: EV 1.2 a 2.7 g/día en 2 a 4 dosis Dosis
máxima: 4.8 g/día VO: 150 a 450 mg/dosis c/6-8 h Dosis máxima: 1.8 g/día |
No
requiere |
No
requiere |
No
requiere |
|
Daptomicina |
4-8
mg/kg c/24 h |
Niños
2-6 años: 8-10 mg/kg/día c/25 h 6-12 años: 7 mg/kg/día c/24 h ≥12 años: 4-6 mg/kg/día c/24 h Infecciones graves: 10 mg/kg/día |
Dosis
en unción del peso corporal total a razón de 4 mg/kg o peso ajustado con C=0.4 |
Child
C: precaución |
FG 10-30 ml/min 4-8 mg/kg c/48 h FG
≤10 ml/min 4-8-mg/kg c/48 h HD: 4-8 mg/kg c/48 h Los días de HF administrar
post-HD |
|
Doxiciclina |
100
mg c/12 h |
No
utilizar en recién nacidos, lactantes y menores de 8 años. Entre 8-12 años: ≥45 kg: dosis inicial: 4.4
mg/kg (en dosis única o dividida en dos) el primer día, seguido de una dosis
de mantenimiento de 2.2 mg/kg (en dosis única o dividida en dos dosis
iguales) los días siguientes. ≥45 kg: igual que en adultos |
No
requiere |
No
requiere |
No
requiere |
|
Eritromicina |
VO: 250-500 mg c/6-8
h EV:
500-1000 mg c/6
h |
40-50
mg/kg/día, c/6-8 h Dosis máxima 2 g/día |
No
requiere ajustes. Se recomienda usar dosis máximas. Utilidad de infusiones prolongadas |
Child
A: sin cambios Child B/C: Evitar altas dosis |
VO FG
≤10 ml/min 125-250 mg c/6-8 h HD: No requiere ajustes.
Administrar dosis post-HD EV FG
≤10 ml/min 250-500 mg c/24 h HD: No requiere ajustes.
Administrar dosis post-HD |
|
Gentamicina |
1-1.7
mg/kg c/8 h |
5-7.5
mg/kg/día c/8-12 h Dosis máxima 300 mg/día |
Utilizar
peso ajustado con C=0.4 |
No
requiere ajustes |
FG 40-60 ml/min: 1-1.7 mg/kg c/12 h FG
20/40 ml/min: 1-1.7 mg/kg c/24 h FG10-20
ml/min: 1-2 mg/kg c/24-48 h FG≤10
ml/min: 1-2 mg/kg c/48 h HD: 1.7 mg/kg c/48 h Se recomienda dosificar si
valores farmacocinéticos en valle son ≤ 1 mcg/ml |
|
Levofloxacina |
500-750
mg c/24 h |
6
meses a 5 años: 10 mg/kg/dosis c/12 h Dosis máxima: 500 mg/día Mayores de 5 años: 10 mg/kg/ dosis c/24 h Dosis máxima: 1 g/día |
Se
recomienda utilizar dosis máximas Otros autores sugieren dosificar en
función del peso ajustado, con C=0.45 |
No
requiere ajustes |
FG 50-30 ml/min 500-750 mg c/48 h FG 10-30 ml/min 500-750 mg
(1 dosis), luego 250-500 mg c/48 h FG ≤10 ml/min 500-750 mg (1
dosis), luego 250-500 mg c/48 h HD: 500-750 mg (1 dosis),
luego 250-500 mg c/48 h Los días de HD administrar
post-HD |
|
Linezolid |
600
mg c/12 h |
Neonatos
pretérmino menores de 7 días: 10 mg/kg/dosis c/12 h Recién nacidos a 11 años: 10 mg/kg/dosis c/8 h ≥11 años a 18 años: 10 mg/kg/dosis c/12 h Máximo 1200 mg/día |
No
requiere ajustes |
No
requiere ajustes |
No
requiere ajustes |
|
Meropenem |
500-1000
mg c /8 h |
60
mg/kg/día, c/6-8 h Dosis máxima: 3 g/día |
No
requiere ajustes |
No
requiere ajustes Se recomienda utilizar las dosis máximas Utilidad de las infusiones prolongadas |
FG 50-30 ml/min 500-1000 mg c/12 h FG
10-30 ml/min 500 mg c/12 h FG
≤10 ml/min 500 mg c/24 h HD: 500-1000 mg c/24 h Los días de HD administrar
post-HD |
|
Metronidazol |
500
mg c/8 h |
30
mg/kg/día c/8 h Dosis máxima: VO 2 g/día EV 4 g/día |
No
requiere ajustes |
Child
A: Sin cambios. Considerar 500 mg c/12 h Child
B/C: 250 mg c/8 h o 500 mg c/12 h |
No
requiere ajustes En HD: administrar post-HD |
|
Minociclina |
100
mg c/12 h |
≥8
años: carga 4
mg/kg, luego 2 mg/kg/dosis c/12 h Máximo: 200 mg/día. En caso de infecciones por gérmenes multirresistentes: dosis máxima 400 mg/día |
No
requiere |
No
requiere |
No
requiere |
|
Mupirocina |
Crema
al 2% 3 veces por día Ungüento nasal al 2% 2-3 veces por día |
Crema
al 2% 3 veces por día Ungüento nasal al 2% 2-3
veces por día |
No
requiere |
No
requiere |
No
requiere |
|
Penicilina
G sódica |
1.4
millones UI c/4-6 h |
Infecciones
leves y moderadas: 100 000-150 000 UI/kg/día c/6 h Dosis máxima: 8 000 000 UI/día. Infecciones graves: 200 000-300 000 UI/kg/día c/4 h. Dosis máxima: 24 000 000 UI/día |
No
es necesario ajuste Se recomienda utilizar las dosis máximas Utilidad de infusiones prolongadas |
No
requiere |
FG
10-30 ml/min 1-3 millones UI c/4-6 h FG ≤10 ml/min 1-2 millones
UI c/4-6 h HD: Infecciones leves: 0,5-1
millones UI c/4-6 h o 1-2 millones UI c/8-12 h Infecciones graves: 2
millones UI c/4-6 h o 4 millones UI c/8-12 h |
|
Penicilina benzatínica |
2.4
millones UI/IM |
50
000 UI/kg/dosis Dosis máxima: 2 400 000 UI/dosis |
No
es necesario ajuste Se recomienda utilizar las dosis máximas |
No
requiere |
No
requiere |
|
Penicilina
V oral |
200
000 a 800 000 UI c/6-8 h |
≤12
años: 40 000-80 000 UI/kg/día, c/6-8 h Dosis máxima: 4.800.000 UI/día ≥ 12 años: 200 000-800 000 UI/día, c/6-8 h |
No
es necesario ajuste Se recomienda utilizar las dosis máximas No es necesario ajuste |
No
requiere |
No
requiere FG 10-30 ml/min Infusión intermitente: 2.25
g c/6 h Infusión prolongada 4.5 g
c/12 h FG ≤10 ml/min Infusión intermitente 2.25 g
c/8 h Infusión prolongada 4.5 g
c/12 h HD:
2.25 g c/8 h, más 750 mg post-HD |
|
Piperacilina-tazobactam |
4.5
g c/6-8 h |
300-450
mg/kg/día c/6-8 h Dosis máxima: 18 g/día |
Se
recomienda utilizar las dosis máximas Utilidad de infusiones prolongadas |
|
|
|
Rifampicina |
600
mg c/24 h |
Menores
de 1 mes: 10 mg/kg/día Mayores de 1 mes: 10-20 mg/kg/día Dosis máxima: 600 mg/día |
Dosis
según peso ideal |
Child
A: sin cambios Child B/C: 300-600 mg c/24 h |
No
requiere |
|
Tigeciclina |
50
mg/12 h |
Niños
de 8 a 12 años: 1.2 mg/kg/dosis c/12 h Dosis máxima: 50 mg c/12 h Mayores de 12 años: dosis
igual que en adultos |
Dosis
estándar |
Child
A-B: sin cambios Child C: 25 mg c/12 h |
No
requiere |
|
Trimetoprima/ sulfametoxazol |
160
TMP mg/12 h |
Expresado
en dosis de trimetoprima 8-12 mg//kg/día c/12 h Dosis máxima: 320 g/día Infecciones graves: 20
mg/kg/día c/6-12 h |
Dosis
según peso ajustado (valor de C=0,4) |
Child
A: sin cambios Child B: sin cambios/disminuir a la mitad Child C: Evitar |
FG
10-30 mil/min: 50% de la dosis recomendada FG ≤10 ml/min No se
recomienda. Si es necesario: 2,5-5 mg/kg TMP c/24 h. HD: no se recomienda. Si es
necesario 2.5-5 mg/kg TMP c/24 h |
|
Vancomicina |
15-20
mg/kg cada 8-12 h |
40-60
mg/kg/día, c/6-8 h Dosis máxima 2 g/día |
Dosis
en función del peso corporal total |
No
requiere |
FG 50-30 ml/min 10-15 mg/kg c/24
h FG 10-30 ml/min 10-15 mg/kg c/24-36
h FG
≤10 ml/min 10-15 mg/kg c/48 h HD: 10-15 mg/kg c/24-48 h Los días de HD administrar
post-HD |
|
FG: filtrado glomerular;
HD: hemodiálisis; EV: endovenoso; VO: vía oral; TMP: trimetoprima. Cálculo del peso ideal
(Fórmula de Devine): • Peso corporal ideal
masculino = 50 kilogramos + [0.9 kilogramos × (altura (cm) - 152)]. • Peso corporal ideal
femenino = 45.5 kilogramos + [0.9 kilogramos × (altura (cm) - 152)]. Cálculo del peso ajustado:
Peso ideal + [(Peso corporal total – Peso ideal) x C]. |
|||||
En la Tabla 2 se
exhibe el PEN-FAST, un score predictivo del riesgo de alergia a
penicilina, el cual permite una rápida evaluación de la situación, que muchas
veces es sobreestimada en la práctica cotidiana y que deriva en la elección de antimicrobianos
menos eficaces17.
|
TABLA
2 Regla de decisión clínica para determinar la alergia a penicilina (PEN-FAST)17 |
|||
|
Antecedentes de alergia a penicilina |
NO |
0 puntos |
|
|
|
SÍ |
Registro
de episodio hace menos de 5 años Antecedente
de anafilaxia o angioedema Reacción
cutánea severa Recibió tratamiento para la reacción |
2
puntos 2
puntos 2
puntos 1 punto |
|
Interpretación |
0
puntos 1-2
puntos 3
puntos 4-5 puntos |
Riesgo
muy bajo, 1 en 100 pacientes reportan alergia (1%) Riego
bajo de alergia, 1 en 20 pacientes (5%) Riesgo
moderado, 1 en 5 pacientes (20%) Riesgo elevado |
|
|
Indicado
para la evaluación del riesgo de alergia a penicilina en pacientes con
antecedentes, especialmente cuando se considera la penicilina o un b-lactámico relacionado. Esta herramienta tiene un
alto valor predictivo negativo (VPN del 96.3% para puntuaciones <3), lo
que la hace eficaz para descartar la alergia a la penicilina en casos de bajo
riesgo. Su uso en el punto de atención puede ayudar a reducir la evitación innecesaria de la penicilina en pacientes de bajo riesgo, minimizando la necesidad de alternativas antibióticas de amplio espectro. |
|||
En la Tabla 3 se
presentan los criterios generales a utilizar para la definición del sitio de
manejo de un paciente con IPPB (ambulatorio, ingreso en piso general, unidad de
cuidados críticos), de acuerdo con la gravedad de los signos y síntomas locales
y sistémicos de la infección, y la presencia y estabilidad de las
comorbilidades6.
|
TABLA 3 Criterios
generales para la definición del sitio de manejo de un paciente con
infecciones de piel y partes blandas6 |
||
|
Clase |
Características
clínicas |
Sitio
de manejo |
|
I |
Paciente
sin signos o síntomas de enfermedad sistémica, y sin comorbilidades que
puedan complicar el tratamiento. |
Manejo
ambulatorio. |
|
II |
Pacientes
con signos sistémicos de infección pero que no presentan comorbilidades de
riesgo o, por el contrario, sin signos sistémicos de infección pero que
tienen comorbilidades que potencialmente puedan descompensarse. |
Manejo
ambulatorio con administración de
terapia parenteral en domicilio o en el departamento
de emergencias. |
|
III |
Pacientes
con signos sistémicos de infección, requerimiento de medicación parenteral y
potencial necesidad de tratamiento quirúrgico. |
Manejo
en sala general. |
|
IV |
Pacientes
con signos de SIRS e hipotensión, inmunodepresión o progresión rápida,
potencialmente mortales. |
Manejo
en unidad de cuidados críticos |
|
SIRS:
síndrome Inflamatorio de respuesta sistémica. |
||
Tanto los miembros
del GT como los participantes en la RP firmaron una declaración de conflictos
de intereses que pudieran afectar la objetividad del presente Consenso. Dicha
declaración se publica al final del documento.
Microbiología
Las infecciones que
comprometen la piel son producto de un desbalance entre los mecanismos de defensa
de la barrera cutánea y los factores de virulencia y patogenicidad de los
microorganismos que la afectan. Los principales organismos que generan las IPPB
son bacterias, pero otros agentes como virus, parásitos y hongos también tienen
un rol no menor, por lo que se los debe incluir dentro de los diagnósticos
diferenciales1, 8-10, 18.
Las IPPB incluyen a
todos aquellos procesos que afectan la piel y los anexos cutáneos, tejido
celular subcutáneo, fascias y músculo estriado. Pueden estar producidas por una
amplia variedad de microorganismos que forman parte de la microbiota local, o
bien, proceder del medio ambiente1, 8-10, 18 (Tabla 4).
Los microorganismos penetran a través de soluciones de continuidad en la piel o
en las mucosas, secundariamente a la producción de una herida traumática,
quemadura o mordedura (origen exógeno), como complicación de la cirugía (origen
endógeno) o desde un foco de infección distante a través de la sangre
(diseminación hematógena)1, 9, 10. El espectro de este tipo de infecciones abarca
desde procesos leves hasta cuadros graves con gran afectación sistémica que
precisan de una intervención quirúrgica inmediata19.
|
TABLA
4 Etiología bacteriana de las infecciones de piel y partes blandas1, 8-10 |
|
|
Impétigo y ectima |
S.
pyogenes,
principalmente grupo A, y menos frecuentemente grupos C y G S. aureus |
|
Forunculosis |
S. aureus |
|
Abscesos cutáneos |
S.
pyogenes grupo
A Staphylococcus aureus |
|
Erisipela y celulitis |
S.
pyogenes,
principalmente grupo A, y con menor frecuencia B, C y G S. aureus Otros: Pseudomonas spp y Aeromonas spp, Pasteurella, bacilos gram negativos, flora polimicrobiana. |
|
Infección del sitio quirúrgico |
S.
aureus, S. epidermidis E. coli, Klebsiella
pneumoniae, Enterobacter cloacae Otros. P. aeruginosa, Estafilococos coagulasa negativo, Proteus mirabilis, A. baumanii |
|
Fascitis necrotizante |
S.
pyogenes,
principalmente grupo A, y con menor frecuencia B, C y G S. aureus E. coli, K. pneumoniae Clostridioides spp.,
Aeromonas spp.
o Vibrio spp. Hongos: Candida, filamentosos como Aspergillus spp. o Zigomicetes |
|
Gangrena gaseosa |
Clostridium
perfringens y
otras especies de Clostridium (C. novyi, C. histolyticum, C. sordellii, C. septicum) |
|
Piomiositis |
S.
aureus S. pyogenes, principalmente grupo A, y
con menor frecuencia B, C y G Bacilos Gram negativos (E. coli, otros) |
|
Mordeduras de animales |
S.
pyogenes S, aureus, Moraxella, Neisseria, Fusobacterium, Bacteroides, Porphyromonas y Prevotella spp.,
bacilos gram negativos, Pasteurella multocida es prevalente en mordeduras de perros y gatos |
|
Enfermedad por arañazo de gato/angiomatosis bacilar |
Bartonella henselae, Bartonella quintana |
El objetivo de este
capítulo es describir los principales agentes involucrados en las IPPB y
mostrar las principales tasas de resistencia a los antimicrobianos en las
especies bacterianas más frecuentemente aisladas en infecciones de la
comunidad, con el objeto de que sirva para la selección de los tratamientos
antimicrobianos más adecuados. Esto último toma gran importancia en la
actualidad debido al aumento de la resistencia antibiótica a nivel mundial,
favorecido por el mal uso y abuso de los antimicrobianos que disponemos a la
fecha. Para la presente revisión se analizaron los artículos más relevantes y
recientes en cuanto a enfermedad infecciosa cutánea, y los datos que disponemos
de la Red Nacional de Vigilancia de la Resistencia a los Antimicrobianos WHONET
Argentina, coordinada por el Servicio Antimicrobianos del INEI - ANLIS Dr. C.
G. Malbrán, Laboratorio Nacional/Regional de Referencia en la Resistencia a los
Antimicrobianos (LNR) y Centro Colaborador de WHO en Vigilancia de la
Resistencia a los Antimicrobianos20, de forma de poner a disposición el conocimiento
más actualizado posible.
Agentes patógenos
Cuando se hace
referencia a las IPPB, los patógenos más relevantes son S. aureus y S.
pyogenes8, 9, 21. Los bacilos Gram
negativos (BGN) son otro grupo bacteriano importante, sobre todo en pacientes
hospitalizados22. Hay que considerar la localización de patógenos en determinadas
áreas particulares, como Cutibacterium acnes (antes llamado Propionobacterium
acnes) en cintura escapular y región craneana23, Staphylococcus lugdunensis o BGN en la piel
que está por debajo del nivel del diafragma24 o Enterococcus en la región inguinal25. En un análisis presentado por la red WHONET sobre
3836 aislamientos recuperados de IPPB26, de los cuales el 70% (2681 aislamientos) eran de
origen hospitalario (IPPB-H), y 30% (1155
muestras) provenían de
la comunidad (IPPB-C), se
obtuvieron los siguientes datos: entre las IPPB-C, los patógenos de mayor
frecuencia fueron S. aureus (46%), E. coli (9.4%), E. faecalis
(6.4%) y S. agalactiae (4.8%), mientras que en las IPPB-H la
distribución fue S. aureus (23%), E. coli (12%), Klebsiella
pneumoniae (8%) y Pseudomonas aeruginosa (7.5%). Estos hallazgos
confirman que los CGP son predominantes entre las IPPB de origen comunitario,
mientras que en las hospitalarias adquieren relevancia también los BGN.
En cuanto a la
población pediátrica, los datos sobre la prevalencia de las IPPB son escasos.
Según informó la red WHONET, los microorganismos más frecuentemente aislados de
IPPB en pacientes pediátricos durante el período 2009-2010 fueron los
siguientes: en menores de 12 meses, S. aureus (85.4%), SBHGA (3.4%), P.
mirabilis (2%) y P. auriginosa (2%); entre 1 y 5 años: S. aureus (84%),
SBHGA (3%) y H. influenzae tipo B (HiB) (2%); y entre 6 y 15 años, S.
aureus (76.4%) y SBHGA (5.8%)27.
• Staphylococcus
aureus: Este coco Gram positivo que se agrupa formando
racimos es el principal microorganismo patógeno involucrado en las IPPB. Se
encuentra en un 30-40% de los hisopados nasales en la población22. Los determinantes del daño causado al huésped son
factores ambientales como traumatismos, comorbilidades, infecciones activas,
sumado a factores de virulencia específicos del microorganismo7, 18, 21. Una de las características de este agente es su
capacidad de evasión del sistema inmune, específicamente debido a que secreta
moléculas que inhiben la diapédesis y, por ende, la migración de los
neutrófilos, bloquean la fagocitosis o alteran las vías apoptóticas de los
polimorfonucleares. Estos fenómenos permiten al S. aureus generar una gran
variedad de manifestaciones clínicas, desde foliculitis aisladas a infecciones
necrosantes con riesgo vital7, 18, 21, 28.
Desde principios de
este siglo se observó una creciente incidencia de IPPB causadas por S.
aureus meticilino resistente adquirido en la comunidad (SAMR-AC), cuyo
mecanismo de resistencia es la expresión del gen mecA, que codifica para una
PBP (penicillin binding protein) diferente, la PBP-2a, con menor
afinidad por meticilina y sus derivados28-30. El SAMR-AC se caracteriza además por producir
diferentes exotoxinas, entre ellas la leucocidina de Panton-Valentine, la cual
produce daño tisular8, 29-31.
En comparación con
las infecciones asociadas a cuidados de la salud, este tipo de resistencia
puede afectar a personas más jóvenes, pero en general mantiene la sensibilidad
a diversos antimicrobianos no betalactámicos7, 31, 32.
Prevalencia global, regional y local: En un estudio conducido por SADI, publicado en 201332, se evaluaron 311 pacientes con IPPB provenientes
de la comunidad, observándose que el SAMR-AC fue el agente causal en el 70.1%
de los cuadros, frente a 9.6% de casos por SAMS y 20.3% por otros
microorganismos. Otros trabajos locales mostraron datos similares, tanto en
población adulta29 como pediátrica33.
Sin embargo, en el
reporte de la red WHONET publicado en 202420, se observa que, en los últimos años, el porcentaje
SAMR en aislamientos de todo el país exhibe una tendencia decreciente,
particularmente en muestras provenientes de IPPB, con un descenso desde el
65.5% en 2010-2013 al 43.6% en 2022-2023 (Fig. 1). Debe considerarse que esta
distribución presenta una amplia variación geográfica (Fig. 2): igual o mayor
al 50% en la región norte del país, del 25 al 50% en Cuyo, centro, Buenos Aires
y Ciudad Autónoma de Buenos Aires (CABA) y entre 10 y 25% en la Patagonia34.
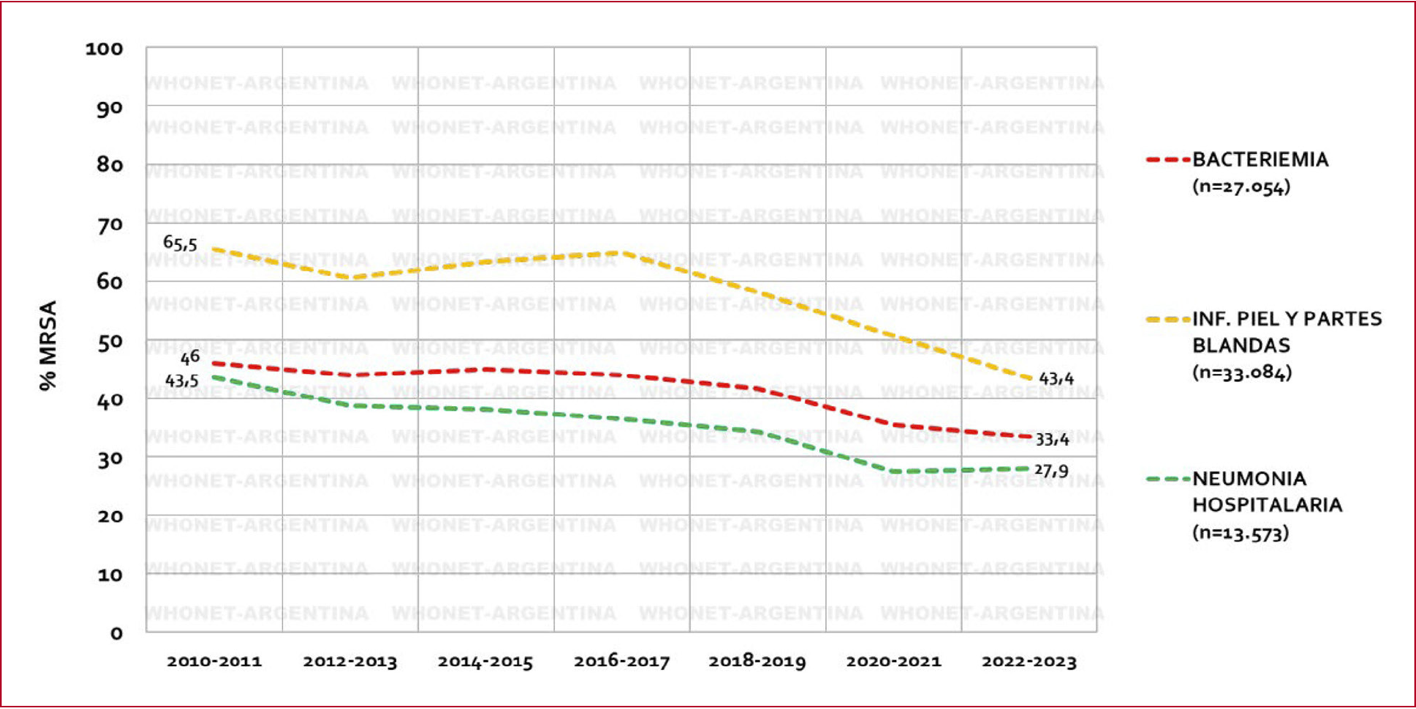
Figura 1. Evolución del porcentaje de
Staphylococcus aureus meticilino resistente según el tipo de infección
2010-2023, de acuerdo con los datos de la Red WHONET20
Para más información, consultar en: http://antimicrobianos.com.ar/wp-content/uploads/2024/05/Vigilancia-Nacional-de-la-Resistenciaa-los-Antimicrobianos-Red-WHONET-Argentina-Tendencia-2013-2023.pdf
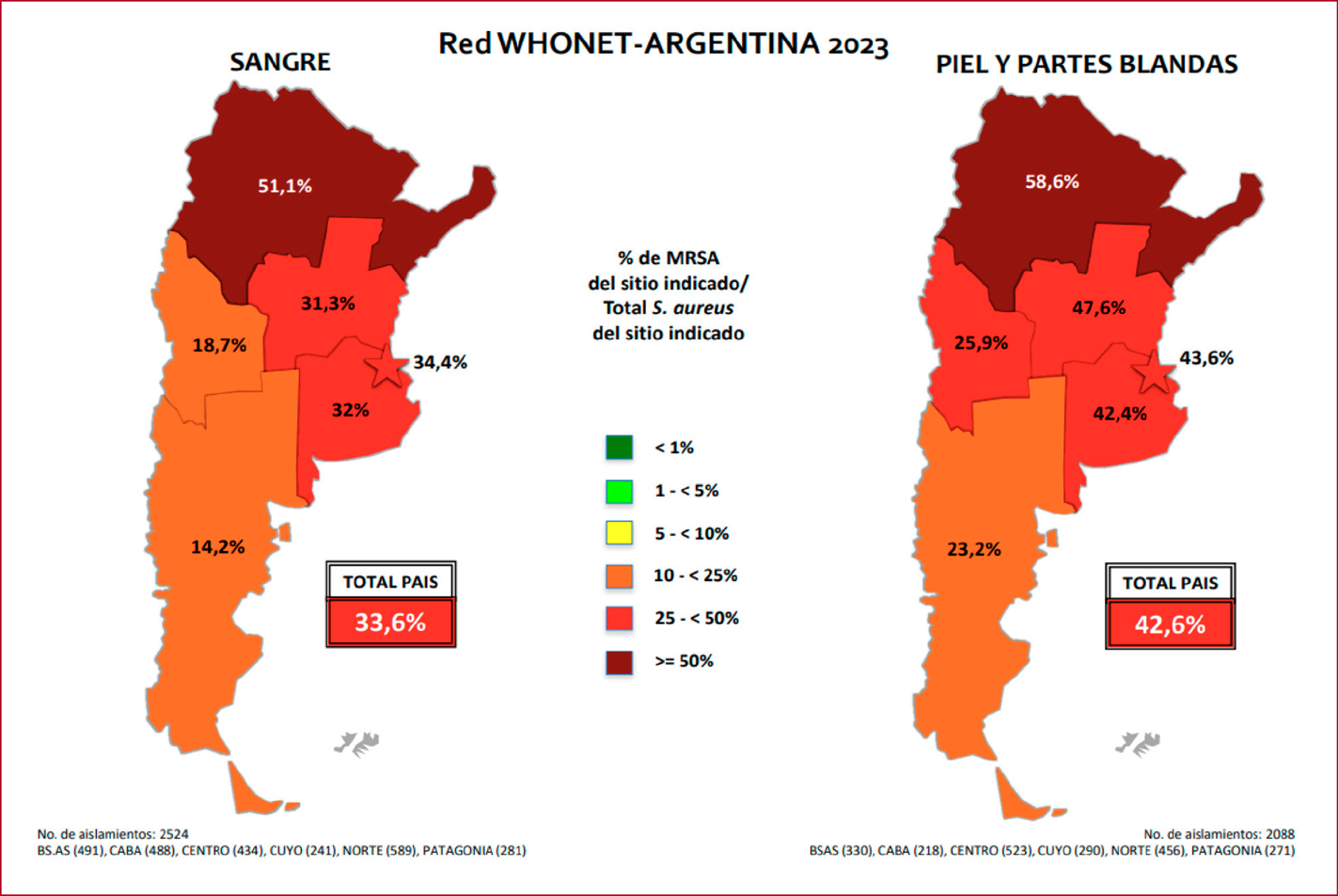
Figura 2. Staphylococcus aureus
meticilino resistente. Distribución en la Argentina, 202334
MRSA: Staphylococcus aureus meticilino
resistente.
Mapas de la Resistencia Antimicrobiana. En: hhttp://antimicrobianos.com.ar/wp-content/uploads/2024/12/Mapas-de-Resistencia-Antimicrobiana-Red-WHONET-Argentina-2023.pdf
En la Tabla 5 se
presentan los datos de sensibilidad de S. aureus, de origen tanto
comunitario como hospitalario, del mencionado estudio de la red26. Como puede verse, la meticilino resistencia fue
mayor en S. aureus de origen comunitario en comparación con los de
origen hospitalario (48% vs. 40.9%, p≤0.05), mientras que no se registraron
diferencias para el resto de los antibióticos. Por otra parte, las tasas de no
sensibilidad a eritromicina y clindamicina en los SAMS (38.9% y 28.6%
respectivamente) fueron mayores en comparación con los SAMR (15% para
eritromicina y 13.9% para clindamicina).
|
TABLA
5 Distribución y perfil de sensibilidad a los antimicrobianos de S. aureus causantes de infecciones de piel y partes blandas en Argentina-Red WHONET 202226 |
|||
|
|
S.
aureus IPPB-H N = 625 |
S. aureus IPPB-C N = 534 |
Valor de p |
|
% No Sensibilidad (I + R) |
|
|
|
|
Penicilina |
NT |
NT |
NS |
|
Oxa (MR) 40.9 48 p≤0.05 |
40.9 |
48 |
p≤0.05 |
|
Ampicilina |
NT |
NT |
--- |
|
Gentamicina |
20.2 |
18.6 |
NS |
|
Estreptomicina |
NT |
NT |
--- |
|
Eritromicina |
29.9 |
32 |
NS |
|
Clindamicina |
21.9 |
23 |
NS |
|
Ciprofloxacina |
4.7 |
3.3 |
NS |
|
Levofloxacina |
4 |
3.2 |
NS |
|
TMS |
2.3 |
2.7 |
NS |
|
Tetraciclina |
1.2 |
1.2 |
NS |
|
Minociclina |
0.7 |
0.2 |
NS |
|
Rifampicina |
1.7 |
0.9 |
NS |
|
Vancomicina |
0 |
0 |
NS |
|
Teicoplanina |
0 |
0 |
NS |
|
Linezolid |
0 |
0 |
NS |
|
% Resistencia |
|
|
|
|
Daptomicina |
0 |
0 |
NS |
|
Ceftarolina |
0 |
0 |
NS |
|
IPPB-H: infecciones de piel y partes blandas hospitalarias; IPPB-C: infecciones de piel y partes blandas de la comunidad; NT: no testeado; NS: no significativo. |
|||
• Streptococcus
pyogenes: Es la segunda
bacteria patógena más importante entre las que producen IPPB. Morfológicamente,
es un coco Gram positivo que se agrupa en cadenas, se encuentra tanto en las
mucosas como en la piel y puede causar gran variedad de manifestaciones, desde
erisipela hasta neumonías y meningitis bacteriana graves. Dentro de sus
mecanismos patogénicos se encuentran la estreptolisina S y O, hialuronidasa,
estreptoquinasa, exotoxinas pirogénicas, entre otras que favorecen la
virulencia de esta bacteria18, 35. Otros estreptococos, como los grupos B, C y G,
pueden también ser causantes de IPPB35.
S. pyogenes es universalmente
sensible a penicilina, la cual continúa siendo el tratamiento de elección
debido a su eficacia, seguridad, espectro estrecho y bajo costo23. De acuerdo con lo publicado por el programa WHONET
202420, S. pyogenes presenta una tasa de resistencia de 0% para
penicilina, 0.6% para levofloxacina, 2.7% para clindamicina y 3.8% para
eritromicina (Fig. 3). Las tasas de resistencia a clindamicina y eritromicina,
aunque todavía son bajas, exhiben una tendencia creciente en todo el mundo36, 37. Algunos autores sugieren la utilidad de TMP/ SMX
en IPPB causadas por S. pyogenes38, 39. Esto se basa en
estudios in vitro que demostraron tasas de susceptibilidad del S.
pyogenes a TMP/SMX del 100% cuando se utilizaron medios de cultivo con
bajos niveles de timidina, sustancia que inhibe la actividad de esta droga39-41. Sin embargo, no
hay estudios y datos suficientes en nuestra región de monoterapia con TMP/SMX
para IPPB por estreptococo para pacientes adultos para realizar aún tal
recomendación.
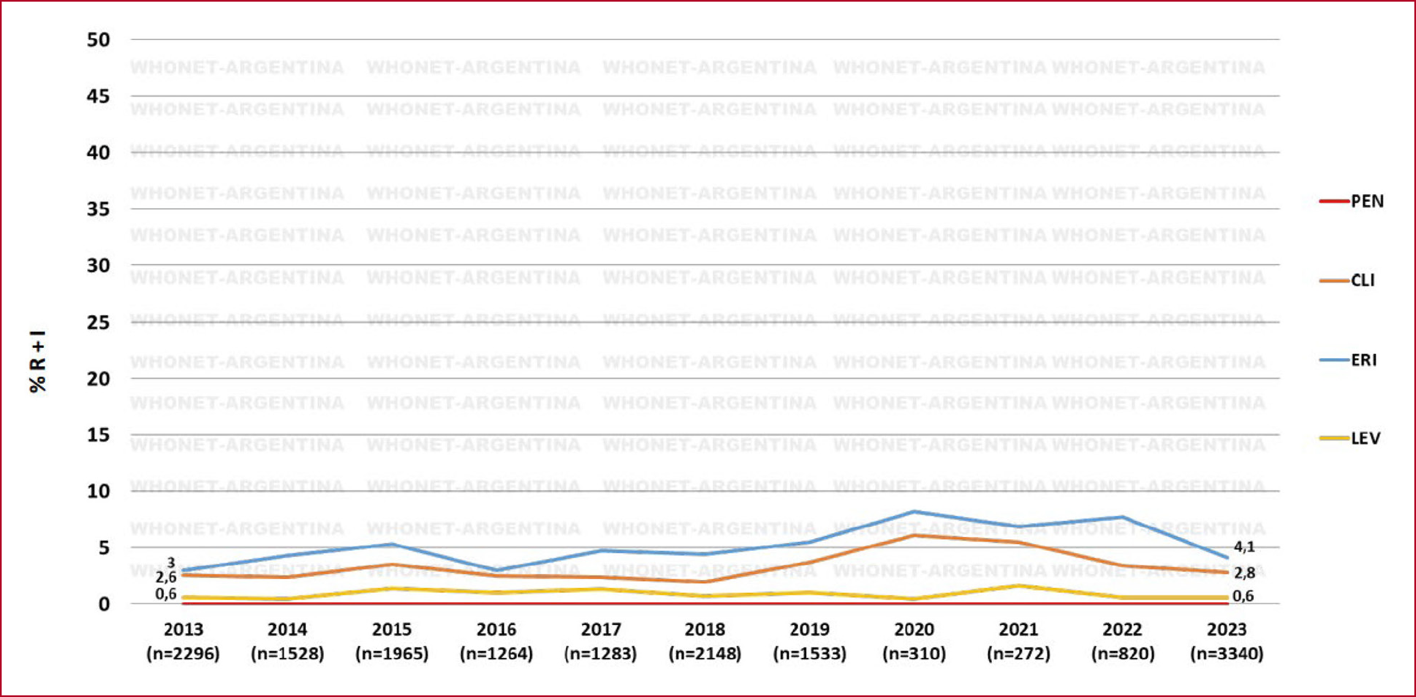
Figura 3 | Porcentaje de
resistencia de Streptococcus b hemolítico Grupo A. Datos de la
Red Whonet Argentina 202220 (n = 16 759)
Para más información,
consultar en: http://antimicrobianos.com.ar/wp-content/uploads/2024/05/Vigilancia-Nacional-de-la-Resistencia-a-los-Antimicrobianos-Red-WHONET-Argentina-Tendencia-2013-2023.pdf
• Bacilos Gram
negativos (BGN): Este grupo bacteriano ocupa un rol no menor en la génesis de
IPPB, mayormente en las de origen hospitalario, y principalmente en cuadros de
ISQ, y, en gran proporción, en las infecciones del pie diabético. Los agentes
que más comúnmente han sido aislados son E. coli, P. aeruginosa, Proteus
spp. y K. pneumoniae1, 9, 26.
Los factores de
riesgo asociados a IPPB por BGN son insuficiencia cardíaca, enfermedad renal
crónica, enfermedad vascular periférica e infección necrótica. Es fundamental
considerar las características clínicas de los pacientes y su mayor
predisposición a infecciones por BGN al asignar el tratamiento empírico inicial
para las IPPB, especialmente en casos de infecciones asociadas a los cuidados
de la salud42, 43.
En la Tabla 6 se
transcriben los datos de sensibilidad para BGN productores de IPPB, publicados
por el programa WHONET26. Según puede observarse, son pocos los antibióticos
con tasas de sensibilidad superior al 90% en IPPB: en infecciones causadas por E. coli, solo
piperacilina-tazobactam, gentamicina, amikacina, imipenem/meropenem y
tigeciclina entre las de origen comunitario, y amikacina, imipenem/meropenem,
colistín y fosfomicina, entre las de origen hospitalario. Para K. pneumoniae,
el panorama es aún más grave, ya que ningún antimicrobiano presentó tasas de
sensibilidad mayores al 90% (incluyendo cetazidima-avibactam). Finalmente, en
IPPB por P. aeruginosa, solo mostraron tasas de sensibilidad mayores al 90%
ceftolozano/tazobactam, ceftazidima/avibactam y colistín. El estudio mostró
también que, entre los aislamientos de K. pneumoniae no sensibles a
imipenem/meropenem, el 60% era productor de KPC, el 33% de MBL y el 6% tenía
combinaciones de carbapenemasas. Estas cifras reflejan la extensión del problema
de la resistencia a los antimicrobianos y la necesidad de estadísticas locales
para guiar los tratamientos.
|
TABLA
6 Distribución y perfil de sensibilidad a los antimicrobianos de bacilos Gram negativos causantes de infección de piel y partes blandas en Argentina-Red WHONET 202226 |
||||
|
|
E.
coli IPPB-C N = 108 |
E.
coli IPPB-H N = 324 |
K.
pneumoniae IPPB-H N = 217 |
Pae IPPB-H N = 202 |
|
% No Sensibilidad (I + R) |
|
|
|
|
|
Ampicilina |
62 |
74 |
RN |
RN |
|
AMS |
38.6 |
53.4 |
71.3 |
RN |
|
C3G |
23 |
24.1 |
66 |
20.7 |
|
PTZ |
9.9 |
15.1 |
66.7 |
29.3 |
|
Cefepime |
20 |
23.1 |
66.1 |
26.7 |
|
Imipenem |
1.2 |
2.4 |
38.7 |
33.3 |
|
Meropenem |
1.2 |
2.1 |
38.1 |
26.6 |
|
Ciprofloxacina |
34.4 |
49 |
66 |
28 |
|
TMP/SMX |
37.9 |
44.9 |
61.5 |
RN |
|
Gentamicina |
9 |
15.9 |
50.5 |
NT |
|
Amikacina |
0 |
3.8 |
36.5 |
13.3 |
|
Colistin |
NT |
0.8 |
10.7 |
1.4 |
|
Fosfomicina |
NT |
5.6 |
19 |
NT |
|
Ceftolozano-tazobactam |
NT |
NT |
NT |
2.4 |
|
Ceftazidima-avibactam |
NT |
NT |
13.6 |
5.1 |
|
Tigeciclina |
6 |
12.8 |
47.3 |
RN |
|
% BGN con RDT |
0 |
1.5 |
35 |
5 |
|
IPPB-H: infecciones de piel y partes blandas hospitalarias; IPPB-C: infecciones de piel y partes blandas de la comunidad; C3G: cefalosporinas de tercera generación; PTZ: piperacilina-tazobactam; BGN con RDT: bacilos Gram negativos con resistencias difíciles de tratar a carbapenemes, cefalosporinas, aztreonam; TMP/SMX: trimetoprima/sulfametoxazol; NT: no testeado; RN: resistencia natural. |
||||
• Anaerobios: Las
bacterias anaerobias son un componente fundamental de la microbiota de la
mucosa humana, especialmente de la boca, el tracto gastrointestinal inferior y
la vagina. Por lo tanto, en IPPB producidas en áreas del cuerpo sujetos a
contaminación fecal u oral están particularmente en riesgo de ser causadas por
microorganismos anaerobios1.
Su patogénesis
también incluye el desarrollo de factores de virulencia, la capacidad de
algunas especies para resistir microambientes oxigenados, el sinergismo con
otras bacterias y la resistencia a ciertos antibióticos. Este tipo de infección
tiende a ser polimicrobiana, lo que complica su aislamiento. El método
MALDI-TOF, una técnica para la identificación de microorganismos mediante el
uso de un espectrómetro de masas, ha facilitado la identificación rápida y
fiable de estos microorganismos y actualmente es el método de elección43. Las IPPB causadas por gérmenes anaerobios
están relacionadas con
traumatismos, cirugías o inmunosupresión, por lo que ciertos hallazgos clínicos
se correlacionaron con ellos: hinchazón y sensibilidad con Clostridium spp;
adenopatía regional con grupo B. fragilis; gangrena y necrosis con B.
fragilis o Clostridium spp.; mal olor con Bacteroides spp; y
gas en tejidos con B. fragilis y Clostridium spp. De igual modo,
determinadas condiciones predisponentes se correlacionaron con los siguientes
organismos: traumatismo con Clostridium spp.; diabetes con Bacteroides
spp1, 44.
Los microorganismos
del género Clostridium son ubicuos, se encuentran en el suelo, en el
aire y en el tracto digestivo. Son bacterias anaerobias, Gram positivas,
parásitas y saprófitas formadoras de esporas y productoras de gas. Clostridium
perfringens sintetiza múltiples enzimas extracelulares como colagenasa,
neuraminidasa y DNAsa, pero además produce dos toxinas de gran importancia, ya
que determinan las manifestaciones clínicas: fosfolipasa C (alfa toxina), que
produce hemólisis, destrucción plaquetaria, daño capilar y muerte por falla
multiorgánica, y una hemolisina responsable de hipotensión profunda y
bradicardia sostenida1.
• Síndromes mediados
por toxinas: Dentro de las IPPB se reconocen algunas entidades que, si bien son
causadas por bacterias, se destacan porque el mecanismo de daño es mediado por
toxinas. Dentro de este grupo se encuentran el síndrome de la piel escaldada
estafilocóccica y los síndromes de shock tóxico (SST) estafilocóccico y
estreptocóccico.
Se trata de
enfermedades agudas, multisistémicas, que a menudo desembocan en insuficiencia
multiorgánica, como resultado de la capacidad de las toxinas bacterianas de
actuar como superantígenos, estimulando la expansión de las células
inmunitarias y la expresión desenfrenada de citoquiinas, lo que da como
resultado un importante daño tisular, coagulación intravascular diseminada y
disfunción orgánica45, 46.
Síndrome del shock tóxico estafilocócico: El SST estafilocócico está causado por las cepas de S.
aureus productoras de toxinas (toxina 1 del SST, enterotoxinas B y C)10.
Síndrome del shock tóxico estreptocócico: El SST estreptocócico es una complicación de una
infección invasiva por S. pyogenes causada por una tormenta de
citoquinas inducida por toxinas estreptocócicas47, 48.
Síndrome de la piel escaldada estafilocócica: Enfermedad mediada por las toxinas exfoliativas
epidermolíticas A y B, tras su diseminación hematógena49.
Como conclusión,
contar con datos epidemiológicos actualizados en nuestra región es de suma
importancia ya que, en general, las IPPB no complicadas suelen tratarse
empíricamente guiándose por la epidemiología local. La vigilancia continua es
fundamental para entender la epidemiología local, evaluar los perfiles de
resistencia que orienten en la elección de los tratamientos empíricos e
implementar estrategias para la contención de los mecanismos de resistencia
emergentes.
Impétigo y ectima
Definición: El impétigo es una
infección bacteriana que afecta las capas superficiales de la piel,
generalmente en zonas expuestas (rostro, miembros). Ocurre a través de una
puerta de entrada (lesiones por rascado, picaduras, intertrigos, escabiosis),
mediante el contacto directo, y, mayormente cura sin dejar cicatriz8, 10. Puede ser producido principalmente por S.
pyogenes o por S. aureus.
El ectima es un
tipo de impétigo, de mayor invasividad, que llega a las capas más profundas de
la piel y puede dejar cicatrices9, 11.
Epidemiología: Son entidades
frecuentes del adulto joven o el niño, especialmente entre los 2 y 5 años de
edad50. Se presentan mayormente en los meses de verano8, 10. No hay predilección por sexo o raza11, 51, y afectan principalmente a individuos de niveles
socio-económicos bajos, en condiciones de hacinamiento e higiene insuficiente27.
Los factores
predisponentes son la sudoración por exceso de calor, la higiene local
deficiente, las afectaciones atópicas recurrentes u otras lesiones (quemaduras,
enfermedades eruptivas, traumatismos cutáneos, picaduras de insectos). También
influyen los factores inmunológicos del huésped y la colonización recurrente
con estafilococos en piel y mucosas11.
Microbiología: Los agentes
etiológicos más frecuentes son S. pyogenes, (mayormente el SBGA,
aunque también puede
ser ocasionada por Streptococcus dysgalactiae ss
equisimiliis (estreptococos de los grupos C y G) y S. aureus27, incluyendo SAMR-AC29, 52. Es probable que en los climas templados S.
aureus sea más frecuente, mientras que, en climas más cálidos y húmedos, la
causa más común sea estreptocóccica52-54.
Clínica: El impétigo puede
presentarse de dos maneras:
• Impétigo ampollar
(o bulloso): se manifiesta
como ampollas en piel que se rompen y dejan erosiones. El mecanismo de
infección es a través de toxinas exfoliativas. Afecta con mayor frecuencia a
neonatos, aunque puede ocurrir también en niños mayores y adultos. Se localiza
más comúnmente en tronco, y en los niños en axilas, cuello y la zona del pañal50. Suele resolver en la mayoría de los casos en
algunas semanas, sin dejar cicatriz. A veces puede haber síntomas sistémicos
como fiebre, compromiso del estado general y diarrea. De no mediar un
tratamiento adecuado el impétigo estafilocóccico puede propagarse por
autoinoculación50 y complicarse con una infección invasiva como
celulitis, linfangitis o bacteriemia10, 11, 27, 51.
En los niños existe
una forma particular de impétigo ampolloso: la dactilitis ampollosa, que es una
forma localizada, que suele afectar a niños de entre 2 y 16 años de edad,
aunque también se han notificado casos en menores de 9 meses50. La lesión característica de la dactilitis
ampollosa es una ampolla que no produce prurito, purulenta y llena de líquido,
generalmente de entre 10 y 30 mm de diámetro, que puede evolucionar a
erosiones. El sitio afectado con mayor frecuencia es la almohadilla grasa de la
porción distal de un dedo de la mano, o más raramente de un dedo del pie.
• Impétigo no
ampollar (o no bulloso): constituye más del
70 % de los casos, y puede ser producido tanto por S. pyogenes como por S. aureus50. Sus lesiones comienzan como vesículas o ampollas
de contenido seroso y que pueden evolucionar a contenido purulento, que se
rompen rápidamente y dejan erosiones que se cubren de costras melicéricas o
amarronadas. En ocasiones se acompañan de prurito o dolor y se diseminan con
rapidez por autoinoculación. Son más comunes en zonas cercanas a la boca,
acompañadas de adenomegalias regionales, y en las extremidades10, 11, 27, 51. Típicamente, las
lesiones resuelven en forma espontánea en algunas semanas55, dejando en ocasiones un área despigmentada27. En la mayoría de los casos no tiene repercusión
sistémica, aunque existen reportes de casos graves51.
• Ectima: es una complicación de una ampolla de impétigo, que
evoluciona en forma tórpida y se extiende en profundidad. Las erosiones
producidas por las ampollas evolucionan a úlceras profundas, las que se cubren
de costras gruesas que, al desprenderse, dejan cicatriz10, 56. Aparece con más frecuencia en niños o en pacientes
inmunocomprometidos56.
Diagnósticos diferenciales: Ante un paciente con impétigo no bulloso deben descartarse otras
dermatitis de diversas etiologías, entre ellas atópicas, tiña, herpes simple,
erupción variceliforme de Kaposi y herpes zóster11, 57. El impétigo bulloso debe diferenciarse de las
lesiones por quemaduras y de enfermedades ampollares autoinmunes como pénfigo
vulgar o el penfigoide ampollar11, 51. El ectima se debe diferenciar de la tiña profunda,
la tuberculosis cutánea y el pioderma gangrenoso11, 27. El diagnóstico diferencial de la dactilitis
ampollosa incluye lesiones herpéticas, epidermólisis ampollosa, ampollas por
fricción, picaduras de insectos y dermatitis irritativa50.
Diagnóstico: El diagnóstico de
impétigo es clínico27 (A-II), no se recomienda el
cultivo de las lesiones, excepto en casos refractarios al tratamiento, en
inmunosuprimidos o en brotes11, 27 (A-II). En esos casos, el
cultivo debe hacerse en lo posible con biopsia de piel para determinar el
germen productor de la lesión.
Otros estudios
complementarios, como hemograma (que puede evidenciar leucocitosis) o
eritrosedimentación, solo se solicitan en los casos con compromiso sistémico o
en huéspedes inmunocomprometidos11, 27.
La búsqueda de
anticuerpos antiestreptocóccicos (ASTO) solo provee información de contacto
reciente en pacientes en los que se sospecha glomerulonefritis
postestreptocócica, por lo que no está indicada en forma rutinaria27. La respuesta de ASTO es débil en pacientes con
impétigo estreptocócico9, 10, 57.
Tratamiento: No existe un
tratamiento estandarizado, por lo que la decisión de cómo tratarlo dependerá de
diferentes factores, como el número de lesiones presentes, la localización
(cara, párpado o boca) y la necesidad de limitar el contagio27, 54, 58.
El manejo es, en
general, ambulatorio8, 9, 27, 52, existiendo tres tipos principales de tratamiento:
antisépticos, antibióticos tópicos y antibióticos sistémicos54, 58.
En los niños, en
general se indica tratamiento tópico cuando la extensión es limitada (<2% de
la superficie corporal), por 5-7-dias o hasta completar la resolución, mientras
que el tratamiento sistémico se sugiere en casos de mayor extensión, edad menor
a un año, sospecha de etiología por SAMR, o mala respuesta al tratamiento o
recurrencia50 (A-II).
Medidas de higiene generales: baño con agua y jabón, descostrado de las lesiones con agua blanca de
Códex o agua D´Alibour diluidas a la mitad al tercio54 (A-II).
Impétigo no bulloso con área delimitada: tratamiento local, con ácido fusídico 2% en crema, 3
veces por día por 5 días (preferentemente) o con mupirocina 2% en crema por 5
días (A-III). Es preferible priorizar el empleo de ácido fusídico, a fin
de preservar la mupirocina para su uso en la descolonización pre-quirúrgica, en
virtud de la descripción de la emergencia de cepas de S. aureus resistentes59. Por otra parte, mupirocina no debe aplicarse en
áreas extensas ya que puede causar insuficiencia renal debido a su elevado
contenido de polietilenglicol, especialmente ante la presencia de insuficiencia
renal moderada o grave58.
Impétigo bulloso o con compromiso extenso o con pobre respuesta al
tratamiento, o impétigo no bulloso extendido: cefalexina o cefadroxilo, y re-evaluación en 72 horas (A-III).
En caso de no mejoría, evaluar amoxicilina-TMP/SMX. Cuando, por factores
sociales no se considere factible una reevaluación a las 72 h, iniciar
directamente con amoxiclina y TMP/SMX (A-III). Como alternativas o en
pacientes con alergia a penicilina: clindamicina o minociclina/doxiciclina (en
mayores de 8 años o mujeres no embarazadas) (A-III).
Duración del
tratamiento: 5-7 días (A-III).
Complicaciones: Puede presentarse
glomerulonefritis post-estreptocócica, que aparece a las semanas de la
infección cutánea. Otra complicación frecuente en niños es el síndrome de la
piel escaldada estafilocócica. Se ve en los primeros años de vida por carencia
de anticuerpos anti-exfoliatinas y por la imposibilidad por parte de los
riñones de eliminar la toxina por la orina9, 51.
Prevención: Deben extremarse
las medidas higiénicas para evitar la sobreinfección bacteriana de heridas
(especialmente en niños). Utilizar agua y jabón neutro, uso adecuado de
soluciones antisépticas de clorhexidina (su sobreutilización puede inducir a la
resistencia) y, en casos de mayor compromiso, se recomienda el empleo de crema
con antibióticos para descolonizar, particularmente en situaciones en que, por
la purulencia de las lesiones, se sospeche la presencia de SAMR-de la comunidad54, 60 (A-III).
Es preciso educar
al paciente para que evite escoriaciones por rascado y diseminación de la
infección por autoinoculación. También es necesario indicarle que no comparta
toallas o ropa, así como también enfatizar la importancia del lavado de manos.
Los niños no deben reintegrarse al colegio/club hasta dos días después de
iniciado el tratamiento10 (A-III). En huéspedes inmunocomprometidos es importante hacer el diagnóstico
antes de que las lesiones avancen en extensión y profundidad.
Forunculosis
Definiciones: El forúnculo es la
infección aguda del folículo piloso en su parte más profunda, con
perifoliculitis que desorganiza la dermis, que no sobrepasa la dermis, y que da
como resultado una cicatriz. El nódulo, inicialmente doloroso, firme y rojizo,
se convierte rápidamente en fluctuante, con tendencia a drenar su contenido al
exterior9, 13, 61. La forunculosis es la aparición repetida o
simultánea de varios forúnculos.
En ocasiones se
produce la confluencia de varios forúnculos hasta formar abscesos profundos que
alcanzan la grasa subcutánea con bocas múltiples por las que drena pus. Esto es
lo que se denomina ántrax (o carbuncle, en inglés). Se localizan con
mayor frecuencia en cuello, cara, espalda, axilas y glúteos. Es importante
tener en cuenta que no debe confundirse con el anthax o carbunco, que es
una zoonosis causada por el Bacillus anthracis, un BGN esporulado, que
afecta primariamente a animales herbívoros y accidentalmente al hombre, por
contacto cutáneo o por ingestión de esporas62.
Microbiología: S. aureus es el agente más frecuente: es el causante del 98% de los forúnculos,
siendo SAMR-AC en el 82% de los casos61.
Suele ser una
infección que se transmite por contacto directo y, en
menor medida, por fómites. Se han descrito brotes en grupos o comunidades que
mantienen contacto íntimo (niños en guarderías, deportistas de contacto, militares, personas en condición de
encierro, entre otros). También se ha observado un aumento del
riesgo en usuarios de drogas endovenosas e indigentes. El riesgo en un determinado individuo con una infección cutánea de estar
infectado por SARM-AC no dependerá tanto de la presencia de los factores
predisponentes mencionados, sino de la prevalencia de SARM-AC en esa comunidad63.
Manifestaciones clínicas: Se caracteriza por presentar un nódulo inflamatorio, rojo y doloroso,
centrado por el orificio de un folículo piloso y que se acompaña de intenso
edema local. Sin tratamiento adecuado, luego de unos días evolucionará a un
absceso con necrosis central, lo que constituye el llamado clavo, que es un
tejido amarillento negruzco, que se delimita de la pared folicular y se
desprende, dejando una cicatriz10.
Los factores
predisponentes pueden ser divididos en locales (regiones pilosas sometidas a
roce o transpiración, alteraciones de la barrera cutánea, sudoración excesiva y
falta de higiene) y generales (obesidad, diabetes mellitus, neutropenia,
tratamiento prolongado con glucocorticoides, inmunosupresión, insuficiencia
renal crónica, y contacto con personas con forúnculos)10.
La forunculosis
puede complicarse ocasionalmente de bacteriemia, sepsis y el desarrollo de
focos a distancia como osteomielitis y endocarditis64-66. La trombosis del seno cavernoso puede evolucionar
a partir de lesiones en cara, principalmente luego de su manipulación.
Diagnóstico diferencial: Debe diferenciarse de abscesos cutáneos, otras foliculitis, acné
conglobata y quiste epidérmico infectado.
Otro importante
diagnóstico diferencial es la hidradenitis supurativa, una enfermedad
inflamatoria crónica del folículo piloso, que se manifiesta con nódulos,
abscesos, cicatrices y comedones en áreas de pliegues como axilas, mamas,
ingles, nuca y glútea. El abordaje de estos individuos es diferente al de
aquellos con IPPB.
Particularmente en
niños, la forunculosis debe diferenciarse de diversos tipos de foliculitis,
como las ocasionadas por BGN, virus, hongos (Pytirosporum spp) o ácaros
(Demodex spp).
Diagnóstico: El diagnóstico de
la forunculosis es principalmente clínico, no está recomendado el estudio
microbiológico de la lesión, con excepción de los pacientes inmunocomprometidos9 (A-II).
Tratamiento: En el caso de
lesiones pequeñas resulta suficiente el tratamiento local8, 9, que consiste en la limpieza con agua y jabón
neutro, fomentos tibios con agua blanca del Códex o agua D´Alibour que
promueven el drenaje o antisépticos que no modifiquen el pH ácido de la piel
(iodopovidona o clorhexidina) (A-II).
Cuando las lesiones
son de mayor tamaño y se encuentran en etapa de fluctuación, pueden requerir
drenaje quirúrgico, con técnica aséptica, particularmente para los forúnculos
de gran tamaño67 (A-I).
El tratamiento
sistémico con antibióticos en el caso de los forúnculos es en general
innecesario, y solo está indicado cuando hay celulitis circundante, lesiones
múltiples, localización en rostro, inmunodeficiencias o compromiso sistémico8-10 (A-II). En esos casos, debe
utilizarse TMP-SMX durante 5-7 días, debido a la elevada prevalencia de SAMR-AC
en nuestro país34. Como alternativas pueden considerarse las tetraciclinas (doxiciclina
o minociclina) en los mayores de 8 años (A-II). Si bien las tasas de
resistencia a ciprofloxacina y rifampicina son bajas, no se recomienda su
empleo de rutina en el tratamiento de forúnculos.
En cuanto a la
descolonización de pacientes infectados con SAMR (p. ej., mupirocina nasal y
lavados corporales con clorhexidina), no existe evidencia concluyente que avale
dicha práctica, ya que la colonización está frecuentemente ausente en pacientes
infectados.
Forunculosis recurrente
La forunculosis
recurrente es la aparición secuencial de varios forúnculos en un período de
meses o incluso años en el mismo paciente. La mayoría de los casos (hasta un
75%) son atribuibles a S. aureus, ya sea SAMS o SAMR68. Puede deberse a un absceso recurrente en un sitio
de infección anterior, por factores locales como material extraño, hidradenitis
supurativa o quiste pilonidal8, cuya erradicación puede ser curativa. La portación
nasal de S. aureus y la continua exposición a la fuente de infección
(p.ej., contacto cercano entre convivientes) han sido identificados como
factores de riesgo para la forunculosis recurrente.
Los beneficios del
tratamiento antimicrobiano complementario en cuanto a la prevención de las
recurrencias son desconocidos. Ensayos aleatorios demostraron que mupirocina
intranasal durante 5 días cada mes69 redujo la tasa de nuevas infecciones. Más
recientemente, un estudio
encontró que una descolonización de 5 días con mupirocina
intranasal dos veces al día y el baño diario con clorhexidina no fueron medidas
eficaces para reducir la recurrencia70.
Los abscesos
recurrentes deben drenarse y cultivarse tempranamente66 (A-II). La instauración de tratamiento antibiótico deberá
hacerse en base a los resultados de ese cultivo, con una duración de 5 a 10
días9 (A-II).
Debe considerarse
la descolonización con mupirocina intranasal, durante 5 días, y lavados diarios
con clorhexidina, con descontaminación diaria de artículos personales como
toallas, sábanas y ropa (A-II). Esta medida debe incluir a todo el grupo
familiar y, de ser necesario, a las mascotas. También deben limpiarse las
superficies de alto contacto con lavandina al 1% y realizarse una cuidadosa
higiene de manos8-10 (A-II). Es de suma importancia poner énfasis en la educación del paciente,
mediante instrucciones sencillas especialmente desarrolladas para la
prevención, como han desarrollado algunas instituciones (https://www.hospitaldeclinicas.uba.ar/?page_id=7875).
Abscesos cutáneos
Definición: Se trata de una
colección purulenta rodeada de una pared formada por leucocitos, bacterias y
tejido necrótico que se localiza en la dermis o en el tejido celular
subcutáneo. Se forma por extensión local de una infección cutánea, tras un
traumatismo o por diseminación hematógena8, 9.
Microbiología: Los agentes
etiológicos más frecuentes son S. aureus (incluido SAMR-AC), seguido de S.
pyogenes9, 71. En caso de que la lesión se localice cerca de
mucosas (regiones peribucal o perianal), se deberá tener en cuenta la
microbiota de dichas localizaciones.
Clínica: Clínicamente, se
manifiestan como un nódulo eritematoso y doloroso, inicialmente firme, que
progresa a fluctuante. No suele haber síntomas sistémicos, a no ser que haya
una extensión a tejidos más profundos o una bacteriemia.
En pediatría, los
pacientes con un único absceso de un diámetro de hasta 5 cm (3 cm en pacientes
de 6 a 11 meses de edad y 4 cm en pacientes de 1 a 8 años) se consideran dentro
del grupo de abscesos simples. Todos los demás (absceso >5 cm de diámetro,
dos sitios de infección de la piel o abscesos recurrentes), se consideran
dentro del grupo de abscesos complicados.
La mastitis
neonatal es una infección poco frecuente de la glándula mamaria, que puede
presentarse en los primeros 2 meses de vida y está relacionada con la
hipertrofia mamaria fisiológica presente en los recién nacidos a término.
Aunque es común, se desconoce su prevalencia. La patogenia implica la
propagación de patógenos bacterianos al parénquima mamario a través del pezón.
La mastitis se distingue de la hipertrofia fisiológica por hallazgos clínicos
característicos, como eritema, induración y dolor. Otros hallazgos clínicos
pueden incluir secreción purulenta del pezón, lesiones cutáneas y adenopatía
axilar. La mayoría de los casos se deben a S. aureus y, con menos
frecuencia a BGN, anaerobios y estreptococos del grupo B. La mitad de los niños
presenta síntomas generales como rechazo del alimento e irritabilidad y el 24%
se presenta con fiebre. Al evaluar a los recién nacidos con mastitis, se debe
considerar si tienen una infección bacteriana grave concomitante (sepsis o
infección necrosante).
Diagnóstico: El diagnóstico se
realiza mediante el examen clínico8-10 (A-II). De estar indicado el tratamiento antibiótico, el mismo puede iniciarse
sin necesidad de cultivo en la mayor parte de los casos9 (A-II). La solicitud de hemocultivos está indicada en pacientes que presentan
fiebre y síntomas sistémicos o que están inmunocomprometidos, aunque muestran
un bajo rendimiento en las IPPB no complicadas. La ecografía es un
procedimiento sensible y sencillo que permite distinguir los abscesos de la
celulitis, evaluar el tamaño del absceso y elegir a los pacientes que deberán
drenarse.
Diagnósticos diferenciales: El principal diagnóstico diferencial es la celulitis abscedada, debido
a que los abordajes terapéuticos son diferentes, por lo que en ocasiones puede
ser necesario hacer el diagnóstico diferencial a través de ecografía8-10. Otros
diagnósticos diferenciales son foliculitis, quiste sebáceo o quiste epidérmico
infectados, forunculosis, erisipela, hidradenitis supurada, neoplasias cutáneas
infectadas (carcinoma de células escamosas, carcinoma basocelular),
escrofuloderma por tuberculosis e infecciones por micobacterias de rápido
crecimiento. Recientemente se ha reportado un incremento de casos de abscesos
cutáneos por Mycobacterium abscessus secundarios a procedimientos
estéticos invasivos72, 73.
Tratamiento: La base del
tratamiento es el drenaje, que suele ser suficiente para la curación en
paciente inmunocompetentes8, 9. Un estudio aleatorizado ensayo demostró que el
manejo de abscesos cutáneos con incisión y drenaje fue significativamente
superior en términos de curación que la aspiración con aguja guiada por
ecografía, por lo que esta última forma de tratamiento no se recomienda74. Los abscesos que no se resuelven con drenaje
espontáneo deben ser evaluados para cirugía.
El uso de antibióticos
sistémicos en casos no complicados es innecesario71 (A-I), aunque puede valorarse en caso de drenaje
incompleto, inmunodeprimidos, lactantes, edad avanzada, afectación del estado
general o lesiones múltiples, o en pacientes con signos de compromiso sistémico9 (A-I). El tratamiento antibiótico aumenta la tasa de
curación de 87% a 95%, especialmente en pacientes con abscesos de gran tamaño y
celulitis. En las regiones donde la tasa de prevalencia de SAMR-AC supera el
10-15%, como es el caso de la mayor parte de nuestro país34, las cefalosporinas de primera generación no se
recomiendan como tratamiento empírico inicial. En pacientes con infecciones no
complicadas se sugiere el uso de TMP-SMX, durante 5 a 7 días. Como alternativas
se recomienda la indicación de tetraciclinas (doxiciclina o minociclina) en
mayores de 8 años, o clindamicina28, 67 (A-II).
En el caso de la
mastitis neonatal, el tratamiento empírico sugerido es vancomicina o
ceftarolina si el SAMR es prevalente, más cobertura para BGN con cefotaxime,
cefepime o ceftazidima. En una serie de casos, el tratamiento antibiótico se
extendió 4 días y luego se continuó por vía oral. Si no hay respuesta con el
tratamiento médico se deberá hacer drenaje quirúrgico. La duración del
tratamiento antibiótico se individualiza hasta que los síntomas clínicos se hayan
resuelto por completo75, 76.
Abscesos recurrentes
Definición: Hasta el 70% de los
pacientes que presentan abscesos cutáneos, tendrán infecciones recurrentes
durante al menos un año, incluso después de un tratamiento inicial exitoso77, 78. Las personas que presentan abscesos cutáneos
recurrentes deben ser investigados debido a que, en ocasiones, puede ser una
manifestación de una deficiencia inmune, ya sea primaria o secundaria79.
Microbiología: S. aureus suele ser el agente causante, aunque también pueden ser
polimicrobianos o contener flora de la piel o mucosa aledaña. La colonización
nasofaríngea por S. aureus es el principal factor predisponente para la
aparición de abscesos recurrentes. Hay que recordar que más del 80% de las
personas pueden estar colonizados por S. aureus en forma intermitente en
algún momento de su vida, y un 10-15% lo está en forma permanente77, 80, 81.
Factores de riesgo: Los pacientes que
presentan abscesos recurrentes pueden tener una deficiencia inmune específica,
o bien factores predisponentes, como enfermedades crónicas de la piel, diabetes
mellitus o enfermedad inflamatoria intestinal79. Se deben considerar también las causas
iatrogénicas, como leucopenia inducida por fármacos, u otros factores
adicionales, como insuficiencia venosa o pioderma gangrenoso.
En niños que tienen
precozmente abscesos recurrentes debe considerarse la presencia de
trastornos inmunológicos congénitos,
como enfermedad granulomatosa crónica, déficit de adhesión leucocitaria,
enfermedad Mendeliana y susceptibilidad a infección por micobacterias,
neutropenias congénitas graves, síndrome de Hiper IgE, síndrome de
Wiskott-Aldrich, neutropenia cíclica, déficit de granulocitos y déficit de
mieloperoxidasa50, 82, y antecedentes de dermatitis atópica, lesiones
cutáneas, picaduras de insectos y arañazos de animales, colonización por SAMR
y/o colonización por S. aureus y absceso cutáneo en un contacto
doméstico50. También se deben tener en cuenta factores sociodemográficos
(personal militar, personas que practican deportes de contacto, veterinarios,
hombres que tienen sexo con hombres, familias numerosas, asistentes a centros
de albergue o guarderías, residentes en geriátricos, individuos en condición de
encierro, personas en contacto con mascotas, entre otros) y comorbilidades
(obesidad, HIV, enfermedad gastrointestinal, diabetes, eczema, psoriasis,
atopía, artritis reumatoide, sinusitis crónica, asma, infecciones cutáneas
previas, hospitalización prolongada, uso de drogas endovenosas). Cuando el
absceso recurrente se localiza en sitios donde hubo infecciones anteriores
puede deberse a la presencia de factores locales, como material extraño,
hidradenitis supurativa o quiste pilonidal9.
La hidradenitis
supurativa (HS) es un trastorno común del epitelio folicular que contiene las
glándulas apocrinas, y que afecta predominantemente a la axila, el perineo y la
ingle82. Es más común en mujeres, aunque la afectación axilar muestra menos
predilección por género. Es probable que exista una predisposición genética,
dado que hasta un 26% de los pacientes tiene antecedentes familiares83. Los factores de riesgo para HS incluyen diabetes y
tabaquismo. La obesidad, aunque no es causa predisponente, puede agravar la HS,
al igual que el uso de ropa ajustada, la mala higiene y los productos químicos
utilizados en la depilación79.
El quiste pilonidal
es una lesión cutánea que se produce en el pliegue interglúteo. Los síntomas
son locales, y pueden incluir dolor, hinchazón, eritema y drenaje de pus. Los
factores de riesgo incluyen obesidad, antecedentes familiares, estar sentado por
periodos de tiempo prolongados, mayor cantidad de vello e insuficiente
ejercicio. En cuanto al mecanismo subyacente, se cree que se trata de un
proceso mecánico84.
Diagnóstico: El diagnóstico se
basa en la clínica, y se realiza mediante el examen clínico y el cultivo de las
muestras del material purulento drenado. Sin embargo, el tratamiento
antibiótico puede iniciarse sin necesidad de cultivo en la mayor parte de los
casos. Un absceso recurrente en un sitio de infección previa debe impulsar la
búsqueda de causas locales como quiste pilonidal, hidradenitis supurativa o
material extraño9 (A-I).
Los abscesos
recurrentes deben drenarse y cultivarse tempranamente (A-III). Los
pacientes que presentan abscesos recurrentes deben ser evaluados para detectar
trastornos predisponentes9, 79 (A-II).
Tratamiento: El tratamiento
básico de los abscesos cutáneos es la incisión y drenaje quirúrgico de su
contenido de forma abierta, aunque en casos de abscesos pequeños se podría
esperar el drenaje espontáneo (A-I). Estudios aleatorizados han
comparado el drenaje con aguja fina guiada por ultrasonografía con solo el 25%
de éxito y una alta tasa de recurrencia, por lo que actualmente se desaconseja85.
En cuanto a la
administración de antibióticos, no hay evidencia de que la terapia antibiótica
sea beneficiosa para la prevención de las recurrencias. Si bien las guías
clínicas más recientes no apoyan el uso de rutina de antibióticos sistémicos
luego de la incisión y drenaje de abscesos cutáneos simples, un curso asociado
de TMP-SMX de 5 a 7 días, sería más eficaz en la prevención del fracaso del
tratamiento y las recurrencias en niños y adultos con factores de riesgo, como
obesidad, diabetes mellitus, inmunocompromiso o hacinamiento (B-II).
Las medidas
generales incluyen baños con jabones antisépticos con agua templada. Se han
descrito otras medidas como la aplicación de láser, radioterapia y CO2, pero no hay evidencia de su beneficio.
En los procesos
recurrentes es importante establecer si el paciente es portador nasofaríngeo de
estafilococo y tratarlo para descolonizar y disminuir la frecuencia de las
infecciones purulentas. Aunque la evidencia no es contundente70, 86, se recomienda la descolonización de 5 días con
mupirocina intranasal y bañarse diariamente con clorhexidina70 (A-II).
Infecciones no purulentas: erisipela y
celulitis
Los términos
celulitis y erisipela se utilizan para referirse a infecciones cutáneas
difusas, superficiales y extendidas. Ambas constituyen las entidades más
frecuentes entre las IPPB no purulentas. Sin embargo, su diferenciación en la
práctica clínica es, muchas veces, dificultosa9, 87, 88. Por lo tanto, y dado que el manejo de ambas tiene,
en términos generales, aspectos muy similares, en estas recomendaciones serán
abordadas en conjunto.
Definición: La erisipela es una
infección aguda, que compromete la dermis superficial, con marcado compromiso
de los vasos linfáticos subyacentes, y, en ocasiones, rápidamente progresiva.
Clínicamente se manifiesta como una placa edematosa, caliente, de bordes netos
no sobreelevados y eritematosa (en ocasiones eritemato-purpúrica, ampollar o
necrótica). Puede acompañarse de adenopatía regional y a veces de linfangitis,
e incluso presentar sintomatología general, como fiebre y decaimiento10. Se localiza habitualmente en los miembros
inferiores, aunque también puede ubicarse en la cara, a partir de intertrigos
retroauriculares9, 10.
La celulitis se
desarrolla como consecuencia del ingreso de bacterias a través de la ruptura de
la barrera dérmica, con compromiso del tejido celular subcutáneo4, 8-10, 87, 89. Frecuentemente se asocia con antecedentes de
traumatismos o con la presencia de úlceras, heridas
quirúrgicas, lesiones por rascado o dermatosis8. La ausencia de límites netos,
debido a que se extiende más
profundamente y comprometiendo al tejido celular subcutáneo, es lo que la
diferencia de la erisipela, asociado o no con un foco purulento4, 8-10, 87, 89.
Microbiología: En el caso de la
erisipela, S. pyogenes es el patógeno predominante, y, menos frecuentemente, los estreptococos grupos G, C y B,
especialmente en neonatos. Se ha observado la colonización por estreptococo
betahemolítico de los grupos A y G en lesiones de piel de los pies y región perianal en pacientes con
erisipela, aunque el rol de los reservorios en los
episodios de la enfermedad no ha sido establecido44, 90. La etiología
estafilocócica es poco común, y ocurre generalmente en pacientes con trastornos
de la circulación linfática o traumas penetrantes, como sitios utilizados para
inyección de drogas. La colonización de la piel o el tracto respiratorio, o la
transmisión de persona a persona, son la fuente de los microorganismos
involucrados.
En la celulitis,
las etiologías más comunes en pacientes inmunocompetentes es también S.
pyogenes4, 8, 9. Otros tipos de
estreptococos (grupos B, C y G) pueden ser también la etiología. En aquellos
casos asociados con una puerta de entrada, la incidencia de S. aureus suele
ser más elevada, por lo que se debe considerar el riesgo de SAMR-AC al evaluar
el tratamiento antibiótico empírico7, 10, 18, 29, 30, 33, 89. Otros grupos de pacientes con factores de riesgo
para SAMR son: atletas participantes de deportes de contacto, consumidores de
drogas inyectables, hombres que tienen sexo con hombre, personal militar,
personas en condición de encierro, residencias o refugios, pacientes con
neumonía grave, historia de colonización o infección reciente con SAMR-AC,
historia de consumo reciente de antibióticos, o habitante en región geográfica
con elevada tasa de prevalencia87.
Otros
microorganismos pueden ser agentes causales de celulitis en determinadas
situaciones. En personas con adicción endovenosa se debe tener en cuenta la
posibilidad de P. aeruginosa y Aeromonas spp (principalmente A.
grupo hydrophila, A. grupo caviae y A. grupo veronii).
Estas últimas están implicadas en infecciones usualmente precedidas por alguna
injuria traumática que ocurre en contacto en el agua10, 18, 89. Finalmente, en individuos que sufren mordeduras de
gatos y en menor grado, de perros, hay que considerar la posibilidad de Pasteurella
multocida2, 89.
Factores predisponentes: La erisipela puede producirse a cualquier edad, pero es más frecuente
en mayores de 60 años. Es una infección esporádica sin carácter epidémico. Se
produce cuando ante determinadas situaciones, como traumatismos, intertrigos u
onicomicosis, se genera la disrupción de la barrera mecánica que ofrece la
piel, lo cual constituye la puerta de entrada para el ingreso del
microorganismo y su extensión local posterior. En muchas ocasiones estas
disrupciones son imperceptibles, impidiendo su reconocimiento y posterior
tratamiento44. Existen otros factores predisponentes en el huésped, como la
obesidad o el edema secundario a insuficiencia venosa crónica u obstrucción
linfática. La diabetes y el etilismo no están claramente definidos como
factores de riesgo para erisipela90, 91.
En cuanto a la
celulitis, el principal factor de riesgo asociado es el edema, especialmente el
linfedema, debido a que facilita el crecimiento bacteriano. De acuerdo con
algunas revisiones internacionales, hasta en el 77% de los pacientes se reporta
la existencia de una puerta de entrada, siendo la más frecuente una infección
micótica superficial, generalmente tiña pedis, con o sin onicomicosis
concomitante4, 90. Entre los factores de riesgo para infecciones
graves se incluyen la edad, diabetes, obesidad, insuficiencia renal,
insuficiencia hepática, insuficiencia vascular, inmunocompromiso y uso previo
de antibióticos. No existen diferencias significativas en cuanto al género8. La historia de colonización nasal por S. aureus
también es un factor predisponente para considerar7, 10, 92, 93.
Manifestaciones clínicas: La erisipela se localiza con mayor frecuencia en los miembros
inferiores y es generalmente unilateral, aunque en algunas oportunidades el
compromiso puede ser bilateral. La presentación en la cara se describe como “en
alas de mariposa”, y la de los miembros superiores se observa particularmente
en mujeres sometidas a vaciamiento axilar por cáncer de mama. En niños, la
localización en miembros inferiores se observa en el 80% de los casos, mientras
que en la cara en el 5-20%87, 92.
La lesión típica es
eritematosa, con rápida extensión, indurada (“piel de naranja”), de bordes
nítidos, dolorosa, con linfedema regional. Se acompaña de adenomegalias
satélites en el 46% de los casos y linfangitis en el 26%9, 94.
La presencia de
síntomas sistémicos tales como hipertermia, taquicardia, y, en casos graves,
confusión e hipotensión, acompañan a la lesión cutánea, e incluso pueden
precederla95. En ocasiones se pueden observar presentaciones con mayor compromiso
cutáneo como la aparición de ampollas, púrpura y a veces necrosis. Cuando se
produce compromiso sistémico el cuadro de erisipela se considera moderado o
grave. Algunos factores, como la edad y las condiciones clínicas subyacentes,
pueden ser determinantes de cuadros de mayor gravedad.
En los estudios de
laboratorio, son hallazgos frecuentes la leucocitosis, la eritrosedimentación
acelerada y la proteína C reactiva elevada. Sin embargo, en la mayoría de los
casos los estudios complementarios no son necesarios para el diagnóstico95, 96.
La celulitis suele
presentarse como un área de eritema diseminada y mal delimitada, de evolución
aguda. El compromiso casi siempre es unilateral y las extremidades inferiores
son el sitio más comúnmente afectado. La afectación bilateral debe hacer pensar
en otros diagnósticos diferenciales. Adicionalmente, pueden encontrarse vasos
linfáticos cutáneos dilatados y edematosos (linfangitis) y linfadenopatías
regionales dolorosas4, 18.
La celulitis puede
manifestarse en forma purulenta o no purulenta, según la presencia de exudado,
absceso o drenaje purulento88, 89. En su forma habitual no purulenta, suele
presentarse como un cuadro de inicio brusco, con una lesión eritematosa sin
límites netos, con edema, dolor y aumento de la temperatura local. Puede cursar
o no con flictenas o petequias y adenopatías regionales88, 89. La principal forma de presentación clínica de las
infecciones por SAMR-Co generalmente es la celulitis abscedada. También pueden
presentarse como parte de un cuadro tóxico o de sepsis y acompañarse de otros
focos supurativos, como osteoartritis y miositis8, 88, 89.
Para una correcta
evaluación del tratamiento, tanto la erisipela como la celulitis se pueden
dividir, desde el punto de vista clínico, en leve, moderada y grave8, 9, 87-89. Tal como se describió en el capítulo 2, deben
tenerse en cuenta para el manejo de las IPPB los criterios generales a utilizar
para la definición del sitio de manejo (ambulatorio, ingreso en piso general,
manejo en unidad de cuidados críticos), de acuerdo con la gravedad de los
signos y síntomas locales y sistémicos de la infección, y la presencia y
estabilidad de las comorbilidades (Tabla 3).
Formas clínicas especiales: Celulitis orbitaria(o celulitis post-septal): Las infecciones
orbitarias bacterianas tienen un inicio agudo y son de naturaleza rápidamente
progresiva97, 98. Si bien puede afectar a todos los grupos de edad,
los niños son los más afectados. La edad media de los niños hospitalizados por
celulitis orbitaria es de 7 a 12 años97. Generalmente es
secundaria a una infección sinusal causada por la flora del tracto respiratorio
(S. pneumoniae, H. influenzae, Moraxella catarrhalis, S. pyogenes) o S.
aureus, aunque también pueden estar involucrados otros estreptococos o
bacterias anaerobias99. En los
últimos años, la incidencia de H.
influenzae y S. pneumoniae ha disminuido drásticamente por la
vacunación100, por lo que la etiología estafilocócica se está volviendo más
frecuente. Se caracteriza por la presencia de proptosis, oftalmoplejía y
deterioro de la agudeza visual o afectación de la visión de los colores, debido
al edema que afecta los tejidos de la órbita98. El drenaje quirúrgico está indicado si en la
tomografía axial computada (TAC) o la resonancia magnética nuclear (RMN) se
diagnostica un absceso orbitario o subperióstico significativo, o si el
paciente presenta empeoramiento de los signos oculares o falta de mejoría
clínica después de 48 horas de tratamiento con antibióticos parenterales97, 98, 100.
Celulitis
preseptal: La celulitis preseptal suele comenzar superficial al tabique
orbitario, que es la lámina membranosa que se extiende desde el borde orbitario
hacia los párpados superior e inferior98. Es más frecuente que la celulitis orbitaria, y, al
igual que ella, es más común en niños. Se caracteriza por la presencia de edema
e hiperemia limitada al párpado sin restricciones en los movimientos oculares
ni alteraciones de la visión50. Debe diferenciarse del edema periorbitario con
sinusitis, que puede verse idéntico clínicamente, pero no es doloroso. La
etiología más frecuente a S. aureus y S. pyogenes, particularmente
cuando se asocia con una puerta de entrada cutánea evidente50, 99.
Celulitis
periorbitaria sin sitio de entrada asociado (en lactantes febriles no
inmunizados): Los agentes etiológicos más frecuentes son S.
pneumoniae y H. influenzae. Debe hacer diagnóstico diferencial con
angioedema, picadura de insectos, trombosis de seno cavernoso, chalazión,
orzuelo, mucormicosis, sindrome nefrótico, celulitis orbitaria, tumor hinchado
de Pott y fascitis necrosante periorbitaria97, 98.
Paroniquia aguda:
Es la infección del pliegue de tejido blando que rodea la uña de la mano o del
pie que resulta de un traumatismo menor que facilita la entrada de bacterias en
la cutícula o la uña. La paroniquia aguda es causada con mayor frecuencia por S.
aureus, mientras que la paroniquia crónica es causada con mayor frecuencia
por Candida spp. Los factores de riesgo de paroniquia incluyen
dermatitis, morderse las uñas y chuparse el pulgar o el dedo de manera crónica.
La paroniquia se presenta con eritema, edema y dolor a la palpación del pliegue
ungueal proximal y lateral o puede extenderse por debajo de la uña y supurar101, 102.
Onfalitis: Es una
infección poco común pero potencialmente grave en los neonatos. Clínicamente se
presenta con eritema e induración alrededor del muñón umbilical, drenaje
purulento, fiebre y signos de enfermedad sistémica103. Con menor frecuencia los pacientes tienen
solamente signos de infección localizada de tejidos blandos. Se deben
considerar anomalías subyacentes del uraco en el lactante con drenaje
umbilical, que se diagnostican con ecografía. Los factores de riesgo descriptos
para el desarrollo de onfalitis son ruptura prematura o prolongada de
membranas, infección materna, bajo peso al nacer, antecedentes de
cateterización umbilical y parto domiciliario104. Los avances en el cuidado y la higiene del cordón
umbilical han llevado a disminuciones en la prevalencia, mortalidad y tasa de
complicaciones de la onfalitis105, 106. Los agentes etiológicos más comunes son S.
aureus y S. pyogenes, seguidos con menor frecuencia de BGN y
anaerobios. La sepsis es la complicación más común de la onfalitis, aunque
también puede presentarse fascitis necrosante, peritonitis, necrosis
intestinal, evisceración del intestino delgado, absceso hepático y trombosis de
la vena porta104.
Diagnósticos diferenciales: Si bien tienen características clínicas particulares, a menudo la
erisipela y la celulitis pueden ser muy difíciles de diferenciar. En general,
la erisipela se caracteriza por el desarrollo de síntomas sistémicos de inicio
agudo (fiebre, escalofríos, malestar general grave y dolor de cabeza),
precediendo incluso a los signos y síntomas inflamatorios locales, y, a nivel
local, con una clara demarcación entre el tejido afectado y el sano, ya sea
como un borde no sobreelevado que avanza o un eritema con aclaramiento central.
El compromiso de la oreja es un claro signo de erisipela, ya que la celulitis
no la afecta, debido a la ausencia de tejido dérmico profundo y de grasa
subcutánea en la zona4, 18.
Por el contrario,
la celulitis se caracteriza por tener un eritema menos delimitado, un
infiltrado inflamatorio más profundo y no presentar signos de propagación
linfática9, 10, 87, 88. La celulitis es un desafío diagnóstico porque no
existe ninguna prueba o modalidad de imagen que pueda confirmarla o
descartarla. Se estima que aproximadamente un tercio de los pacientes
diagnosticados con celulitis finalmente tienen un diagnóstico no infeccioso88.
El término
pseudocelulitis se utiliza para englobar a enfermedades cutáneas inflamatorias
y no inflamatorias que imitan el aspecto clínico de la celulitis107. Ante la presencia
de un paciente con lesiones eritematosas de los miembros inferiores (síndrome
de la pierna roja), es importante buscar factores que puedan sugerir una causa
alternativa no infecciosa. Como regla general, el inicio crónico, la naturaleza
recurrente, la presencia de escamas, el curso lentamente progresivo, la
presentación bilateral y el tratamiento infructuoso con antibióticos son
altamente sugestivos de pseudocelulitis107. El diagnóstico erróneo de enfermedades
inflamatorias de la piel como celulitis, coloca a los pacientes en riesgo de
eventos adversos secundarios a infecciones adquiridas en el hospital y
resultados subóptimos, además de un gasto innecesario del sistema de atención
médica. Por lo tanto, es clave utilizar un algoritmo de diagnóstico
estandarizado que tenga en cuenta los signos vitales del paciente, los
hallazgos de las pruebas de laboratorio, los hallazgos cutáneos y la
distribución de la afectación cutánea108. La consideración temprana de diagnósticos
alternativos es importante para un manejo oportuno y preciso, especialmente en
los casos en los que se notan signos o síntomas atípicos, o no hay una
respuesta adecuada al tratamiento instituido.
Diagnósticos diferenciales de causa infecciosa: Ante la presencia de signos de alerta (compromiso
sistémico y/o alteración del sensorio, dolor intenso desproporcionado,
hipoestesia localizada, cuadro que progresa bajo tratamiento antibiótico,
decoloración azul purpúrica, bullas hemorrágicas, crepitación, necrosis
cutánea) se debe sospechar de infección necrosante de tejidos blandos o
miositis, indicar internación y estudios con imágenes, e iniciar tratamiento
antibiótico endovenoso8. En ocasiones puede resultar difícil diferenciar
semiológicamente la celulitis necrosante de la fascitis necrosante, por no
poder determinar siempre el plano de clivaje. En la celulitis necrosante la
piel se presenta dolorosa, roja oscura con lesiones hemorrágicas, mientras que
en la fascitis necrosante se produce una disección de la piel, con coloración
pálida y afectación de los planos profundos del tejido subcutáneo (planos
fasciales)89.
Diagnósticos diferenciales de causa no infecciosa: Los principales diagnósticos diferenciales de causa
no infecciosa son: tromboflebitis superficiales y trombosis venosa profunda;
picadura de insectos con reacción inflamatoria a nivel local; reacciones
adversas a drogas, celulitis eosinofílica, gota; linfedema; paniculitis;
linfomas o leucemias; eritema nodoso, lipodermatoesclerosis, podagra,
linfangitis troncular, tromboflebitis y fascitis necrosante, erisipeloide,
dermatitis por contacto y carcinoma erisipeloide (inflamación cutánea asociada
con frecuencia al cáncer de mama)9, 87, 88.
En estas
situaciones es preciso evitar el uso indiscriminado de antibióticos8, 10, 87, 89 y descartar el diagnóstico por otros estudios
complementarios.
Diagnóstico: El diagnóstico
tanto de la erisipela como de la celulitis se realiza habitualmente en base a
la presentación clínica (A-II).
Los hemocultivos
raramente son positivos (menos del 5% de los casos), pero se sugiere la toma en
pacientes inmunocomprometidos o en aquellos que están con signos de sepsis o
que presentan SIRS (A-II).
El cultivo de la
biopsia de la lesión se acompaña de una tasa de rescate cercana al 20-30%94, 109, 110. No suele ser necesaria la realización de una
punción aspiración o de una biopsia cutánea para el diagnóstico, dado que aún
en los casos positivos no suelen modificar el tratamiento9, 10, 87, 89. De todos modos,
estos procedimientos pueden ser de utilidad en situaciones específicas, como
pacientes inmunocomprometidos (dado que el agente etiológico es menos
predecible), en formas de presentación atípicas, de sospecha de causa no
infecciosa o con posibilidad de presentar gérmenes atípicos o cuadros graves8, 89 (A-II). Se sugiere realizar la punción a través del mayor punto de inflamación9, 10, 110. En caso de duda
diagnóstica con infecciones necrosantes o celulitis complicadas con colecciones
o abscesos, se recomienda la punción con envío del material para estudio
microbiológico9.
En la erisipela,
los niveles de anticuerpos antiestreptolisina O (ASTO) están elevados
frecuentemente, pero su determinación carece de valor clínico-práctico. No se
recomienda su uso como elemento diagnóstico ni pronóstico10.
Tratamiento: El
objetivo del tratamiento en las infecciones no purulentas radica en controlar
la infección, aliviar los síntomas, y evitar complicaciones locales, secuelas y
episodios recidivantes10, 111, 112.
Si bien es una
práctica asistencial frecuente, no se recomienda la utilización de penicilina
benzatínica para el tratamiento del episodio agudo de erisipela debido a que se
asocia a fracasos terapéuticos con mayor frecuencia9. El uso de fluoroquinolonas en dosis única diaria
durante 5 días ha sido estudiado para el tratamiento de episodios de erisipela113, 114, pero no está recomendado.
El empleo de
corticoides con el fin de disminuir la respuesta inflamatoria ha sido
previamente investigado113-115. En un estudio aleatorizado donde 108 pacientes
recibieron tratamiento antibiótico solo o combinado con 30 mg/día de
prednisolona, el grupo que recibió corticoides se benefició en términos de
tiempo a la curación, duración de tratamiento antibiótico parenteral y duración
de hospitalización. Por ello, el uso de corticoides como medida coadyuvante
puede ser considerado en casos seleccionados, como presencia de edema
importante, púrpura o ampollas. En las erisipelas purpúricas el uso de
corticosteroides disminuye la frecuencia y la magnitud de la necrosis
secundaria.
Antes de tratar la
celulitis o la erisipela, puede ser de utilidad el dibujo de la extensión de la
infección con un marcador quirúrgico, a fin de poder evaluar la evolución88 (A-III). Una vez instaurado el tratamiento inicial, es importante reevaluar al
paciente a las 48-72 h, a fin de valorar la mejoría o el empeoramiento de los
síntomas sistémicos, la aparición o el incremento del dolor local, y el aumento
del enrojecimiento o el edema de la lesión, en relación con la primera
evaluación88 (A-III).
Tratamiento de cuadros leves (manejo ambulatorio): En casos leves de erisipela o celulitis (pacientes
sin signos o síntomas de enfermedad sistémica y sin comorbilidades que puedan
complicar el cuadro) el tratamiento empírico debe dirigirse contra
estreptococos y S. aureus sensible a la meticilina con cefalosporinas de
primera generación (cefalexina o cefadroxilo) (A-II).
Si se registran
claros factores de riesgo para SAMR o falta de respuesta tras 48-72 h de
tratamiento, considerar el agregado de TMP/SMX o tetraciclina (minociclina o
doxiciclina) (A-II). En pacientes con alergia a los betalactámicos, se
recomienda el uso de clindamicina. Es importante que la alergia a penicilina
sea adecuadamente demostrada116 (A-II).
Tratamiento de cuadros moderados (manejo hospitalario): En casos de celulitis o erisipela moderados
(pacientes con signos sistémicos de infección, requerimiento de medicación
parenteral y potencial necesidad de tratamiento quirúrgico, niños, huéspedes
inmunocomprometidos, lactantes) considerar un régimen intravenoso con
cefazolina (A-II). En pacientes con riesgo de SAMR-Co o falta de
respuesta a las 48-72 h, evaluar el agregado de vancomicina EV, o TMP/ SMX como
alternativa9, 18, 88 (A-II). En situaciones con riesgo de infecciones por BGN, se recomienda
utilizar ceftriaxona en lugar de cefazolina9, 87 (A-II).
Tratamiento de cuadros graves (manejo en terapia intensiva): En caso de erisipela o celulitis graves (pacientes
con signos de SIRS e hipotensión, inmunodepresión o progresión rápida,
potencialmente mortales), considerar la cobertura de SAMR con vancomicina
(alternativas: linezolid o daptomicina, solo en situaciones muy seleccionadas),
BGN (piperacilina/tazobactam, cefalosporinas de 3ra o 4ta generación) y el
agregado de clindamicina por su efecto antitoxina10, 18, 88 (A-II). En aquellos casos que se sospeche celulitis necrosante, se debe
considerar el desbridamiento quirúrgico con toma de muestra para terapia
agente-específica según cultivo y antibiograma del tejido obtenido9, 18 (A-II).
La duración óptima
del tratamiento no está completamente establecida; en general se recomienda
mantenerlo durante 5 y 7 días, aunque puede ser necesario una mayor duración en
caso de falta de mejoría en ese período8, 9, 114, 117 (A-III).
Se recomienda
además instrumentar las medidas preventivas necesarias a fin de evitar las
recidivas, como la elevación de la zona afectada9, 87, 88, el tratamiento de la puerta de entrada (Ej.: uso
de antimicóticos tópicos o antibióticos para el tratamiento de intertrigos,
onicomicosis, queratodermias fisuradas, etc)91 (A-III). Otras consideraciones a tener en cuenta para evitar las recurrencias
son la compresión con vendas elásticas y la disminución de peso en obesos118.
Erisipela y celulitis recurrentes
La celulitis y la
erisipela pueden presentar episodios recurrentes, con una frecuencia que se
describe en alrededor del 10 al 50%119-121, especialmente en pacientes con factores
predisponentes.
Definición: La celulitis y
erisipela se definen como recurrentes cuando se producen 2 o más eventos en el
lapso de 6 meses. Su incidencia aumenta luego de cada episodio, incluso con
posterioridad a un tratamiento óptimo122, 123. La etiología de los episodios recurrentes es
similar a la de los episodios agudos124.
Factores predisponentes: Los factores de riesgo predisponentes de erisipela y celulitis
recurrente se pueden dividir en locales y sistémicos.
Factores predisponentes locales: El primero a considerar es el episodio previo de celulitis, que
compromete y altera el drenaje linfático. Algunos estudios han mostrado que
cada recurrencia incrementa el riesgo de nuevos episodios, particularmente en
adultos mayores125.
El sitio anatómico
del episodio de celulitis también es importante, siendo los miembros
inferiores, especialmente el área tibial, cinco veces más frecuente, comparado
con pies o región femoral120.
Muchos de los
factores de riesgo locales están relacionados directa o indirectamente con la
presencia de edema crónico126, 127, definido como aquel que afecta una o más áreas del
cuerpo y que persiste por más de 3 meses.
El linfedema es un
tipo de edema crónico, frecuentemente asociado con distintos tipos de cáncer128, y muy fuertemente
relacionados con la recurrencia en celulitis y erisipela125, 129-131. Con cada recurrencia, el linfedema residual se
agrava y a su vez es un terreno favorecedor de nuevas erisipelas, llegando en
ocasiones a la elefantiasis.
Las dermatomicosis,
que incluyen tinea pedis interdigitalis, tinea pedis plantaris u
onicomicosis, predisponen a la puerta de entrada bacteriana. La colonización
con estreptococos beta-hemolíticos también podría estar relacionada con mayor
riesgo de infección y recurrencia90, 91, 94. Estos sitios podrían comportarse como reservorios,
aunque aún no se ha demostrado fehacientemente la asociación entre colonización
y riesgo incrementado de recurrencias.
Otros factores de
riesgo locales son la insuficiencia venosa, la enfermedad vascular periférica,
la trombosis venosa profunda, los traumatismos y las intervenciones quirúrgicas
(ej.: safenectomía).
Factores predisponentes sistémicos: Se deben mencionar la obesidad, la diabetes y el cáncer9, 119. La obesidad se asocia con comorbilidades y edema
crónico (afectan hasta el 80%), y la diabetes con complicaciones
macrovasculares y microvasculares. El control glucémico es fundamental: los
niveles de Hb glicosilada > de 7.5% aumentan 1.4 veces el riesgo de
celulitis122.
Una rigurosa
evaluación para corregir estos factores, el correcto tratamiento del episodio
agudo y el manejo multidisciplinario, son pilares fundamentales para evitar la
recurrencia.
Diagnóstico: Se basa en la
historia y manifestaciones clínicas. Es primordial evaluar los factores de
riesgo y las características de los episodios previos, fundamentalmente la
localización, el tiempo de presentación y las posibles puertas de entrada
(trauma, úlceras) (A-III).
El episodio
recurrente de celulitis o erisipela es generalmente similar al episodio agudo:
unilateral, afecta típicamente los miembros inferiores y causa signos de
inflamación local (dolor, calor, rubor, linfangitis) (A-III). Frecuentemente
se asocian signos sistémicos como fiebre. En algunas ocasiones pueden
acompañarse de vesículas, bullas, pústulas o necrosis, linfangitis y adenopatía
regional87.
Los hisopados
nasales para búsqueda de SAMR tienen un VPN elevado (94-99%) en áreas de alta
prevalencia. Son de utilidad para, eventualmente, poder desescalonar el esquema
empírico de antibióticos132, 133 (A-III).
Prevención de las recurrencias: Para la prevención de las recurrencias se deben considerar medidas
farmacológicas y no farmacológicas. Es sumamente importante acordar con el
paciente cuál será el tratamiento por instituir, a fin de asegurar el
cumplimiento adecuado del mismo134.
Medidas de prevención no farmacológicas: Varias intervenciones no farmacológicas han sido
propuestas para disminuir la frecuencia de los episodios de recurrencia. Entre
ellas deben mencionarse las siguientes118.
• Reducción de peso en pacientes obesos debido a que
se facilita el drenaje linfático y el flujo vascular (A-II).
• Tratamiento físico del linfedema (vendaje, drenaje
linfático manual, ejercicios, cuidados de la piel y medias elásticas compresión
entre 30 y 60 mmHg, compresión neumática) (A-II).
• Elevación de los miembros inferiores siempre que sea
factible en pacientes con insuficiencia venosa o linfedema (A-II).
• Tratamiento farmacológico efectivo de los
intertrigos micóticos y de las onicomicosis. (A-II).
• Educación del paciente (A-II).
También se deben
considerar la cesación tabáquica, el ejercicio físico y el adecuado control de
la diabetes (B-III).
La decolonización
en pacientes con S. aureus y portadores nasales SAMR puede ser
considerada en pacientes con infecciones recurrentes por SAMR135 (B-III).
Medidas de prevención farmacológicas: Las intervenciones farmacológicas para la prevención de las
recurrencias deben considerarse ante la falla o imposibilidad de implementación
de las medidas no farmacológicas mencionadas anteriormente9, 10, 131 (A-II).
No existen recomendaciones
claras para indicar la profilaxis antibiótica. Algunos investigadores la
recomiendan luego del segundo episodio. En los pacientes que presentan los
factores de riesgo descritos se deberá iniciar la profilaxis en forma precoz,
dado el mayor riesgo de recurrencia. También se debe evaluar la gravedad y el
riesgo de complicaciones, el riesgo de resistencia en tratamientos prolongados
con antibióticos, la frecuencia de los episodios de celulitis y la presencia de
cultivos previos positivos88.
* Una revisión Cochrane concluyó que la
administración de antibióticos redujo el riesgo de episodios futuros en un 69%,
redujo su número en más de un 50%, y aumentó significativamente el tiempo hasta
el próximo ataque en comparación con placebo o ningún tratamiento (evidencia de
certidumbre moderada)119. Sin embargo, estos efectos preventivos de los
antibióticos parecen disminuir después de su interrupción, y, por otra parte,
la evidencia está limitada a los pacientes con al menos dos episodios pasados
de infección de la pierna en un plazo de hasta tres años. Ninguno de los
estudios investigó otras intervenciones comunes como los métodos de reducción
del linfedema o el cuidado adecuado de la piel. Es necesaria la realización de
estudios más amplios, de alta calidad, que incluyan un seguimiento a largo
plazo y otras medidas profilácticas.
En conclusión, este
grupo de trabajo recomienda la indicación de profilaxis antibiótica luego de
2-4 episodios separados de celulitis, en el transcurso de un año (A-II), considerando
la importancia de la evaluación y corrección de los factores de riesgo
predisponentes9, 87, 88, 118, 136.
La profilaxis
antibiótica debe ser dirigida fundamentalmente hacia Streptococcus, especialmente
S. pyogenes. Dado que no se observó resistencia de S. pyogenes a
penicilina en Argentina, según datos de la red WHONET26, este antibiótico
continúa siendo la droga de elección para los esquemas de profilaxis.
Algunos esquemas
que podrían recomendarse son (A-II):
• Penicilina benzatínica 1.2 a 2.4 MU cada 2 a 4
semanas
• Penicilina vía oral 500 000 UI cada 12 horas durante
6-12 meses
• Pacientes alérgicos a la penicilina: eritromicina
250 mg cada 12 horas u otros macrólidos. Esta clase de antibiótico solo se
aconseja en pacientes alérgicos a betalactámicos, debido a la creciente
resistencia del S. pyogenes a los mismos.
Considerar siempre
el ajuste de dosis necesario en los pacientes obesos.
La duración del
tratamiento farmacológico preventivo también es tema de debate. En general se
recomienda una extensión de 6 a 12 meses9, 134, 137 (A-III). La profilaxis antibiótica es efectiva en el momento en que se usa,
pero su efectividad se reduce con el tiempo119-123, por lo que puede continuar si ocurren otros
episodios o si no se corrigen los factores predisponentes. Luego de un año sin
intercurrencias, la dosis de penicilina puede disminuirse, y suspenderse luego
de 2 años si no reaparecen episodios de celulitis y continúan los cuidados de
piel134. En general dosis bajas dosis de antibiótico son bien toleradas. Las
desventajas incluyen reacciones alérgicas, generación de resistencia, riesgo de
infección por Clostridioides difficile y costos. No hay evidencias del
uso de corticoides sistémicos para prevenir celulitis recurrente124.
La eficacia de
prevención con el uso de diuréticos y protectores vasculares no ha sido
demostrada.
Infección del sitio quirúrgico
Definición: La infección del
sitio quirúrgico (ISQ) es la infección que ocurre en la incisión quirúrgica o
cerca de ella, durante los primeros 30 días o hasta un año, si se ha colocado
un implante138. Se las divide en superficiales, profundas y de órgano/espacio. Las
primeras involucran el espacio subcutáneo, entre la piel y la fascia muscular,
y ocurren dentro de los 30 días de la cirugía; las profundas comprenden los
tejidos profundos, músculo y fascia, y también ocurren dentro de los 30 días de
la cirugía o dentro del año del evento, si se implantó material protésico; las
infecciones de órgano/espacio presentan la misma dimensión temporal que las
profundas, pero puede involucrar cualquier parte de la anatomía, tanto espacios
como órganos, distintos al sitio quirúrgico inicial138-140. Deben considerarse también las infecciones de
malla, en aquellos pacientes en los que se utilizó este elemento terapéutico141.
Epidemiología: Según el reporte
del Instituto Nacional de Epidemiología Dr. Juan H. Jara (INE), basado en la
información aportada por los hospitales adheridos al Programa Nacional de
Vigilancia de Infecciones Hospitalarias de Argentina, dependiente del Programa
Nacional de Epidemiología y Control de Infecciones Hospitalarias (VIHDA), la
incidencia promedio de ISQ es del 2.6%, lo que representa el 38% de las
infecciones nosocomiales en pacientes quirúrgicos142.
Microbiología: Los patógenos
aislados de las infecciones difieren, principalmente, en virtud del tipo de
cirugía realizada. En procedimientos quirúrgicos limpios o contaminados, los
patógenos aeróbicos y anaeróbicos de la microbiota endógena del órgano
quirúrgicamente resecado son los microorganismos aislados con mayor frecuencia.
En procedimientos quirúrgicos limpios, en los que no se ha accedido a los
tractos gastrointestinal, ginecológico o respiratorio, la causa habitual de
infección es S. aureus del ambiente exógeno o de la microbiota cutánea
del paciente. Sin embargo, en algunas zonas específicas del cuerpo, como la
ingle, la piel también podría estar colonizada por la microbiota entérica.
Además, es posible que procedimientos como prótesis de cadera o bypass vascular,
realizados en esta región anatómica, eventualmente puedan resultar infectados
por bacterias Gram negativas.
Según el reporte
VIHDA en 2023, de un total de 931 aislamientos en ISQ, los microorganismos más
frecuentemente hallados en cirugías NO laparoscópicas fueron: S. aureus 25.92%;
S. epidermidis 9.41%; K. pneumoniae 9.41% y E. coli 8.64%. En
ISQ de cirugías laparoscópicas predominaron E. coli 21.05%; y K.
pneumoniae 18.42%142.
Factores de riesgo: Los factores que
facilitan la producción de una ISQ pueden ser clasificados en no modificables
(edad, sexo, diabetes, enfermedades preexistentes), modificables (tabaquismo,
nutrición), perioperatorios (tiempo de estadía hospitalaria preoperatoria,
experiencia del cirujano, longitud de la incisión, duración de la operación,
transfusión de sangre por operación, drenaje de la herida y naturaleza de la
herida ) y postoperatorios (cuidado de la herida, programa hospitalario de
control de infecciones)143. Los principales factores que contribuyen a las ISQ
incluyen la duración de la operación, la diabetes mellitus y la puntuación en
el sistema de clasificación ASA (American Society of Anestesiologist)139.
Manifestaciones clínicas: Varía según se trate de infección superficial, profunda,
órgano/espacio o malla.
ISQ superficial: compromete
únicamente la piel y los tejidos blandos subcutáneos. Ocurre en los 30 días
después de la cirugía140, 142. Debe incluir al menos una de las siguientes
condiciones:
a) Drenaje
purulento, con o sin confirmación microbiológica por la incisión superficial.
b) Aislamiento del
microorganismo en un fluido o tejido.
c) Al menos uno de
los siguientes signos o síntomas de infección: dolor, inflamación, eritema,
calor o que el cirujano haya abierto deliberadamente la herida quirúrgica,
excepto si el cultivo es negativo.
d) Diagnóstico de
ISQ por el cirujano.
ISQ profunda: Infección que
ocurre dentro de los 30 días posteriores a la cirugía si no existe un implante
o hasta un año después si hay algún implante relacionado con la operación. La
infección envuelve tejidos blandos profundos (fascia y músculo).
Se requiere al
menos una de las siguientes condiciones138, 140:
a) Drenaje
purulento de esta zona, sin que comprometa infecciones de órgano y espacio del
sitio operatorio.
b) Dehiscencia de
suturas profundas espontáneas o deliberadamente por el cirujano cuando el
paciente tiene, al menos, uno de los siguientes signos o síntomas: fiebre (>
38°C), dolor
localizado, irritabilidad a la palpación, a menos que el cultivo sea negativo.
c) Absceso u otra
evidencia de infección que afecte la incisión profunda al examen directo,
durante una reintervención, por histopatología o examen radiológico.
d) Diagnóstico de
ISQ profunda hecha por el cirujano o por la persona que lo esté atendiendo.
Infección de órgano/espacio: Es aquella en la que se dan las siguientes condiciones: la infección
ocurre en los 30 días siguientes a la cirugía, sin implante; o bien ocurre al
año siguiente de la cirugía, cuando hay un implante en el lugar quirúrgico; o
que pueda relacionarse con la cirugía y comprometer cualquier órgano o espacio
diferente de la incisión, que fue abierto o manipulado durante el procedimiento
quirúrgico138, 140. Un ejemplo de este tipo de infecciones,
recientemente descripto, es la endocarditis infecciosa secundaria a TAVI
(implante de válvula aórtica trans-catéter, por sus siglas en inglés)144.
Requiere la
presencia de al menos una de las siguientes condiciones:
a) Drenaje
purulento a partir de un órgano o espacio por la incisión.
b) Microorganismos
aislados de un cultivo tomado en forma aséptica de un líquido o tejido
relacionado con órgano y espacio.
c) Un absceso u
otra evidencia de infección que envuelva el órgano o el espacio, encontrado en
el examen directo durante reintervención, por histopatología o examen
radiológico.
d) Diagnóstico de
infección de órgano y espacio por el cirujano a cargo,
Infección de malla: Las infecciones de
la malla deben distinguirse de las infecciones del sitio quirúrgico
superficiales por incisión. Se producen en el período posoperatorio temprano145.
Los pacientes con
infecciones profundas de la malla pueden presentar signos de inflamación local.
Sin embargo, con mayor frecuencia, tienden a ser indolentes y presentan signos
y síntomas crónicos. Es posible que inicialmente se las subestime145.
Los microorganismos
causantes habituales de infecciones de la malla son S. aureus, incluido
SAMR, S. epidermidis y estreptococos, y BGN, incluidas las
enterobacterias.
El objetivo de las
estrategias de prevención y control de infecciones, incluida la profilaxis
quirúrgica con antibióticos, es minimizar el recuento bacteriano en la herida y
disminuir la adherencia de los microorganismos a la malla145.
Diagnóstico: Los signos locales
de dolor, edema, eritema y drenaje purulento proporcionan la información más
confiable para diagnosticar una ISQ (A-II). Una vez diagnosticada la
infección o si existe una alta sospecha clínica, se debe instaurar tratamiento,
a la par que, si corresponde, realizar técnicas complementarias de diagnóstico,
como cultivos, hemocultivos o pruebas de imagen138-140 (A-II).
En pacientes con
obesidad mórbida o en aquellos con heridas profundas de múltiples capas, como
después de una toracotomía, los signos externos de ISQ pueden retrasarse. Si
bien muchos pacientes con ISQ desarrollarán fiebre, generalmente no ocurre
inmediatamente después de la operación y, de hecho, la mayoría de las fiebres
posoperatorias no están asociadas con una ISQ9, 146, 147.
Las ISQ rara vez
ocurren durante las primeras 48 horas después de la cirugía y la fiebre durante
ese período generalmente surge por causas no infecciosas o desconocidas. Las
ISQ que ocurren en este período casi siempre se deben a especies de S.
pyogenes o Clostridium9, 148, 149.
Después de 48 h, la
ISQ es una causa más común de fiebre y está indicada una inspección cuidadosa
de la herida; cuatro días después de la cirugía es igualmente probable que la
fiebre sea causada por una ISQ o por otra infección u otras fuentes desconocidas9.
Las infecciones
posteriores son menos probables, pero los estándares de vigilancia exigen 30
días de seguimiento para operaciones sin colocación de material protésico y
durante 1 año para operaciones en las que se insertó una prótesis9.
Tratamiento: Los 3 pilares
fundamentales del tratamiento son la instauración de un tratamiento antibiótico
adecuado, el drenaje quirúrgico y el soporte metabólico y hemodinámico del
paciente, que evite la aparición de una segunda complicación140.
Los pacientes con
temperatura >38.5°C o frecuencia cardíaca >110 latidos/minuto o
eritema que se extiende más allá de los márgenes de la herida por >5 cm
pueden requerir un ciclo corto de antibióticos, así como la apertura de la
línea de sutura9.
En el caso de ISQ
siempre se debe retirar la sutura y realizar incisión y drenaje (A-II).
La elección del
antibiótico suele ser empírica según epidemiología local, hasta disponer del
resultado de la tinción de Gram, y antibiograma de cultivo del contenido de la
herida y el sitio de la cirugía9, 146 (A-II).
Se debe proceder a
la extracción del foco séptico mediante drenaje, que puede ser directo al
exterior o a través de cavidades naturales140.
Se debe realizar un
desbridamiento amplio de los tejidos, extrayendo aquellos que estén
desvitalizados, y demás detritus, con destrucción de posibles puentes de
fibrina que puedan formar compartimientos con colecciones purulentas, lavado
con abundante solución fisiológica140 (A-II).
La terapia más
importante para una ISQ es abrir la incisión, evacuar el material infectado y
continuar con los cambios de vendaje hasta que la herida sane por segunda
intención9, 140.
Numerosos estudios
experimentales y ensayos clínicos demuestran que los antibióticos que se
inician inmediatamente después de la operación o se continúan durante largos
períodos después del procedimiento, no previenen ni curan esta inflamación o
infección9, 146. Por lo tanto, si hay <5 cm de eritema e
induración y el paciente no tiene signos sistémicos, la recomendación de
antibióticos sería innecesaria147.
Las ISQ incisionales
siempre deben drenarse, irrigarse y, si es necesario, abrirse y desbridarse. Si
se sospecha alteración fascial, siempre se debe realizar drenaje. El drenaje
percutáneo, la irrigación de heridas y el tratamiento de heridas asistido por
presión negativa son opciones nuevas y eficaces que reducen la necesidad de un
tratamiento abierto de las infecciones de las heridas. En los casos en los que
se necesita un tratamiento abierto, una vez que la infección ha desaparecido,
se puede cerrar la herida.
Tratamiento antibiótico de ISQ: Para cirugía abdominal y vaginal, en la que predominan las infecciones
por BGN y anaerobios, se recomienda un tratamiento empírico según su
epidemiología local que puede ser desde ampicilina-sulbactam,
piperacilina-tazobactam, o combinación de gentamicina y metronidazol, además
del tratamiento quirúrgico (A-II).
En procedimientos
limpios en los que no se ingresó al tracto intestinal o genital, S. aureus y
las especies de estreptococos son los organismos más frecuentes. En estos casos
(cirugías limpias en el tronco, la cabeza y el cuello, o en extremidades) que
presentan signos sistémicos de infección está indicado un ciclo corto de
antibióticos sistémicos (A-II).
Se recomienda una
cefalosporina de primera generación para SAMS, pero si la institución en la que
se realizó la operación tiene una proporción significativa de infecciones por
SAMR o el paciente ha tenido una infección por SAMR previa, hospitalización reciente,
colonización nasal o estuvo tomando antibióticos previamente, el antibiótico
inicial debe incluir vancomicina (alternativas linezolid o daptomicina, solo en
situaciones muy seleccionadas), para cobertura de SAMR (A-II).
Las infecciones que
se desarrollan después de procedimientos quirúrgicos que involucran áreas no
estériles como la mucosa colónica, vaginal, biliar o respiratoria pueden ser
causadas por una combinación de bacterias aeróbicas y anaeróbicas.
Por lo tanto, en
ISQ secundarias a cirugías en axila, tracto gastrointestinal, periné o tracto
genital femenino se recomiendan agentes activos contra BGN y anaerobios, como
una cefalosporina en combinación con metronidazol (A-II).
En todos los casos
debe adecuarse el tratamiento antibiótico a los resultados del antibiograma.
Prevención: Si bien el enfoque
de esta guía está orientado hacia el tratamiento, a modo de resumen se
recomienda:
a) El adecuado
conocimiento de los factores de riesgo para la aparición de ésta, así como de
las medidas que disminuyen su incidencia, es la medida más eficaz para su
reducción. El lavado quirúrgico, el uso de antibióticos y, sobre todo, la
depurada técnica quirúrgica son los principales factores de riesgo
identificados.
b) Se debe realizar
una vigilancia activa de las ISQ en el postoperatorio que permita un
diagnóstico y un tratamiento temprano de éstas. La prevención de la aparición
de ISQ debe ser una actitud activa, continua y primordial para todo el personal
implicado en el preoperatorio, el perioperatorio y postoperatorio.
c) Se recomienda la
consulta a las guías específicas de prevención143, 150-152, entre las cuales
se menciona la Guía Intersociedades de Profilaxis Antibiótica Quirúrgica en
pacientes adultos, publicada en 2024 por la Sociedad Argentina de Infectología,
la Asociación Argentina de Cirugía y la Asociación de Anestesia, Analgesia y
Reanimación de Buenos Aires153.
Infecciones necrosantes
Definición: El término
infecciones necrosantes (IN) de partes blandas ha reemplazado hoy en día a
otras denominaciones, en su mayoría confusas y, poco prácticas, con la idea de
englobar entidades relacionadas y con enfoque diagnóstico y terapéutico
similares12, 154. Dentro de las IN pueden describirse a la celulitis
necrosante, que afecta predominantemente la piel y el tejido celular subcutáneo
(fascia superficial), sin alcanzar la fascia muscular o profunda; la fascitis
necrosante, que afecta la fascia superficial y la muscular, y la mionecrosis,
que afecta la masa muscular12. El tratamiento no difiere significativamente entre
estas entidades, por lo que lo importante es diferenciar precozmente estas
infecciones graves (que requieren inmediato tratamiento quirúrgico y
antibiótico) de un cuadro no grave que, en general, presenta buena evolución
con tratamiento antibiótico y un simple drenaje.
Las IN puede
definirse como un proceso rápidamente progresivo de la piel y los tejidos
blandos, asociado a destrucción y necrosis de la fascia y de la grasa,
caracterizado por la friabilidad de la fascia superficial, exudado grisáceo y
ausencia de pus, y que se acompaña de importante toxicidad sistémica y con alta
mortalidad. Puede dividirse en polimicrobiana o monomicrobiana155, 156, aunque algunos autores señalan, adicionalmente,
otros tipos ocasionados por Clostridium spp., Aeromonas spp., Vibrio
spp. (V. vulnificus, principalmente) u hongos157.
La mionecrosis
clostridica o gangrena gaseosa por Clostridium (GGC) es una infección de
la piel y estructuras relacionadas, de evolución fulminante, de presentación
clínica muy característica y potencialmente mortal158. Si bien el principal agente causal es el Clostridium
perfringens, puede ser ocasionada por otras especies de Clostridium, como
C. septicum156, 159.
Epidemiología: Considerando que
las IN engloban multiplicidad de agentes etiológicos, no es factible realizar
un único análisis epidemiológico.
La incidencia de IN
es difícil de determinar en el mundo. No ha sido posible encontrar estimaciones
específicas de Argentina, a excepción del reporte epidemiológico nacional que
da cuenta del aumento de enfermedad invasiva por S. pyogenes,
coincidente con reportes de otros países luego de la pandemia160, 161. Series de EE. UU. reportan una incidencia anual de
8.7 a 10.3 casos cada 100 000 individuos162, similar a reportes de otros países163. Usualmente la
frecuencia es mayor en climas templados154, 164.
En cuanto a la
gangrena clostrídica (GC), trabajos realizados en los EE. UU. estimaron que
anualmente se producen unos 1000 casos165. Aproximadamente la mitad de ellos son secundarios
a lesiones traumáticas (alrededor del 70% debidas a accidentes vehiculares),
30% son complicaciones posoperatorias, vinculadas generalmente a cirugías de
apéndice, tracto biliar o intestinal y el 20% restante son casos de gangrena
gaseosa espontánea (GGE)165, 166.
La mortalidad de
las IN ha variado a lo largo del tiempo, con informes que muestran un descenso
del 14.8% a 4.8%163, 167, 168. Debe señalarse que la demora diagnóstica169 y un abordaje quirúrgico insuficiente en el primer
desbridamiento170, 171 aumentan notablemente la probabilidad de muerte. Un
trabajo focalizado en IN en pediatría señaló que la mortalidad es del 19%
cuando el desbridamiento se realiza dentro de las 6 horas de iniciado el
cuadro, pero aumenta al 32% si el abordaje se hace más de 6 horas después93. La GC se asocia con una alta tasa de letalidad,
que puede ir desde el 25% en aquellos con trauma, a casi el 100% si no se
recibe un tratamiento adecuado165, 172.
Factores de riesgo: Los factores de
riesgo típicamente descritos para las IN son diabetes, enfermedad renal
crónica, cirrosis, alcoholismo, accidente cerebrovascular previo y enfermedad
valvular cardíaca173, 174, los cuales se asocian también a mayor mortalidad.
El uso de drogas de abuso endovenosas sería otro factor de riesgo, aunque con
características particulares en su manejo154, 157.
Microbiología: Tradicionalmente se
las dividía en tipo I o polimicrobianas y tipo II o monomicrobianas175.
Las IN
polimicrobianas engloban tanto gérmenes aerobios como anaerobios, provenientes
principalmente de la propia flora del paciente, pudiendo alcanzar el tejido
subcutáneo por traumas, fístulas o instrumentación médica. Los aislamientos más
frecuentes son E. coli y K. pneumoniae162, 176.
En las
monomicrobianas los aislamientos más frecuentes son S. pyogenes y S.
aureus, y se producen por transmisión de persona a persona por contacto o
gotas, y, frecuentemente, sin puerta de entrada evidente, siendo infrecuente su
asociación con cuidados de la salud162, 177. En Argentina, el linaje circulante de SAMR-AC es
ST5 SCC mec IVa, productor de leucocidina de Panton-Valentine, mientras que S.
pyogenes presenta 0% de resistencia a penicilina, 0.7% a clindamicina y
1.7% a eritromicina12.
Existen otras
entidades clásicas como la GC o mionecrosis clostrídica, de presentación
clínica muy característica y potencialmente mortal158. El principal agente causal es el Clostridium
perfringens, típicamente luego de un traumatismo158. La acción de las toxinas de C. perfingens, particularmente
la a, causa gran
destrucción tisular al mismo tiempo que favorece el desarrollo del
microorganismo, exacerba la toxemia y genera hemólisis intravascular178. Este cuadro
clínico también puede ser ocasionado por otras especies como C. novyi, C.
histolyticuym, C. sordelli, que incluso pueden asociarse con mayor
mortalidad156, 159, 179. Por su parte, C. septicum es el agente más
frecuente de la GGE, habitualmente asociada a cáncer de colon y neutropenia12, 180.
Las infecciones por
Aeromonas spp. o Vibrio spp tienen presentación similar, aunque
presentan como antecedente epidemiológico el contacto con agua dulce o salada, respectivamente162. Por otro lado,
antecedentes tales como lesiones traumáticas o quemaduras suelen asociarse a
hongos que pueden ser tanto levaduras (Candida spp.) como hongos
filamentosos (Aspergillus spp. o Zigomicetes)162, 177.
Manifestaciones clínicas: Se describe clásicamente la tríada de dolor, edema y eritema, también
encontrada en afecciones más benignas. Habitualmente suele comenzar con dolor
de gran intensidad, desproporcionado
respecto a la ausencia de evidentes signos cutáneos. Esta sintomatología puede
ser distorsionada por analgésicos, lo que
podría asociarse a peor pronóstico181, 182, o en casos de
neuropatía diabética183. Adicionalmente, puede evidenciarse aumento de
temperatura local, cambios de coloración, equimosis en
parches, secreción maloliente, fiebre o diarrea157, 184. Luego de 24 a 48 h
puede evolucionar con vesículas o flictenas, algunas
con contenido hemático, pudiendo llegar a la necrosis y crepitación154. En las
infecciones monomicrobionas, las lesiones superficiales pueden pasar desapercibidas hasta que se haya establecido un daño
extenso. Finalmente, es frecuente que desarrolle
sepsis, shock séptico y/o falla multiorgánica27, 154, 185, especialmente si
hay demoras en la consulta, diagnóstico o tratamiento. El deterioro clínico,
especialmente con mala respuesta al tratamiento antibiótico empírico, debe
hacer sospechar la posibilidad de infección necrosante154, 155, 184. La mayoría de estos pacientes requerirán manejo en
terapia intensiva9, 12.
La GC se
caracteriza por la aparición repentina de un dolor muy intenso en el sitio de
la infección y rápido desarrollo de una herida maloliente que contiene una fina
capa sero-sanguinolenta, con producción de burbujas de gas. Se desarrolla edema
muscular e induración, que da paso a la generación de ampollas cutáneas de
color azulado a granate158. La GGE es un cuadro mucho más infrecuente. Se
desarrolla en tejido blando normal en ausencia de traumatismo, resultado de
diseminación hematógena de una afección colónica, generalmente cáncer12, 180. En general, el diagnóstico no se considera hasta
que se detecta gas en el tejido o aparecen signos sistémicos de toxicidad12, 158.
Diagnósticos diferenciales: Se plantea como diagnósticos diferenciales otras IPPB como erisipela,
celulitis, absceso, flemón y miositis necrosante. El diagnóstico de las IN es
esencialmente clínico y en los casos de alta sospecha no debe retrasarse la
exploración quirúrgica, ya que su pronóstico depende del tratamiento agresivo
inmediato.
Diagnóstico: Se basa en la
sospecha clínica y los hallazgos quirúrgico163.
Desde el punto de
vista clínico, suele comenzar con dolor de gran intensidad, desproporcionado
respecto a la ausencia de signos cutáneos evidentes (A-III).
El recuento de
glóbulos blancos (a expensas de los neutrófilos), la proteína C reactiva,
eritrosedimentación o procalcitonina suelen estar elevados154. Se han desarrollado scores con alto valor
predictivo positivo, como el Laboratory Risk Indicator for Necrotizing
Fascitis (LRINEC) y LRINEC modificado, aunque existe controversia respecto
a su sensibilidad154, 186, 187. La creatinfosfoquinasa se encuentra elevada
principalmente en infecciones monomicrobianas, sugiriendo necrosis188; la
hiperlactacidemia es un predictor independiente de mortalidad y necesidad de
amputación189. Sin embargo, ningún examen de laboratorio ha demostrado su utilidad
para descartar IN184. Es de notar que, cuando el cuadro clínico es
característico y la condición del paciente es crítica, no debiera retrasarse la
terapéutica en búsqueda de estudios diagnósticos adicionales12, 190.
La realización de
estudios de imágenes no tiene indicación, excepto en cuadros de presentación atípica, debido a que podría llevar a demoras
en la instauración de un tratamiento efectivo (A-III). De realizarse, la
RMN es el método de elección, particularmente en secuencia T2 con supresión
grasa154, 184. No obstante, la
TAC con contraste, dada su rapidez y amplia disponibilidad puede tener un lugar2, 39. Las radiografías, aunque a veces evidencian la
presencia de gas, pueden llevar a errores diagnósticos191. Existen comunicaciones que señalan el potencial
beneficio de utilizar ecografía191, 192.
Todos los test o
pruebas diagnósticas deben ser utilizados con mucho criterio, a fin de evitar
demoras en la instauración del tratamiento, especialmente en pacientes con
sepsis12, 190, 193.
El patrón de oro
para el diagnóstico sigue siendo la exploración quirúrgica184: tejido necrótico y fascia, secreción fétida como
“lavado de carne”, músculo no contráctil, ausencia de sangrado y “test del
dedo” positivo (A-III). Esta prueba, que puede realizarse al pie de la
cama, consiste en realizar una incisión de 2 cm, hasta la fascia, constatándose
la friabilidad de los tejidos que son disecados con el pasar del dedo por la
estructura desvitalizada.
Es fundamental la
toma de muestras de tejido para estudio microbiológico (cultivo y hemocultivos)
para guiar la antibioticoterapia (A-III). Los hemocultivos son positivos
entre el 11% y 60% y los tejidos tomados en el quirófano en un 80%174, 194. Adicionalmente, la punción con aguja fina del
tejido necrótico tiene un buen rendimiento
diagnóstico, como así
también punciones guiadas por ecografía cercanas a la fascia174, 184.
Tratamiento: Las IN son
emergencias clínicoquirúrgicas. El tratamiento se basa en tres pilares:
cirugía, antibióticos y cuidados intensivos9, 12, 194, 195.
Dado lo infrecuente
de la afección, es difícil encontrar evidencia en estudios aleatorizados sobre
comparaciones entre diferentes estrategias terapéuticas184. Sin embargo,
aunque las recomendaciones se basan en estudios de cohortes retrospectivas, los
datos disponibles sugieren que un diagnóstico precoz, junto a un desbridamiento
rápido y extenso, hasta tejido vital y sangrante, y junto a un tratamiento antibiótico
empírico eficaz disminuyen la mortalidad166, 196.
El tratamiento
quirúrgico precoz y extenso, junto a un tratamiento antibiótico empírico de
amplio espectro, disminuye la mortalidad (A-III).
Los principios
del manejo quirúrgico son: exploración quirúrgica precoz ante la
sospecha clínica, estabilización hemodinámica que comienza en guardia y/o
terapia intensiva y se completa en el quirófano, desbridamiento amplio con
resección de áreas desvitalizadas y necróticas hasta llegar al tejido vital y
sangrante, descompresión radical de la fascia mediante incisiones
longitudinales libres y escisiones del músculo infectado9, 12, 194, 195. La herida quirúrgica debe dejarse abierta, sin
realizar el cierre por primera intención. El cirujano debe realizar un control
diario para detectar progresión de la necrosis, ya que se deben realizar
re-exploraciones quirúrgicas en todos los pacientes, ya sea para una nueva
remoción de tejido o para asegurarse el éxito de la primera intervención9, 12, 156, 194, 197 (A-III). En caso de IN en la región perianal, comúnmente denominada Gangrena de
Fournier, se puede considerar el realizar colostomías y/o cistostomías de
protección12, 198, 199.
El tratamiento
antibiótico empírico debe ser amplio e idealmente bactericida, dada la
frecuencia de infecciones polimicrobianas87. Por otro lado, el rol de las toxinas de S.
pyogenes o S. aureus sugiere la necesidad de indicar antibióticos
que reduzcan su producción9, 12, 177. En este escenario, es preciso adoptar medidas para
optimizar la relación farmacocinética/farmacodinámica que suele requerirse en
los pacientes críticos200. El sitio anatómico puede sugerir agentes causales,
sin embargo, es prudente considerar una cobertura antibiótica amplia, que
incluya BGN, CGP y anaerobios. Por tanto, se recomienda el uso de un
betalactámico de amplio espectro, como piperacilina/tazobactam o un
carbapenémico, según factores de riesgo individuales para organismos
resistentes, asociado a vancomicina dirigido a SAMR9, 12, 87 (A-III). La evidencia disponible sugiere la adición de fármacos antitoxina,
como clindamicina o linezolid por un potencial beneficio en mortalidad, que es
independiente de la susceptibilidad de la cepa9, 12, 201-203 (A-III). Clindamicina no se recomienda como monoterapia por la potencial
resistencia12, 202, 204.
Una vez que se haya
establecido el diagnóstico de GC, ya sea por su presentación clínica o por los
hallazgos microbiológicos, se recomienda el tratamiento con penicilina más
clindamicina, tanto para casos traumáticos como para GGE27, 165. El fundamento de esta combinación es que, de acuerdo
con datos microbiológicos, la penicilina tiene mayor tasa de sensibilidad
frente a C. perfringens que clindamicina (5% de resistencia)9, pero, por otra parte, la clindamicina tiene la
capacidad de reducir la formación de toxinas, según se demostró en modelos
animales9, 87, 165. No se han realizado ensayos clínicos sobre el uso
de clindamicina en GGC9. Otros inhibidores de la síntesis proteica como
linezolid y tigeciclina son potencialmente útiles, pero no debe usarse como
primera opción debido al riesgo de generación de resistencia antimicrobiana9, 12.
Una vez que se
cuente con los resultados de los cultivos debe evaluarse el ajuste del
tratamiento según los aislamientos microbiológicos (A-III).
La duración del
tratamiento antibiótico no ha sido establecida. Una revisión sistemática sobre
infecciones necrosante que incluyó 4 estudios retrospectivos, no encontró
diferencias entre terapias breves (menos de 7 días) versus terapias prolongadas
(más de 7 días) en cuanto a sobrevida y necesidad de amputación, aunque muy pocos pacientes tenían GGC205. A falta de
ensayos clínicos definitivos, el tratamiento antibiótico debe extenderse hasta
que ya no sea necesario un nuevo desbridamiento, el paciente haya mejorado y no
se presente fiebre en las últimas 48-72 h12, 87, 204, 206, 207 (A-III). En pediatría, un consenso internacional sugirió que el tiempo de
tratamiento antibiótico mínimo es de 5 días por vía parenteral y el total entre
10 y 14 días, completando con vía oral, aunque podría requerirse más tiempo de
tratamiento de acuerdo a la evolución50.
Aunque no existe
acuerdo sobre el manejo de las heridas, según el criterio del equipo
quirúrgico, es razonable el uso del sistema de vacuum assisted closure (VAC),
una vez controlado el foco infeccioso87, 208.
Respecto a
intervenciones adicionales en GC, se menciona el tratamiento con oxígeno
hiperbárico (OHB). No se recomienda como medida universal, debido a que no se
ha demostrado su beneficio, y puede retrasar la reanimación y el desbridamiento
quirúrgico. Debe considerarse cuidadosamente la proximidad y la velocidad de
transferencia antes de transportar al paciente a las unidades de OHB, a fin de
no retrasar el control de foco12, 180, 209, 210. Algunos expertos sugieren que la OHB como terapia
adyuvante en necrosis clostridiales tiene buenos resultados en términos de la
reducción del tamaño y del aspecto vital de la lesión, siempre y cuando esté
accesible, no comprometa el inicio y/o continuidad del tratamiento quirúrgico y
la antibioticoterapia, y la condición clínica del paciente lo permita12, 93, 210.
Piomiositis
Definición: La piomiositis es
una infección aguda/subaguda, caracterizada por la presencia de pus dentro de
un músculo esquelético211. Las piomiositis pueden ser divididas en primarias,
cuando son debido a la diseminación hematógena, o secundarias, cuando ocurren
luego de un traumatismo (mayormente inyecciones) o de la extensión de procesos
infecciosos adyacentes1, 212, 213. Según una revisión sistemática, los principales
factores predisponentes para el desarrollo de piomiositis son trauma, diabetes
mellitus, enfermedad avanzada por HIV, ejercicio vigoroso, anemia,
malnutrición, infección cutánea, uso de drogas endovenosas y cáncer214.
Epidemiología: Si bien se
desconoce su prevalencia exacta, algunos autores sugieren que está en aumento212, 213. El grupo etario más frecuentemente afectado es el
de los hombres menores de 20 años, especialmente aquellos con comorbilidades o
enfermedades crónicas212, 214. La mortalidad osciló entre 1.8% y 9%214.
Microbiologia: S. aureus representa del 30% al 90% de los casos212, 214, en los últimos años principalmente SAMR-AC215-218. S. pyogenes grupo
A, otros Streptococos (grupos B, C y G), S. pneumoniae y BGN, como E.
coli, son otros posibles agentes etiológicos214, 219.
Diagnósticos diferenciales: Ante un paciente con posible piomiositis, debe hacerse diagnóstico
diferencial con osteomielitis, artritis, celulitis, trombosis vascular,
desgarro/rotura muscular y hematomas. Si el compromiso es de los músculos
abdominales, la piomiositis debe diferenciarse de enfermedades viscerales, como
apendicitis en el caso de la afectación del músculo psoas artritis séptica de
cadera en la afectación del músculo ilíaco212. En un paciente con fiebre de origen desconocido,
debe considerarse el diagnóstico de piomiositis212.
Manifestaciones clínicas: La piomiositis se caracteriza por la presencia de dolor localizado,
aumento de la sensibilidad a la palpación, debilidad muscular y fiebre9, 212, 215. Los músculos que más frecuentemente se ven
afectados son el cuádriceps, glúteos y pantorrillas, aunque también pueden
observarse compromiso del psoas, ilíaco, pectoral mayor, esternocleidomastoideo
y músculos de las extremidades superiores212, 220. La piomiositis
puede ser de presentación solitaria o múltiple212, 221.
Clínicamente, se
describen tres etapas en la evolución de la piomiositis222, 223 (Tabla 7). La primera etapa, o fase invasiva, se
caracteriza por edema y dolor (a menudo sordo y sensación de calambres),
asociado con fiebre de bajo grado y malestar. Puede durar entre 2 y 3 semanas.
Este estadio puede confundirse con condiciones trombóticas, hematoma,
distensión/desgarro muscular, osteomielitis o traumatismo (contusión).
La segunda etapa, o fase purulenta, está caracterizada por aumento de la
sensibilidad, edema y mialgia grave. El diagnóstico a menudo se realiza en esta
etapa ya que se reconoce un absceso definido por imagen o por el estudio
patológico. La piel suprayacente puede no mostrar eritema. La tercera etapa, o
fase tardía, es ya un cuadro grave, con signos de sepsis y potencial disfunción
orgánica múltiple212, 222.
|
TABLA
7 Piomiositis. Estadios y manejo223 |
||
|
Estadio de la enfermedad |
Características clínicas |
Resumen del manejo |
|
Estadio
1 Fase invasiva |
Suele
durar entre 10 y 21 días Aparición insidiosa de
dolores musculares sordos, febrícula, mialgias, malestar general, anorexia,
calambres Edema
localizado, a veces descrito como induración leñosa Poca o ninguna sensibilidad
muscular Solo un pequeño porcentaje de pacientes se presenta en esta etapa |
Terapia antibiótica |
|
Estadio
2 Fase purulenta o supurativa |
Duración
de 24 h a 12 días Suelen presentarse fiebre y
escalofríos Etapa caracterizada por la
formación de abscesos en la masa muscular La hinchazón es evidente o
visible con técnicas de diagnóstico Músculo(s) afectado(s)
sensible(s) La mayoría de los pacientes se presentan en esta etapa |
Terapia
antimicrobiana + drenaje de colecciones intramusculares o abscesos
incipientes (drenaje mediante técnicas percutáneas o cirugía abierta) |
|
Estadio
3 Fase tardía |
Fiebre
alta, dolor intenso, signos locales de infecciones y sistémicos
manifestaciones de sepsis Evoluciona a sepsis,
abscesos metastásicos y fallo multiorgánico, que puede asociarse con elevada
mortalidad Un pequeño porcentaje de pacientes presentes en esta etapa |
Terapia
antimicrobiana + escisión de absceso intramuscular (cirugía abierta a menudo
recomendado) |
El absceso del
psoas generalmente se desarrolla como resultado de la diseminación desde una
estructura adyacente, ya sea como una extensión de una infección intraabdominal
(apendicitis, diverticulitis, enfermedad de Crohn), absceso perinefrítico o
hematoma retroperitoneal infectado. También puede originarse por tuberculosis
vertebral, osteomielitis por S. aureus, o artritis séptica de la
articulación sacroilíaca1.
Como complicaciones
de la piomiositis se describen osteomielitis (5-73%), neumonía (11-18%) y
artritis séptica (2-16%)214.
Diagnóstico: La detección
temprana se considera la intervención más eficaz para minimizar las
complicaciones de la enfermedad214.
En cuanto al
diagnóstico microbiológico, se recomienda la toma de muestra de tejido y de
hemocultivos (A-I). Estos últimos son positivos en 5%-30% de los casos,
ya que la bacteriemia suele ser transitoria. Es imperativo realizar cultivos
para microorganismos aerobios y anaerobios junto con pruebas de sensibilidad a
los antibióticos para optimizar el tratamiento. En un huésped
inmunocomprometido, se deben considerar cultivos para Mycobacterium spp.,
Nocardia spp. y hongos. Las concentraciones séricas de creatina quinasa
(CPK) suelen ser normales en pacientes con un área única de piomiositis
relacionada con siembra hematógena215.
Entre los estudios
por imágenes, la RMN con contraste es el estándar de oro89, 220, 224-226. Si no se puede realizar, la TAC con contraste
también puede ser útil, aunque tiene menos sensibilidad213, 225, 226. La ecografía puede contribuir si los grupos de
músculos infectados son superficiales, pero su sensibilidad es baja para
detectar abscesos profundos o en las primeras etapas de la infección213. Sin embargo, dada
su accesibilidad y bajo costo, debe ser tenida en cuenta218 (A-II).
Tratamiento: El manejo dependerá del estadio de la enfermedad13, 14 (Tabla 7). En la etapa inicial, deben
administrarse antibióticos en forma empírica, mientras que, en las fases
purulenta y tardía, es imprescindible el drenaje de colecciones
intramusculares, ya sea mediante técnicas percutáneas o cirugía abierta227-230 (A-II).
En pacientes con
piomiositis grave, está ampliamente justificada una exploración quirúrgica de
urgencia, a fin de definir la naturaleza del proceso infeccioso (celulitis
crepitante versus gangrena gaseosa), que se realiza mediante examen directo de
los músculos involucrados1 (A-II).
En relación con la
antibioticoterapia, dada la prevalencia de SAMR-AC, se recomienda vancomicina
para la terapia empírica inicial215, 227. Otros agentes activos contra SAMR-AC (p. ej.,
linezolid, daptomicina o ceftarolina) también pueden ser eficaces231-233; sin embargo,
faltan datos clínicos, y, además, deben ser utilizados en situaciones muy
seleccionadas. En el manejo empírico debe considerarse la cobertura de BGN, con
piperacilina-tazobactam o ampicilina-sulbactam9 (A-II).
La duración
recomendada de la terapia antibiótica dependerá de la evolución clínica e
imagenológica, probablemente no menos de 2 semanas desde el control de foco (A-II).
Los antibióticos deben administrarse inicialmente por vía intravenosa, pero
ante la mejoría clínica debe considerarse el pasaje a terapia oral en pacientes
clínicamente estables, que ya hayan sido drenados y que tengan tolerancia a la
vía oral (A-II).
Enfermedad por arañazo de gato y angiomatosis
bacilar
Enfermedad por arañazo de gato
Definición: La
enfermedad por arañazo
de gato (EAG) es producida por un BGN, Bartonella henselae, cuyo
reservorio son los gatos, y que se transmite al humano a través de la
superficie cutánea. Se caracteriza por la presencia de una pápula o pústula con
linfadenitis regional benigna de evolución subaguda, que aparece entre los 5 y
20 días posteriores a una mordedura o arañazo de gato234. En pacientes inmunocomprometidos pueden
presentarse formas de mayor gravedad235.
Microbiología: B. henselae es un BGN, de difícil crecimiento en los cultivos, y que pueden ser
transmitidas a humanos mediante insectos vectores, por picaduras de pulgas o
mordeduras de animales236.
Epidemiología: La EAG es una
enfermedad cosmopolita. La seroprevalencia de Bartonella spp en gatos en
la Argentina es del 11.9%, pero puede fluctuar ampliamente en los diferentes
países (EE. U.U 15-44%, Francia 39.4%, Singapur 47.5% y Chile 85.6%)237. En un estudio
observacional realizado en un hospital pediátrico de nuestro país se incluyeron
150 pacientes con EAG, con una edad promedio de 7,9 años. El 68% refirió haber
tenido contacto con gatos, y el motivo de consulta más frecuente fueron las adenopatías
únicas (84.7 %), localizadas principalmente en cabeza y cuello238.
Manifestaciones clínicas: La forma de presentación más frecuente en inmunocompetentes se da en
niños entre 1 a 14 años en contacto con gatos.
En general se
presenta como un cuadro leve y autolimitado. Luego de los 5 a 20 días
posteriores al contacto con el
gato (generalmente en menores de un año) puede observarse en algunos pacientes
una lesión papular en la zona de inoculación, pero en el 90% de ellos se presenta una adenitis regional
unilateral generalmente cervical o submaxilar o con localizaciones múltiples,
acompañada de fiebre o febrícula. Se resuelve espontáneamente en el curso de
2-4 meses, independientemente del uso de antibióticos, en los huéspedes
inmunocompetentes234. En aproximadamente un 10% de los casos las
manifestaciones son síndrome febril prolongado con hepatoesplenomegalia.
También se han descripto compromiso ocular, óseo, cardiológico o neurológico,
pero en menos del 2% de los casos. Hay una presentación típica llamada síndrome
óculo-ganglionar de Parinaud en la que el paciente presenta fiebre,
conjuntivitis folicular, linfadenopatía regional sensación de cuerpo extraño,
lagrimeo, enrojecimiento y secreción ocular serosa, con resolución al cabo de 2
a 4 meses239.
En un trabajo
realizado por el servicio de Infectología del Hospital Gutiérrez de la Ciudad
de Buenos Aires240, el 35% de los niños presentó enfermedad invasiva: abscesos
esplénicos (75%), abscesos hepáticos (34%), coriorretinitis (13%),
osteomielitis (9%), neumonitis (5%) y eritema nodoso (1.5%). El 41% de los
pacientes con enfermedad sistémica presentó más de un foco clínico,
principalmente granulomas hepáticos y esplénicos. Como dato relevante, la
mediana de edad de los pacientes con coriorretinitis fue mayor que la de otras
manifestaciones (11.7 años). La mediana de duración del tratamiento antibiótico
fue de 21 días, y los pacientes con enfermedades sistémicas recibieron mayor
duración (30 frente a 15 días, p = 0.001). La mitad de la población presentó
síntomas durante 1 a 4 semanas, y casi el 30% los presentó durante más de un
mes.
El pronóstico en la
EAG es bueno, ya que la linfadenopatía suele regresar espontáneamente en 2 a 4
meses. Por otra parte, la infección parece conferir inmunidad de por vida.
Diagnósticos diferenciales: La EAG debe considerarse en todos los pacientes con linfadenopatía
persistente o crónica (≥ 3 semanas). Es la causa más común de linfadenitis
regional en niños y adolescentes. Sus diagnósticos diferenciales son
linfogranuloma venéreo, tuberculosis típica o atípica, adenitis bacteriana,
brucelosis, histoplasmosis, coccidioidomicosis, sarcoidosis, toxoplasmosis,
mononucleosis infecciosa y tumores benignos o malignos241.
Diagnóstico: El diagnóstico debe
basarse en la epidemiología (contacto con gatos), las manifestaciones clínicas
(lesiones con adenopatías sin otro diagnóstico específico), los estudios
serológicos (IgG e IgM) y, de ser posible, la detección de Bartonella en
biopsias/punción de adenopatías o lesiones viscerales237 (A-II). Un resultado positivo en la tinción de plata de Warthin-Starry del
material proveniente de los ganglios linfáticos infectados es útil para
confirmar el diagnóstico, aunque no puede diferenciar las especies de Bartonella242.
Tratamiento: El tratamiento debe
considerar primariamente el cuadro clínico y el estado inmunológico del
paciente. Las recomendaciones están basadas en comunicaciones de casos y en la
opinión de expertos, ya que los ensayos clínicos son escasos242, 243. Solo dos estudios evaluaron el tratamiento con
antibióticos en la EAG. El primero fue un estudio clínico aleatorizado que
demostró superioridad del tratamiento con azitromicina en comparación con
placebo244, y el segundo fue un estudio observacional no aleatorizado que
exhibió superioridad de TMP-SMX frente a ciprofloxacina, gentamicina y
rifampicina o ningún tratamiento245. Otro estudio evaluó a 19 pacientes con EAG
hepatoesplénica y encontró que los pacientes que recibieron rifampicina sola o
en combinación mejoraron más rápidamente que aquellos que recibieron otros
tratamientos (gentamicina o TMP–SMX)246.
Por lo tanto, los
datos disponibles no muestran claramente que algún régimen antibiótico en
particular sea superior para mejorar la tasa de curación o el tiempo para
lograr la curación, e incluso algunos cuestionan la necesidad de tratamiento
antibiótico247. Las recomendaciones más recientes248 sugieren que el tratamiento de elección debería ser
azitromicina (B-II). Otras alternativas terapéuticas son claritromicina,
rifampicina o ciprofloxacina. La combinación de doxiciclina con rifampicina
podría ser una alternativa, particularmente en casos complicados, como
retinitis o compromiso del SNC246 (B-II). No está determinada la duración de este tratamiento.
Prevención: La manipulación de
gatos traería el riesgo de la enfermedad y puede ser grave en niños y huéspedes
inmunocomprometidos. Se debe controlar al gato con veterinario para su
tratamiento. Evitar el depósito de saliva en la piel o heridas por parte del
gato en humanos y cualquier lesión. En inmunocomprometidos se recomienda evitar
la convivencia con gatos en menores de 12 meses249.
Angiomatosis bacilar
Definición: La angiomatosis
bacilar (AB) es una forma de bartonelosis que involucra primariamente a la
piel, acompañada por manifestaciones sistémicas y compromiso de otras vísceras.
Es una enfermedad oportunista producida por Bartonella henselae o Batonella
quintana, que se presenta fundamentalmente en pacientes inmunocomprometidos
por HIV/SIDA (con menos de 100 CD4+) o por otras causas (ej.: trasplante de
órganos sólidos), y es muy rara en sujetos inmunocompetentes.
Microbiología: Se han identificado
más de 30 especies de Bartonella, pero solo 6 son patógenas para el ser
humano. Entre ellas, B. henselae y B. quintana son los agentes
causales de AB250. La infección por B. quintana se encuentra en pacientes de
bajo nivel socio-económico, vagabundos, con alcoholismo crónico y pediculosis
corporal (Pediculus humanus) y sus manifestaciones clínicas se asocian,
además, a compromiso óseo y subcutáneo251, 252. En cambio, B. henselae tiene un reservorio
felino y se asocia a mordeduras o rasguños de gatos y a picaduras de pulgas
portadas por éstos (ectoparásito Ctenocephalides felis)253.
Epidemiología: El gato es el
principal reservorio de B. henselae254-256 y, en la gran mayoría de los casos, permanece
asintomático254. Si bien hay una correlación significativa entre el antecedente de
exposición a gatos y la aparición
de AB, esto no siempre puede demostrarse254, 256, 257. También se halló
este bacilo en otros animales, como el perro, y en insectos como la pulga de
los felinos, las garrapatas y los mosquitos235, 258.
El grado de
inmunocompromiso del paciente determinará las manifestaciones clínicas cutáneas
de las infecciones por B. henselae259. La incidencia reportada de la AB entre las
personas viviendo con HIV es de 1.2 a 1.4 por cada 1000 pacientes260.
Clínica: Lo más frecuente en
pacientes con infección por HIV son las complicaciones dermatológicas:
comienzan como tenues pápulas rojo-purpúreas alargadas, exofíticas, o como
nódulos de consistencia gomosa y firme, móviles o fijos en cualquier parte de
la piel. Las lesiones son de tamaño variable, friables, de fácil sangrado, y
pueden ulcerarse y formar costras. Pueden ser poco numerosas o bien cubrir todo
el cuerpo y se localizan predominantemente en la cara y miembros inferiores261. En el 30% de los
casos hay lesiones óseas por contigüidad. Puede presentarse afectación de
mucosas oral, nasal, anal, conjuntival o gástrica.
La AB puede cursar
con diseminación hematógena, por lo que pueden presentarse fiebre, sudores
nocturnos y pérdida de peso, y evidenciarse compromiso hepático (peliosis),
esplénico, respiratorio, óseo (huesos largos) o ganglionar261. La infección por Bartonella (más
frecuentemente por B. quintana) es una causa relativamente frecuente de
endocarditis con cultivo negativo, tanto en pacientes inmunocompetentes como en
inmunocomprometidos. Es de inicio insidioso con malestar general, mialgias,
astenia, pérdida de peso, fiebre persistente y cefalea. Puede dar también
glomerulonefritis por inmunocomplejos262.
Diagnósticos diferenciales: El principal diagnóstico diferencial de la AB en las personas viviendo
con HIV es el sarcoma de Kaposi. Para eso es necesaria la realización de
biopsia, observándose, en la anatomía patológica, las características
descriptas anteriormente. Sin embargo, en algunos reportes se observó la
coexistencia de ambas enfermedades263.
Otros diagnósticos
diferenciales son granuloma piógeno, histoplasmosis diseminada (variedad
angiomatoide), micobacteriosis atípicas, pseudoangiomatosis eruptiva,
angioqueratoma, angiosarcoma.
Diagnóstico: El diagnóstico de
las infecciones por Bartonella puede resultar difícil porque se trata de
un microorganismo fastidioso, difícil de desarrollar en el cultivo. Las pruebas
serológicas respaldan el diagnóstico, aunque existe reactividad cruzada entre B.
henselae y B. quintana, así como con algunos otros organismos.
El diagnóstico
definitivo de la AB requiere de la biopsia cutánea (B-II), con la
observación histopatología, proliferación y dilatación de capilares y vénulas,
en la dermis con células endoteliales grandes que protruyen hacia la luz
vascular y pueden ocluirla. El estroma circundante muestra un intenso
infiltrado a predominio de polimorfonucleares, con un material granular
correspondiente a los bacilos, que con la coloración argéntica de
Warthin-Starry se tiñen de oscuro257, 264.
La confirmación del
diagnóstico se puede realizar también mediante la técnica de PCR, específica
para cada especie de Bartonella, que es el método de elección para
identificar directamente la bacteria en sangre y en tejidos265 (B-II).
Tratamiento: El tratamiento de
la AB cutánea no se ha examinado sistemáticamente. Según informes de casos y
series pequeñas, el tratamiento recomendado es doxiciclina o eritromicina
durante 3 meses9, 266, 267 (B-II). Como alternativa se puede indicar azitromicina o claritromicina268 (B-II). Tanto las quinolonas como la TMP-SMX tienen variable actividad in
vitro y respuesta clínica pobre, por lo que no están recomendadas.
En una revisión
sistemática publicada recientemente269 se evaluaron casos de pacientes con AB, pero sin
compromiso inmunológico. La conclusión fue que eritromicina debe considerarse
la primera opción, mientras que doxiciclina, claritromicina y rifampicina
serían alternativas válidas. La duración del tratamiento debería ser de entre
1.5 y 3 meses, dependiendo de que se trate de lesiones únicas o múltiples,
respectivamente.
En los casos de
endocarditis confirmada se sugiere el uso de doxiciclina por 6 semanas asociada
con gentamicina durante las primeras 2 semanas, o bien doxiciclina más
rifampicina IV por 6 semanas, seguida de doxiciclina VO sola durante por lo
menos 3 meses267 (B-II).
La duración de la
terapia no se ha determinado y probablemente sea más prolongada en casos con
enfermedad invasiva (B-II). En pacientes inmunosuprimidos, el
tratamiento debe continuarse hasta que se normalice el recuento de células T
CD4+ (B-II). En pacientes con HIV, la terapia antirretroviral es
esencial; sin embargo, se ha informado acerca de la posibilidad de síndrome
inflamatorio de reconstitución inmune268.
Mordeduras de animales y humanas
Definición: Las mordeduras de
animales y humanas son una causa frecuente de consulta al sistema de salud. Se
estima que ocupan aproximadamente el 1-2% de las consultas en salas de urgencia235, 270, 271. El 60-80 % de las mordeduras son causadas por
perros y 20-30% por gatos272. Las mordeduras por otros animales como conejos,
caballos, cerdos, hamsters, ratas o murciélagos son poco frecuentes, pero
también deben ser consideradas235.
Conceptualmente es
la lesión o herida producida por dientes de animales (domésticos o salvajes) o
del hombre, y pueden ser laceradas, avulsivas o punzantes235. Esta definición permite diferenciarlas de otras
lesiones que pueden aparecer en piel por mecanismos que no sean dientes, como,
por ejemplo, las generadas por arañas, que tienen estructuras parecidas a los
colmillos, o las serpientes, que en su mayoría tiene colmillos en filas, en
ambos casos para inocular veneno235, 273.
Epidemiología: Las
mordeduras de animales constituyen un problema endémico de
salud pública, de carácter creciente, que obliga a reflexionar acerca de la
práctica diaria, especialmente en materia preventiva. Se estima que en la
Argentina el 78% de la población tiene mascotas en su casa, en su mayoría
perros (63%)272. Por lo tanto, es el país de América Latina con mayor penetración de
mascotas en hogares, con 9 millones de perros y 3 millones de gatos272. La mayoría de las
mordeduras que ocurren en humanos son caninas, y la población pediátrica es el
foco receptor más importante, con predominio del sexo masculino y una edad
promedio de 4 a 7 años272.
Se estima que hasta
un 50% en las mordeduras producidas por gatos y entre un 5% a 15% de las
causadas por perros y humanos se infectan274. Las mordeduras
humanas representan una pequeña
fracción de las lesiones por mordeduras en general, y son más frecuentes en
niños pequeños, que comúnmente son mordidos por otros niños pequeños en
guarderías o entornos preescolares275. También ocurren en adolescentes y adultos,
típicamente en la mano dominante como resultado de un encuentro de puño contra
diente, en el contexto de peleas.
Microbiología: Las mordeduras de
mamíferos están habitualmente colonizadas por microorganismos proveniente de la
cavidad oral como Streptococcus, Moraxella, Neisseria, Fusobacterium,
Bacteroides, Porphyromonas, y Prevotella spp. Dentro de los BGN, P.
multocida es prevalente en mordeduras de perros (47%) y gatos (75%) así
como también Capnocytophaga canimorsus271, 276. En el caso de mordeduras humanas, Streptococcus
spp es aislado en el 50% de los casos, S. aureus en el 40% y Eikenella
corrodens en un 30%235, 271. En estos casos se debe considerar además el
estudio de HIV y hepatitis B y C235 (Tabla 8).
|
TABLA
8 Patógenos aislados más frecuentemente en mordeduras235, 270, 271 |
|||
|
Tipo de bacteria |
Mordedura de perro |
Mordedura de gato |
Mordedura de humano |
|
Aerobios |
Pasteurella
spp. Pasteurella multocida Streptococcus spp. Staphylococcus
spp. (incuido
SAMR) Neisseria
spp. Capnocytophaga canimorsus |
Pasteurella spp. Streptococcus
spp. Staphylococcus
spp. (incluido SAMR) Moraxella spp. Bartonella henselae |
Streptococcus spp. Staphylococcus
spp. (incluido
SAMR) Eikenella corrodens |
|
Anaerobios |
Fusobacterium spp. Bacteroides
spp. Porphyromonas
spp Prevotella spp. |
Fusobacterium spp. Bacteroides
spp. Porphyromonas
spp. Veillonella |
Bacteroides spp. |
Las heridas
purulentas están dadas en general por microbiota polimicrobiana (aerobia y
anaerobia), mientras que las heridas superficiales no purulentas se producen
por Streptococcus o Staphylococcus, aunque también debe ser
tenida en cuenta Pasteurella spp271. También se deben
considerar las reacciones de anafilaxia secundarias a las mordeduras de
animales, como la producida por lipocalinas, proteínas que se encuentran en
altas concentraciones en la saliva de los caballos2, 77.
Diagnóstico: Debe realizarse una
anamnesis dirigida (incluido el estado de vacunación), evaluación de los
factores de riesgo, examen físico general e inspección de la herida para
evaluar el grado de afectación del tejido muscular, articular, vascular y
nervioso y para detectar signos de infección. Si se sospecha una fractura o un
cuerpo extraño en la herida, están indicados estudios de imagen como
radiografía simple, TAC o RMN; la ecografía se puede utilizar para evaluar las
colecciones de líquido de los tejidos blandos o
la sospecha de formación de abscesos235.
Los animales
domésticos o salvajes son causantes de agresiones, tanto activas como de
defensa. La mayoría de éstas producen lesiones locales leves, aunque en
ocasiones pueden dar lugar a cuadros más graves como musculares, vasculares o
esqueléticas que requieran cirugía reparadora, o síntomas sistémicos
dependientes del tóxico que posean235, 272.
A consecuencia de
la agresión pueden aparecer transmisión de enfermedades, sobreinfección de la
herida por gérmenes de la flora oral del animal, posibilidad de desarrollo de
anafilaxia, efecto tóxico directo por toxinas y afectación psicológica del
paciente agredido278, 279 (Tabla 9).
|
TABLA
9 Patógenos que causan infección sistémica tras mordeduras de diversas especies235, 270, 271 |
|||||||
|
Perro |
Gato |
Roedor |
Rata |
Mono |
Caballo |
Varios animales |
Hombre |
|
Leptospira Virus de la rabia Clostridium tetani Francisella tularensis |
Bartonella henselae Francisella tularensis |
Leptospira |
Spirillum menos Streptobacillus moniliformis |
Herpes
simiae (virus B) |
Rhodo-coccus equii |
Brucella |
Hepatitis
B Hepatitis
C HIV Treponema pallidum |
Dada la elevada
tasa de infección posterior a una mordedura, es necesaria la indicación de
profilaxis antibiótica235, 271.
En cuanto a la
herida en sí, los factores asociados a mayor tasa de infección secundaria a
mordedura son que sea punzante y profunda, que tenga un tamaño >3 cm, que
esté localizadas en manos o extremidades inferiores, que requieran
desbridamiento o que afecten a las articulaciones235, 270, 279.
Los hallazgos que
sugieren infección incluyen enrojecimiento, edema, secreción purulenta, dolor,
fiebre y malestar235, 271 (Tabla 10). En general no es necesario realizar
ningún examen complementario, pero en caso de sospecha de infección se
solicitará cultivo de la herida y hemocultivo ante abscesos, celulitis o
sospecha de sepsis. También se puede hacer radiografía en heridas punzantes
cercanas a los huesos o mordeduras en cuero cabelludo, TAC craneal en sospecha
de herida penetrante (herida profunda de cuero cabelludo o hallazgos
radiológicos de fractura o neumoencéfalo)279.
|
TABLA 10 Heridas por mordeduras: valoración del riesgo de infección235, 270, 271 |
|
Heridas por mordeduras con alto riesgo de infección |
|
Por
la naturaleza de la herida •
Heridas profundas (puntiformes) contaminadas •
Heridas con marcada destrucción tisular, edema, mala perfusión •
Heridas en manos, pies, cara y genitales •
Heridas con sospecha de afectación articular •
Heridas por mordedura cerca de un implante protésico de articulación Por
características del paciente •
Deterioro de la respuesta inmune (inmunodeficiencia, enfermedad hepática
crónica, asplenismo, edad <2 años, diabetes
mellitus) •
Estasis venosa o linfática preexistente en el área de la picadura •
Válvula cardíaca protésica Por
la especie del animal que muerde •
Mordedura humana •
Mordedura de gato |
En el caso de
mordeduras humanas, de ser posible se sugiere solicitar serologías para
hepatitis B, hepatitis C y HIV del agresor. De no ser posible, la víctima debe
ser evaluada para eventual profilaxis271.
Tratamiento:
a) Manejo de la
herida: La limpieza temprana y agresiva de las heridas locales es la
terapia más importante para prevenir infecciones posteriores a mordeduras de
animales.
Se debe realizar
una irrigación de la herida con suero fisiológico, evitando presión excesiva
dentro de la misma, seguida de aplicación de antiséptico local, eliminar el
tejido desvitalizado y retirar cuerpos extraños visibles. Se desaconseja el
cepillado. En el caso de heridas poco extensas, la desinfección con agua
oxigenada es una estrategia muy conveniente. El agua ejerce una acción mecánica
de lavado y el jabón altera la capa lipídica que cubre el virus, lo que
favorece su inactivación. De este modo, se disminuye notoriamente el riesgo de
infección272. La extensión, número y localización de las heridas determinan en
parte la gravedad de la mordedura y la necesidad de sutura quirúrgica; sin
embargo, existen muchos otros aspectos determinantes que se deben investigar
durante la anamnesis270.
El equipo tratante
debe valorar el grado de dolor y su manejo escalonado con apoyo de
sedoanalgesia para la inspección de heridas que así lo requieran280, 281.
No se deben recoger
cultivos de las heridas, salvo que el tiempo de evolución desde la mordedura
sea superior a 12 h o en el caso de que existan signos de infección. En tales
casos, el cultivo se debe recoger antes del lavado de la herida y se deben solicitar
la búsqueda de microorganismos aerobios y anaerobios.
Se debe obtener
asesoramiento quirúrgico en todas las heridas profundas, amplias,
desvitalizadas, infectadas o con afectación ósea o articular. En caso de tejido
necrótico, se debe realizar un desbridamiento quirúrgico, poniendo especial
atención en la eliminación de dientes fracturados, pelos o piel del animal. En
caso de afectación facial, es primordial la valoración precoz por un cirujano
general o un cirujano plástico, para evitar en la medida de lo posible
cicatrices antiestéticas. Se debe realizar una exploración quirúrgica urgente
del sitio en caso de sospecha de gangrena gaseosa, con un desbridamiento
quirúrgico del tejido afectado.
El tipo de cierre
(primario, primario diferido por segunda intención) debe elegirlo el equipo
quirúrgico. La decisión de completar el cierre primario de las heridas por
mordeduras de animales debe tomarse después de considerar el riesgo de
infección y la importancia del resultado cosmético. Existe evidencia limitada
para guiar la práctica del cierre de la herida por mordedura después de la
irrigación y el desbridamiento, y debe evaluarse el incremento del riesgo de
infección con el cierre primario280, 281.
Las laceraciones
resultantes de mordeduras de perro sin afectación ósea, articular o
neurovascular que se presenten dentro de las 8 horas posteriores a la lesión,
se pueden cerrar de manera segura después de una limpieza antiséptica
exhaustiva, irrigación abundante y desbridamiento de los tejidos desvitalizados281.
Para las lesiones
por mordedura en la cara, a menudo se realiza el cierre primario de la herida
por razones cosméticas y, dado el menor riesgo de infección, siempre después de
un tratamiento adecuado de la herida275. Un cierre de una sola capa es óptimo para reducir
el riesgo de infección. No se recomienda el uso de pegamento275, 281.
El afrontamiento se
puede realizar por medio de sutura (con el menor número de puntos posibles),
engrapado o con adhesivos cutáneos (también llamados suturas líquidas) dentro
de 6 a 8 horas después de la lesión. La decisión de cerrar una herida mediante estos
mecanismos dependerá de varios factores: el tipo de animal que causó la
mordedura, el tamaño y la ubicación de la mordedura, el tiempo que haya pasado
desde que se produjo y el estado general de salud del paciente271, 272, 275. Debe tenerse en cuenta que el riesgo de infección
aumenta cuanto más tiempo permanezca abierta la herida. Algunas heridas que
requieren tratamiento pueden cerrarse hasta 24 h después de la lesión272. En general se
considera que no deben cerrarse las heridas por mordedura que ocurrieron más de
24 h las mordeduras en la mano y pies, debido al alto riesgo de infección282.
b) Indicaciones
de profilaxis antibiótica: Se recomienda tanto para la mordedura de animal
como de humano, la limpieza y desbridamiento lo antes posible, y el inicio
temprano de profilaxis antibiótica.
Las situaciones en
las que se debe indicar profilaxis antibiótica después de una lesión por
mordeduras son: mordeduras que resultan en lesiones moderadas a graves,
incluidas las lesiones por aplastamiento; edema preexistente o resultante del
área afectada; heridas punzantes; mordeduras en la cara, la mano, el pie o los
genitales; mordeduras que pueden haber penetrado la cápsula articular, los
tendones o el hueso; presencia de signos y síntomas de infección, y pacientes
con mayor riesgo de infección, (asplenia, afecciones inmunodepresoras;
enfermedad hepática avanzada; implantes (p. ej., válvulas cardíacas
artificiales); edema preexistente o en el área afectada; lesiones moderadas o
graves, particularmente en cara o manos; heridas penetrantes que hayan afectado
el hueso o las articulaciones271, 274-276, 281.
Debido a la
etiología polimicrobiana de las heridas
por mordedura infectadas,
se recomienda la indicación de
antibióticos de amplio espectro que cubran tanto bacterias aeróbicas como
anaeróbicas276. Su instauración debe ser precoz (antes de 12 h) y
extenderse durante 3-5 días235, 278.
Se sugiere el uso
de amoxicilina-ácido clavulánico, y, como alternativas, TMP-SMX o levofloxacina
asociados con metronidazol, o bien clindamicina271, 274, 278,
281, 283.
c) Hospitalización:
La hospitalización está indicada cuando hay signos de compromiso sistémico,
o heridas muy extensas. El manejo debe hacerse de manera multidisciplinaria.
Debe hacerse consulta con un cirujano en aquellas mordeduras de la mano que
afectan a los huesos y/o las articulaciones235.
d) Tratamiento
de las infecciones resultantes de heridas por mordeduras: La terapia
empírica debe dirigirse a los organismos más comunes que causan infecciones por
mordedura. La duración de la terapia depende de la ubicación y la gravedad de
la infección. Los principales factores que determinan el tratamiento son la
ubicación, la profundidad de la mordedura, si fue infligida por un humano o un
animal, y la especie del animal271, 275, 284.
El tratamiento
antibiótico de elección, tanto en adultos como en niños, es amoxicilina-ácido
clavulánico271, 276, o bien ampicilina/sulbactam, en caso de ser
necesaria, la vía endovenosa. Como alternativas se puede considerar
ciprofloxacina o TMP/SMX asociados con clindamicina. La duración del
tratamiento debe ser de entre 5 y 7 días.
Las mordeduras de
animales o humanos deben reevaluarse si los síntomas o signos de infección se
desarrollan o empeoran rápidamente, o no comienzan a mejorar dentro de las 24 a
48 h de tratamiento, si el paciente presenta un malestar sistémico o si hay un
dolor significativo que no guarda proporción con la herida o la infección local284. Considerar la hospitalización, particularmente en niños, cuando se
presentan síntomas o signos de infección después de tomar antibióticos
profilácticos o linfangitis, si no es posible la administración de antibióticos
orales, o si la mordedura es un área de mala circulación, como una extremidad o
parte del cuerpo con estasis venosa o linfática pre-existente284.
Mordeduras con características especiales: Si bien el manejo descripto hasta ahora abarca a
todas las situaciones, hay algunos tipos de mordeduras que requieren la
consideración de ciertos aspectos particulares.
Mordeduras de mono: Tienen una alta
tasa de infección282. Deben ser tenidas en cuenta las infecciones por
virus del herpes B, especialmente cuando se trata de macacos. Las mordeduras,
los arañazos y la exposición a sangre o tejido (especialmente el cerebro) son
los principales modos de transmisión. El período de incubación es de 2 días a 5
semanas, después del cual aparece una lesión vesicular en el sitio de
exposición con síntomas gripales. A esto le siguen síntomas de disfunción del
sistema nervioso central, que incluyen parestesias, debilidad muscular y ataxia.
La prevención incluye la decontaminación completa de la herida inmediatamente
después de la exposición y la profilaxis con valaciclovir (debe ofrecerse hasta
5 días después de la exposición). El tratamiento de una infección activa
incluye aciclovir o ganciclovir intravenosos282.
Mordeduras de gato: Las infecciones por
mordedura de gato pueden ser causadas por Erysipelothrix rhusiopathiae y
rara vez causa infección sistémica
y endocarditis282. Las mordeduras de gato
también pueden transmitir Sporothrix schenckii. Este hongo dimórfico
causa lesiones cutáneas que se propagan proximalmente a lo largo del sistema
linfático (propagación esporotricoide).
La tularemia es una
enfermedad sistémica grave causada por Francisella tularensis. Aunque la
transmisión más común es a través de picaduras de garrapatas, F. tularensis también
puede ser transmitida por gatos, perros, conejos y roedores y puede
transmitirse a los humanos a través de las mordeduras de estos animales282.
Mordeduras de roedores: El riesgo de infección por mordeduras de roedores se estima entre un
2% y un 10%282. La fiebre por mordedura de rata (o enfermedad por
mordedura de rata) es una entidad rara que resulta de la infección por Streptobacillus
moniliformis, una parte de la flora bucal normal de los roedores.
Habitualmente se asocian con síntomas pseudogripales, linfadenitis local y,
ocasionalmente, artritis séptica. A esto le sigue una erupción morbiliforme o
petequial que a menudo afecta las palmas de las manos y las plantas de los pies
y, finalmente, una poliartritis migratoria. El proceso patológico puede complicarse
con pericarditis, endocarditis, neumonitis y sepsis. El tratamiento de elección
es la penicilina282.
Modedura de murciélagos: Las mordeduras por murciélagos son poco frecuentes, pero hay que
tenerlas en consideración en la profilaxis de infección por rabia271, 279. En caso de encontrar un murciélago, se recomienda
evitar tocarlo, y cubrirlo con un recipiente rígido (por ejemplo, un balde), y llevarlo al centro de salud
correspondiente. En caso de sufrir una mordedura por el murciélago, hay que
lavar la herida con abundante agua y jabón, y concurrir rápidamente al centro
de salud o centro antirrábico más cercano para evaluar la administración de
profilaxis antirábica271, 279.
Estado de vacunación e inmunización: Debe ser indicada la vacuna doble adultos (difteria-tétanos) o,
preferentemente, triple acelular (difteriatétanos-pertussis) en caso de que el
paciente no tenga aplicada refuerzo de la vacuna por un período menor a 10 años
o no recuerde haber recibido 3 dosis en la vida235, 271, 272,
285, 286. Aquellas heridas o quemaduras con un importante
grado de tejido desvitalizado, herida punzante, heridas contaminadas con cuerpo
extraño, fracturas con herida, mordeduras, congelación, deben ser consideradas
potencialmente tetanígenas. Si se desconoce el estado de la vacunación y/o se
trata de heridas de alto riesgo (heridas
tetanígenas contaminadas con gran cantidad de material que puede contener
esporas y/o que presenten grandes zonas de tejido desvitalizado) se recomienda
el uso de toxoide tetánico272, 285, 286. En inmunodeprimidos (incluidos HIV) y usuarios de
drogas por vía parenteral, se administra una dosis de toxoide en caso de
cualquier herida tetanígena, independientemente del estado de vacunación272, 285, 286.
Hay que considerar
la administración de vacuna antirrábica en toda persona con mordedura, rasguño,
o lamedura de mucosas o de piel herida producida por animales con rabia
confirmada o animales con sintomatología
compatible, por animales silvestres (murciélagos, zorros, monos, coatíes) o por
perros, gatos, hurones domésticos imposibles de observar o no vacunados, deben
ser considerados para vacunación antirrábica y derivado a centro especializado235, 279, 285,
287.
Síndromes mediados por toxinas bacterianas
Dentro de las IPPB
se reconocen algunas entidades que son causadas principalmente por S. aureus
y S. pyogenes (estreptococo del grupo A), pero en las que el
mecanismo de daño es mediado por toxinas45, 288. Dentro de este
grupo, las más descriptas son el síndrome de la piel escaldada estafilocóccica
y los SST estafilocóccico y estreptocóccico. Sin embargo, también se han
notificado casos clínicos de SST que involucran otras bacterias (Streptococcus
grupos B, C y G, S. epidermidis, Clostrium sordelli o perfringnes,
Yersinia pseudotuberculosis, Pseudomonas fluorescens, Mycoplasma
arthritidis, entre otros)289.
Se trata de
enfermedades agudas, multisistémicas, que a menudo desembocan en insuficiencia
multiorgánica46. Son el resultado de la capacidad de las toxinas
bacterianas de actuar como superantígenos, estimulando la expansión de las
células inmunitarias y la expresión desenfrenada de citoquinas, como el factor
NF kappa B, que desempeña un papel fundamental en la generación y expansión de
la respuesta inflamatoria. Esto provoca una liberación masiva de citocinas
proinflamatorias, y en este contexto se suelen reportar signos clínicos como
extravasación capilar, hipotensión arterial, insuficiencia orgánica y activación
de la coagulación45.
El estafilococo
produce muchas toxinas, las cuales se clasifican según su mecanismo de acción
en citotoxinas, toxinas exfoliativas y leucocidinas290. Las citoxinas producen formación de poros y cambios proinflamatorios
en las células de mamíferos, responsables de las manifestaciones del síndrome
del shock séptico. El gen para la toxina 1 está presente en el 20% de todos los
aislamientos de S. aureus, y es la que se asocia con la producción del
síndrome del SST estafilocóccico. Las toxinas exfoliativas, que incluyen las
toxinas epidermolíticas A y B, causan eritema de piel y desprendimiento, tal
como se observa en los casos del síndrome de piel escaldada. La leucocidina es
una toxina leucocitolítica epidemiológicamente asociada con infecciones
cutáneas graves.
Las principales
exotoxinas superantigénicas descritas en S. pyogenes son las exotoxinas
pirogénicas estreptocócicas (SpE) A, B y C, y el superantígeno estreptocócico A
(SsA). La mayoría de los aislamientos estreptocócicos causantes de SST son los
genotipos emm1 (41.1% de los casos), emm3 (8.4%), emm28 (8.9%) y emm89 (9.8%)291.
La fisiopatología,
presentación clínica y manejo de estas enfermedades han sido ampliamente
descritos. Sin embargo, la mayoría de los datos en la literatura científica
provienen de estudios retrospectivos o in vitro con un bajo nivel de
evidencia289.
Síndrome de la piel escaldada estafilocócica: Enfermedad mediada por las toxinas exfoliativas
epidermolíticas A y B, tras su diseminación hematógena49. Si bien es más frecuente en menores de cinco años, y especialmente
en recién nacidos288, puede ser observada en personas adultas cuando se
presentan algunos factores predisponentes, como enfermedad renal,
inmunocompromiso, septicemia, HIV, alcoholismo, adicción a la heroína y
diabetes292. La toxina se excreta por vía renal, por lo que los
niños y especialmente los recién nacidos con función renal aún inmadura, son
los afectados con mayor frecuencia. Esto también explica por qué este síndrome
es extremadamente infrecuente en adultos sanos288.
Clínicamente se
manifiesta con eritema y dolor cutáneo, con formación de ampollas que se rompen
con facilidad dejando una base húmeda. Al frotar suavemente la piel, se
desprende con facilidad (signo de Nikolsky)293. Finalmente, se produce una descamación de la superficie cutánea
afectada. Las principales complicaciones son: deshidratación e infecciones
cutáneas secundarias. El diagnóstico es fundamentalmente clínico, aunque
también se puede hacer mediante el aislamiento de S. aureus portador del
gen productor de toxinas en cultivo de frotis nasal, faríngeo o conjuntival (no
en las lesiones) (A-II).
El síndrome de piel
escaldada estafilocócico puede limitarse a unas pocas ampollas localizadas que
estallan y dejan una base eritematosa dolorosa (que se manifiesta como impétigo
ampolloso localizado en niños mayores), pero la exfoliación puede afectar toda
la superficie corporal (enfermedad de Ritter en neonatos)288. La tasa de mortalidad asociada a este síndrome es del 5%289.
El diagnóstico
diferencial se deberá hacer con:
quemaduras, síndrome de
Stevens-Johnson, necrólisis epidérmica tóxica o enfermedades ampollosas
autoinmunes288. El tratamiento se administrará por vía endovenosa
con antibióticos
antiestafilocócicos
(cefazolina) y clindamicina (por
su actividad inhibidora de la síntesis de toxinas) (A-II). En caso de
sospecha de SAMR-AC, deberá utilizarse vancomicina (A-II). Además, será
necesario un tratamiento de soporte para evitar trastornos hidroelectrolíticos,
tener un buen control del dolor y
tomar medidas de asepsia en las zonas de piel denudada288 (A-II). Aquellos pacientes
que presentan compromiso del estado general, o los recién nacidos, requieren
internación con aislamiento y la administración de medicación por vía
parenteral (A-II).
SST estafilocócico: El SST
estafilocócico está causado por las cepas de S. aureus productoras de
toxinas (toxina 1 del SST, enterotoxinas B y C)288. Se presenta predominantemente en niños, aunque también se han
descrito casos en adultos, particularmente en mujeres menstruantes289. El diagnóstico es fundamentalmente clínico45, 294, y se basa en los
criterios clínicos y de laboratorio establecidos por el CDC (Tabla 11)45, 295, 296
(A-II). Se caracteriza por un inicio de forma brusca, con fiebre, escalofríos,
cefalea, vómitos, odinofagia, mialgias y diarrea, seguidos a las 24-48 h de
eritrodermia (con afectación palmo-plantar, que se descama 1-2 semanas),
afectación mucosa (hiperemia conjuntival, lengua aframbuesada), hipotensión y
fallo multiorgánico.
|
TABLA 11 Criterios
diagnósticos para los síndromes de shock tóxico estafilocócico y
estreptocóccico, según el Centers for Diseases
Control and Prevention (CDC)289 |
||
|
|
SST estafilocócico |
SSTQ estreptocóccico |
|
Criterios clínicos |
1. Fiebre ≥ 38.9 °C 2. Erupción cutánea: eritrodermia macular difusa 3. Descamación: 1-2 semanas después del inicio de
la enfermedad, especialmente en palmas y plantas 4. Hipotensión: presión arterial sistólica ≤
90 mm Hg en adultos o < percentil 5 en niños menores de 16 años 5. Afectación multisistémica: al menos 3 de las
siguientes: 1. Gastrointestinal: vómitos o diarrea; 2. Muscular: mialgia grave o elevación de la CPK
al doble del límite superior de la normalidad; 3. Mucosas: hiperhememia de cualquier superficie
mucosa; 4. Renal: nitrógeno ureico en sangre o creatinina
al doble del límite superior de la normalidad; 5. Hepático: bilirrubina total al doble del
límite superior de la normalidad; 6. f.
Hematológicos: plaquetas ≤ 100 000/mm3 7. g. Sistema nervioso central: desorientación, agresividad o alteraciones de la consciencia sin signos neurológicos focales |
1. Hipotensión arterial: presión arterial
sistólica ≤90 mm Hg en adultos o <5% percentil para la edad en niños
menores de 16 años 2. Dos o más de los siguientes signos: a. Insuficiencia renal: creatinina ≥2 mg/dl
(>177 μmol/l) en adultos o ≥2 veces el límite superior para la edad
normal. Si existe enfermedad renal preexistente, aumento de más del doble del
valor basal b. Coagulopatía: plaquetas ≤100 000/mm3
o coagulación intravascular diseminada c. Afectación hepática: alanina minotransferasa,
aspartato aminotransferasa o bilirrubina total ≥2 veces el límite superior
normal. Si existe enfermedad hepática preexistente, aumento de más del doble
del valor basal d. SDRA. e. Erupción macular eritematosa generalizada que
puede descamarse f. Necrosis de tejidos blandos, incluida fascitis necrosante o miositis, o gangrena |
|
Criterios de laboratorio |
Resultados
negativos en las siguientes pruebas: 1. Sangre, faringitis o LCR (el hemocultivo puede
ser positivo para S. aureus); 2. Aumento de los títulos de anticuerpos a fiebre maculosa de las Montañas Rocosas, leptospirosis o sarampión |
Aislamiento
de estreptococos b-hemolíticos del grupo A: a. De una zona normalmente estéril (sangre, LCR,
articulación, líquido pericárdico, pleural, líquido peritoneal, biopsia de
tejido); b. De una zona no estéril (faringe, vagina, esputo) |
|
Definición de caso |
SST
probable: caso que cumple 4 de los 5 criterios clínicos y los
criterios de laboratorio SST confirmado: caso que
cumple los 5 criterios clínicos
(incluida la descamación) y los criterios de laboratorio |
STT
probable: caso que cumple la definición de caso clínico y aislamiento de
estreptococos b-hemolíticos del grupo A de
un sitio normalmente no estéril, en
ausencia de otra etiología de la enfermedad SST definitivo: caso que
cumple la definición de caso clínico y aislamiento de estreptococos b-hemolíticos del grupo A de
un sitio normalmente estéril |
|
SST: síndrome de shock tóxico; CPK: creatina fosfoquinasa; SDRA: síndrome de dificultad respiratoria del adulto; LCR: líquido cefalorraquídeo |
||
En cuanto al
tratamiento, es crucial erradicar la fuente de producción de toxinas. En caso
de localizarse, deberá hacerse el control del foco: drenaje/limpieza quirúrgica
o extracción de cuerpo extraño (por ejemplo, tampón)289. El tratamiento antibiótico se deberá administrar por vía endovenosa
con antibióticos antiestafilocócicos (cefalosporinas de primera generación),
añadiendo siempre antibióticos que inhiban la síntesis de toxinas
(clindamicina) (A-II). Se deberán aplicar las medidas de soporte
necesarias para tratar el shock (A-II). En pacientes que no
respondan al tratamiento inicial, está recomendada la administración de
inmunoglobulinas intravenosas en base a la presencia de anticuerpos contra las
toxinas estafilocócicas, aunque la evidencia científica es muy limitada289 (B-III).
SST estreptocócico: El SST
estreptocócico es una complicación de una infección invasiva por S. pyogenes
causada por una tormenta de citoquinas inducida por toxinas
estreptocócicas. El SST estreptocócico se presenta principalmente en pacientes
de edad avanzada, entre 50 y 69 años, y en pacientes con comorbilidades
(diabetes, neoplasias malignas, enfermedad hepática, insuficiencia renal
crónica y enfermedad cardíaca), y se caracteriza por la presencia de
hipotensión y fallo multiorgánico, con una tasa de mortalidad asociada del 14
al 54%289. En la población pediátrica, el SST por SBHGA se
presenta en menos del 5% de las infecciones invasivas, y se asocia con IPPB,
varicela y celulitis o con bacteriemia sin foco definido297, con una elevada tasa de mortalidad93.
Clínicamente se
presenta de forma brusca, con fiebre, mialgias, malestar general y exantema, y
evoluciona rápidamente a hipotensión y fallo multiorgánico.
Los criterios de
diagnóstico del CDC para el SST estreptocócico (Tabla 11) incluyen signos
clínicos de gravedad asociados con la presencia de estreptococos b-hemolíticos del grupo A
en un sitio no estéril (faringe, vagina o esputo) o en un sitio normalmente
estéril (LCR, sangre, líquido peritoneal o biopsia de tejido)45, 295, 296
(A-II). El tratamiento antibiótico se administrará de forma endovenosa,
inicialmente de forma empírica con una
cefalosporina de primera generación (cefazolina) hasta el aislamiento de S.
pyogenes, cuando se hará de forma dirigida con penicilina (A-II). En
cualquier caso, se asociará clindamicina por su efecto inhibidor de la
producción de toxinas (A-II). Algunos estudios sugieren que el uso de
IGIV reduciría la mortalidad, pero la evidencia aún es poco
concluyente288, 289,
298 (B-III). Además, se
deberá realizar el tratamiento de soporte
para el shock y el desbridamiento quirúrgico del foco (por ejemplo,
fascitis necrotizante) en caso de que sea necesario (A-II). Debido a la
creciente resistencia a la clindamicina, linezolid sería una alternativa, ya
que tiene propiedades inhibidoras de toxinas y tiene mayor espectro de
cobertura, aunque su uso debe ser muy cuidadosamente evaluado155, 289.
Bibliografía
1.
Brook I. Microbiology
and management of soft tissue and muscle infections. Int J Surg 2008;
6:328-38.
2.
Ray GT, Suaya JA,
Baxter R. Incidence, microbiology, and patient characteristics of skin and
soft-tissue infections in a U.S. population: a retrospective population-based
study. BMC Infect Dis 2013; 13:252.
3.
Pallin
DJ, Egan DJ, Pelletier AJ, Espinola JA, Hooper DC, Camargo CA. Increased US emergency department visits for skin and
soft tissue infections, and changes in antibiotic choices, during the emergence
of community-associated methicillin-resistant Staphylococcus aureus. Ann
Emerg Med 2008; 51:291–8.
4.
Ki V, Rotstein C.
Bacterial skin and soft tissue infections in adults: a review of their
epidemiology, pathogenesis, diagnosis, treatment and site of care. Can J Infect Dis Med Microbiol 2008; 19:173–84.
5.
Vella V, Derreumaux
D, Aris E, et al. The Incidence of Skin
and Soft Tissue Infections in the United States and associated healthcare
utilization between 2010 and 2020. Open Forum Infect Dis 2024;
11:ofae267.
6.
Eron LJ, Lipsky BA,
Low DE. Managing skin and soft tissue infections: expert panel recommendations
on key decision points. J Antimicrob Chemother 2023; 52:i3–17.
7.
Fernandez
S, de Vedia L, Lopez Furst MJ, et al. Methicillin-resistant
Staphylococcus aureus ST30-SCCmec IVc clone as the major cause of
community-acquired invasive infections in Argentina. Infect Genet Evol 2013; 14:401–5.
8.
Barcelona L,
Musante R, Alonso L, Rodriguez Iantorno M, Guidetto B, Laserre N. Algoritmo de
manejo ambulatorio de infecciones de piel y tejidos blandos de la comunidad.
2021. Parte 1: Supuradas y no supuradas. En: https://bancos.salud.gob.ar/sites/
default/files/2023-12/algoritmo-infeccion-piel-tejidos-blandos-comunidad-parte-1-supuradas-y-nosupuradas.pdf; consultado marzo 2025.
9.
Stevens DL, Bisno AL,
Chambers HF, et al. Practice guidelines for the diagnosis and management of
skin and soft tissue infections: 2014 update by the Infectious Diseases Society
of America. Clin Infect Dis 2014; 59:147–59.
10.
Bermejo A, Clara L,
D Atri GM, et al. Consenso
SADI-SAM-SAD-CACCVE. Guía para el manejo
racional de las infecciones de piel y partes blandas – Parte I. Rev Panam
Infectol 2009; 11:49–65.
11.
Brown J, Shriner DL,
Schwart RA, Janniger CK. Impetigo: an update. Int J Dermatol 2003;
42:251–5.
12.
Cunto ER, Colque
ÁM, Herrera MP, Chediack V, Staneloni MI, Saúl PA. Severe skin and soft tissue infections. An update. Medicina (B Aires)
2020; 80:531–40.
13.
Bermejo A, Clara L,
D Atri GM, et al. Consenso
SADI-SAM-SAD-CACCVE. Guía para el manejo
racional de las infecciones de piel y partes blandas – Parte II. Rev Panam
Infectol 2009; 11:47–62.
14.
Bermejo A, Clara L,
D Atri GM, et al. Consenso
SADI-SAM-SAD-CACCVE. Guía para el manejo
racional de las infecciones de piel y partes blandas – Parte III. Rev Panam
Infectol 2010; 12:60–74.
15.
Aplicación móvil.
Google Play. AntibioticApp®. Revisión: Asoc. Argentina de Farmacéuticos de
Hospital. AAFH. 2024. En Antibiotic app (Screaming Brothers S.A
2021). En: (https://play.google.com/
store/apps/details?id=com.limon.scremingbrothers. atm); consultado marzo 2025.
16.
Hospital de
Pediatría Garrahan. Formulario farmacoterapéutico. En: https://farmacia.garrahan.gov.ar/Vademecum; consultado noviembre 2024.
17.
Trubiano JA, Vogrin
S, Chua KYL, et al. Development and validation of a penicillin allergy clinical
decision rule. JAMA Intern Med 2020; 180:745–52.
18.
Flores R, Villarroel
JL, Valenzuela F. Managing adult skin infections. Rev Med Clin Las Condes 2021;
32:429–41.
19.
Burillo A, Moreno A,
Salas C. Microbiological diagnosis of infections of the skin and soft tissues. Enferm Infecc Microbiol Clin 2007; 25:579–86.
20.
Red WHONET
Argentina. Análisis de RAM-Red WHONET Argentina. Vigilancia de la resistencia
2013-2023. En: http://antimicrobianos.com.ar/wpcontent/uploads/2024/05/Vigilancia-Nacional-de-laResistencia-a-los-Antimicrobianos-Red-WHONETArgentina-Tendencia-2013-2023-parcial.pdf. 2024; consultado marzo 2025.
21.
Mistry RD. Skin and
soft tissue infections in ambulatory care settings: setting a new trend. Clin
Infect Dis 2020; 70:2719–20.
22.
Hatlen TJ, Miller LG.
Staphylococcal skin and soft tissue infections. Infect Dis Clin North Am 2021;
35:81–105.
23.
George S, Muhaj FF,
Nguyen CD, Tyring SK. Antimicrobial resistance: Bacterial pathogens of
dermatologic significance and implications of rising resistance. J Am Acad
Dermatol 2022; 86:1189–204.
24.
Beltran A, Cebollada
R, Lavilla MJ, Torres L. Staphylococcus lugdunensis infection: report of 44
cases. Rev Chilena Infectol 2022; 39: 254-9.
25.
Peisl S,
Guillen-Ramirez H, Sanchez-Tattamull D, et al. Influence of patient
characteristics on microbial composition in surgical-site infections: insights
from national surveillance study. Br J Surg 2024; 111: znae
138.
26.
Menocal MA, Gagetti
P, Lucero C. Distribución y perfil de sensibilidad a los antimicrobianos de
patógenos causantes de infección de piel y partes blandas en Argentina-Red
Whonet-2022. Presentados en el 23° Congreso SADI, oral 433, Buenos Aires,
septiembre 2023. En: https://infectologia.info/
abstracts/distribucion-y-perfil-de-sensibilidad-alos-antimicrobianos-de-patogenos-causantes-deinfeccion-de-piel-y-partes-blandas-en-argentinared-whonet-2022/; 2023; consultado marzo 2025.
27.
Comité Nacional de
Infectología Moyano M, Peuchot A, et al. Infecciones de piel y partes blandas
en pediatría: consenso sobre diagnóstico y tratamiento. Arch Argent Pediatr 2014; 112: 183–91.
28.
Stryjewski ME,
Chambers HF. Skin and soft-tissue infections caused by community-acquired
methicillin-resistant Staphylococcus aureus. Clin Infect Dis 2008; 46:
S368–77.
29.
Bermejo V, Spadaccini
L, Elbert GR, Duarte AIE, Erbin M, Cahn P. Prevalence of methicillin resistant
Staphylococcus aureus in skin and soft tissue infections, in ambulatory
patients. Medicina (B Aires) 2012; 72:283–6.
30.
Cercenado E, de
Gopegui ER. Staphylococcus aureus resistente a la meticilina de origen
comunitario. Enferm Infecc
Microbiol Clin 2008; 26:19–24.
31.
Leme
RCP, Bispo PJM, Salles MJ. Community-genotype
methicillin-resistant Staphylococcus aureus skin and soft tissue infections in
Latin America: a systematic review. Braz J Infect Dis 2021; 25:101539.
32.
López Furst MJ, de
Vedia L, Fernández S, et al. Prospective
multicenter study of community-associated skin and skin structure infections
due to methicillin-resistant Staphylococcus aureus in Buenos Aires, Argentina. PLoS
One 2013; 8:e78303.
33.
Gentile Á, Bakir J,
Ensinck G, et al. Community-acquired methicillin-resistant Staphylococcus
aureus infections: Hospitalization and case fatality risk in 10 pediatric
facilities in Argentina. Arch Argent Pediatr
2018; 116:e47–53.
34.
Servicio
Antimicrobianos. Laboratorio Nacional y Regional de Referencia en Resistencia a
los Antimicrobianos -. Vigilancia de Resistencia a los Antimicrobianos
Instituto Nacional de Enfermedades Infecciosas. ANLIS Dr. Carlos G. Malbrán.
Mapasde-Resistencia-Antimicrobiana-Red-WHONET-Argentina-2022. En: http://antimicrobianos.com.ar/
wp-content/uploads/2023/10/Mapas-de-ResistenciaAntimicrobiana-Red-WHONET-Argentina-2022.pdf; consultado marzo 2025.
35.
Stevens DL, Bryant
AE. Streptococcus pyogenes Impetigo, Erysipelas, and Cellulitis. In: Ferretti
JJ, Stevens DL, Fischetti VA, editors. Streptococcus pyogenes: Basic Biology to
Clinical Manifestations. Oklahoma: University of Oklahoma Health Sciences
Center, 2022.
36.
Bryant AE, Bayer CR,
Aldape MJ, McIndoo E, Stevens DL. Emerging erythromycin and clindamycin
resistance in group A streptococci: Efficacy of linezolid and tedizolid in
experimental necrotizing infection. J Glob Antimicrob Resist 2020;
22:601–7.
37.
DeMuri GP, Sterkel
AK, Kubica PA, Duster MN, Reed KD, Wald ER. Macrolide and clindamycin
resistance in group a streptococci isolated from children with pharyngitis. Pediatr
Infect Dis J 2017; 36:342–4.
38.
Alban J. Treatment of
B-hemolytic Streptococal infection. A study of the pediatric use of
sulphametoxazole. Am J Dis Child 1965; 109:304–7.
39.
Bowen AC, Tong SYC,
Andrews RM, et al. Shortcourse oral co-trimoxazole versus intramuscular
benzathine benzylpenicillin for impetigo in a highly endemic region: An
open-label, randomised, controlled, non-inferiority trial. Lancet 2014;
384:2132–0.
40.
Cho C, Shields RK,
Kline EG, Walsh TL. In vitro activity of clindamycin, doxycycline, and
trimethoprim/sulfamethoxazole against clinical isolates of b-hemolytic Streptococcus spp. via BD Phoenix and broth
microdilution. Antimicrob Steward
Healthc Epidemiol 2023; 3:e238.
41.
Vigliarolo L,
Gazzelli L, Bonofiglio L, Lopardo H. Sensibilidad a trimetoprima-sulfametoxazol
de Streptococcus pyogenes aislados de infecciones invasivas. Medicina (B Aires) 2018; 78:311–4.
42.
Macía-Rodríguez C,
Allende-Castro V, VázquezLedo L, Novo-Veleiro I, González-Quintela A. Skin and
soft-tissue infections: Factors associated with mortality and re-admissions. Enferm Infecc Microbiol Clin 2017; 35:76–81.
43.
Navarro-López J,
Gutiérrez-García A, Vacas-Córdoba M, Arranz-Caso A. Medicine: Programa de
Formación Médica Continuada Acreditado. Medicine 2022; 52:3021–30.
44.
Sullivan T, De Barra
E. Diagnosis and management of cellulitis. Clin Med (Lond) 2018; 18:
160–3.
45.
Lappin E, Ferguson
AJ. Gram-positive toxic shock syndromes. Lancet Infect Dis 2009;
9:281–90.
46.
Suda S, Yamakawa S,
Hayashida K. Toxic Syndromes. In: Téot Luc, Meaume Sylvie, Del Mármol
Veronique, Probst Sebasatian, editors. Skin Necrosis, 2nd ed. Geneva,
Switzerland: Springer, 2024, p 145–50.
47.
Gutiérrez-Sánchez
AM, López-Rojo M, Guerrero Laleona C, Bustillo-Alonso M. Síndrome de shock
tóxico estreptocócico. Rev Pediatr Aten Primaria 2020; 22:59–62.
48.
Amaya Díaz de León
IO, Diaz-Conde M. Síndrome de choque tóxico por Streptococcus pyogenes en un
hospital de la Ciudad de México. Med Crit 2019; 33:334–9.
49.
Daum RS.
Staphylococcus aureus. In: Long SS, Prober CG, Fisher M, editors. Principles
and Practice of Pediatric Infectious Diseases, 5th ed., Philadelphia; CABI
Digital Library, 2018, p 692–706.
50.
Galli L, Venturini
E, Bassi A, et al. Common
community-acquired bacterial skin and soft-tissue infections in children: an
intersociety consensus on impetigo, abscess, and cellulitis treatment. Clin
Ther 2019; 41:532–51.
51.
Cole C, Gazewood J.
Diagnosis and treatment of impetigo. Am Fam Physician 2007; 75:859–64.
52.
Marín
Oliván P, Ferrando Monteleon S, Breton Martinez JR, et al. Prevalence and risk factors for methicillin-resistant
Staphylococcus aureus infection in children. Rev Esp Quimioter 2024;
37:170–5.
53.
Koning S, van
Suijlekom-Smit LWA, Nouwen JL, et al. Fusidic acid cream in the treatment of
impetigo in general practice: Double blind randomised placebo controlled trial.
Br Med J 2002; 324:203–6.
54.
Koning S, van der
Sande R, Verhagen AP, et al. Interventions for impetigo. Cochrane Database
Syst Rev 2012; 1: CD003261.
55.
Hoffman TC, Peiris R,
Glasziou P, Cleo G. Natural history of non-bullous impetigo: a systematic
review of time to resolution or improvement without antibiotic treatment. Br J Gen Pract 2021; 71: e237–42.
56.
Bernabeu J,
Aparicio R, Luque R, Nieto MD. Infectious bacteremic
ecthyma in a patient with HIV infection. Actas Dermosifiliogr 2005; 96:54–5.
57.
Taberner-Pazos B,
Devesa-Jover P, García-Peris M, et al. Lesiones vesiculares, no siempre son
varicela. Rev Pediatr Aten Primaria 2021; 23:391–5.
58.
Galindo E, Hebert AA.
A comparative review of current topical antibiotics for impetigo. Expert
Opin Drug Saf 2021; 20:677–83.
59.
Vázquez NM, Cáceres
Guidó P, Fiorilli G, Moreno S. Emerging mupirocin resistance in
methiciüin-resistant Staphylococcus aureus isolates at a tertiary care
children’s hospital in Argentina. Arch Argent Pediatr 2019; 117:48–51.
60.
Trilla A. Guía para
el control de las infecciones asociadas al cuidado de la salud. Infecciones de
piel y tejidos blandos. En: https://isid.org/wpcontent/
uploads/2019/08/28_ISID_InfectionGuide_Infecciones_PielTejidosBlandos.pdf. 2019; consultado marzo 2025.
61.
Casado-Verrier B,
Gómez-Fernández C, Paño-Pardo JR, et al. Community-acquired methicillin resistant Staphylococcus aureus skin and
soft tissue infections in Madrid: prevalence study. Enferm Infecc Microbiol Clin 2012; 30:300–6.
62.
Arnáiz-García AM,
Anáiz-García ME, Arnáiz J. Forúnculo, forunculosis y ántrax: abordaje y
tratamiento. Med Clin (Barc) 2015; 144:376–8.
63.
Stevens DL, Bisno AL,
Chambers HF, et al. Executive summary: practice guidelines for the diagnosis
and management of skin and soft tissue infections: 2014 update by the
Infectious Diseases Society of America. Clin Infect Dis 2014; 59:147–59.
64.
Naimi TS, LeDell KH,
Como-Sabetti K, et al. Comparison of community and health care-associated
methicillin-resistant Staphylococcus aureus infection. JAMA 2003;
290:2976–84.
65.
Demos M, McLeod MP,
Nouri K. Recurrent furunculosis: a review of the literature. Br J Dermatol 2012;
167:725–32.
66.
Otter JA, French GL.
Molecular epidemiology of community-associated meticillin-resistant
Staphylococcus aureus in Europe. Lancet Infect Dis 2010; 10:227–39.
67.
Leitner
R, Körte C, Edo D, et al. Staphylococcus
aureus meticilino resistente (SAMR) adquirido en la comunidad. Dermatol
Argent 2008; 14:367–71.
68.
González-Domínguez
M, Pascual DB, Puras MS, Sancho CA. Familial furunculosis
associated with a multidrug resistant community clone of methicillin-resistant
Staphylococcus aureus (MRSA) producer Panton Valentine leukocidin (PVL). Enferm
Infec Microbiol Clin 2015; 33:496–8.
69.
Raz R, Miron D,
Colodner R, Staler Z, Keness Y. A 1-year trial of nasal mupirocin in the
prevention of recurrent staphylococcal nasal colonization and skin infection. Arch
Intern Med 1996; 156:1109–12.
70.
Whitman TJ,
Herlihy RK, Schlett
CD, et al. Chlorhexidine-impregnated cloths
to prevent skin and soft-tissue
infection in marine recruits: a cluster-randomized, double-blind, controlled
effectiveness trial. Infect Control Hosp Epidemiol 2010; 31:1207–15.
71.
Rajendran PM, Young
D, Maurer T, et al. Randomized, double-blind, placebo-controlled trial of
cephalexin for treatment of uncomplicated skin abscesses in a population at
risk for community-acquired methicillin-resistant Staphylococcus aureus
infection. Antimicrob Agents Chemother 2007; 51: 4044-8.
72.
Tung-Chen Y,
Carballo-Cardona C. Nontuberculous mycobacteria infection after aesthetic
surgery. Med Clin (Barc) 2017; 149:227–8.
73.
Jabbour SF, Malek AE,
Kechichian EG, Tong RR, Nasr MW. Nontuberculous mycobacterial infections after
cosmetic procedures: a systematic review and management algorithm. Dermatol
Surg 2020; 46:116–21.
74.
Gaspari RJ, Resop D,
Mendoza M, Kang T, Blehar D. A randomized controlled trial of incision and
drainage versus ultrasonographically guided needle aspiration for skin
abscesses and the effect of methicillin-resistant Staphylococcus aureus. Ann
Emerg Med 2011; 57:483–1.
75.
Kaplan RL, Cruz AT,
Michelson KA, et al. Neonatal mastitis and concurrent serious bacterial
infection. Pediatrics 2021; 148:e2021051322.
76.
Stauffer WM, Kamat D.
Neonatal mastitis. Pediatr Emerg Care 2003; 19:165–6.
77.
Liu C, Bayer A,
Cosgrove SE, et al. Clinical Practice
Guidelines by the Infectious Diseases Society of America for the Treatment of
Methicillin-Resistant Staphylococcus aureus Infections in Adults and Children. Clin
Infect Dis 2011; 52:e18–55.
78.
Kaplan SL, Forbes A,
Hammerman WA, et al. Randomized trial of “bleach baths” plus routine hygienic
measures vs routine hygienic measures alone for prevention of recurrent
infections. Clin Infec Dis 2014; 58:679–82.
79.
Johnston SL. Clinical
Immunology Review Series: An approach to the patient with recurrent superficial
abscesses. Clin Exp Immunol 2008; 152:397–405.
80.
Nouwen
JL, Van Belkum A, Verbrugh HA. Determinants of
Staphylococcus aureus nasal carriage. Neth J Med 2001; 59:126–33.
81.
Wertheim HFL, Melles
DC, Vos MC, et al. The role of nasal carriage in Staphylococcus aureus
infections. Lancet Infect Dis 2005; 5:751–62.
82.
Wiseman MC.
Hidradenitis suppurativa: a review. Dermatol Ther 2004; 17:50–4.
83.
Singh S, Desai K,
Guillern S. Management of pilonidal disease and hidradenitis suppurativa. Surg
Clin North Am 2024; 104:503–15.
84.
Humphries AE, Duncan
JE. Evaluation and management of pilonidal disease. Surg Clin North Am 2010;
90:113–24.
85.
List M, Headlee D,
Kondratuk K. Treatment of skin abscesses: a review of wound packing and
post-procedural antibiotics. S D Med 2016; 69:113–9.
86.
Fritz
SA, Hogan PG, Hacek G, et al. Household versus
individual approaches to eradication of community-associated Staphylococcus
aureus in children: a randomized trial. Clin Infect Dis 2012; 54:743–51.
87.
Sartelli M, Guirao X,
Hardcastle TC, et al. 2018 WSES/ SIS-E consensus conference: Recommendations
for the management of skin and soft-tissue infections. World J Emerg Surg 2018;
13:58.
88.
NICE guideline.
Cellulitis and erysipelas: antimicrobial prescribing, 2019 Sep 27. En: https://www.nice.org.uk/guidance/ng141; consultado marzo 2025.
89.
Pirotti D, Alonso
I, Spina S. Infecciones prevalentes en el PNA. Infecciones de piel y partes
blandas. Ministerio de Salud de la Nación. 2018. En: https://www.argentina.gob.ar/sites/default/files/infecciones-prevalentes_uni-8.pdf; consultado marzo 2025.
90.
Roujeau JC,
Sigurgeirsson B, Korting HC, Kerl H, Paul C. Chronic dermatomycoses of the foot
as risk factors for acute bacterial cellulitis of the leg: A case-control
study. Dermatology 2004; 209:301–7.
91.
Semel JD, Goldin H.
Association of athlete’s foot with cellulitis of the lower extremities:
Diagnostic value of bacterial cultures of ipsilateral interdigital space
samples. Clin Infect Dis 1996; 23:1162–4.
92.
Ruhe JJ, Smith N,
Bradsher RW, Menon A. Community-onset methicillin-resistant Staphylococcus
aureus skin and soft-tissue infections: Impact of antimicrobial therapy on
outcome. Clin Infect Dis 2007; 44:774–84.
93.
Gupta D. Bacterial
skin and soft tissue infections in children. Pediatr Infect Dis 2021;
3:146–55.
94.
Eriksson BK. Anal
colonization of group G betahemolytic streptococci in relapsing erysipelas of
the lower extremity. Clin Infect Dis 1999; 29:1319–20.
95.
Norrby A, Eriksson B,
Norgren M, K, et al. Virulence properties of erysipelas-associated group A
streptococci. Eur J Clin Microbiol Infect Dis 1992; 11:1136–43.
96.
Dupuy A, Benchikhi H,
Roujeau JC, et al. Risk factors for erysipelas of the leg (cellulitis):
Case-control study. BMJ 1999; 318:15914.
97.
Yadalla
D, Jayagayathri R, Padmanaban K, et al. Bacterial orbital cellulitis A review. Indian J Ophthalmol 2023;
71:2687–93.
98.
Anosike BI, Ganapathy
V, Nakamura MM. Epidemiology and management of orbital cellulitis in children. J
Pediatric Infect Dis Soc 2022; 11:214–20.
99.
Ambati BK, Ambati J,
Azar N, Stratton L, Schmidt EV. Periorbital and orbital cellulitis before and
after the advent of Haemophilus influenzae type B vaccination. Ophthalmology
2000; 107:1450–3.
100. Aryasit O, Aunruan S, Sanghan N. Predictors of
surgical intervention and visual outcome in bacterial orbital cellulitis. Medicine
(United States) 2021; 100:e26166.
101. Larru B, Gerber JS. Cutaneous bacterial infections
caused by Staphylococcus aureus and Streptococcus pyogenes in infants and
children. Pediatric Clin North Am 2014; 61:457–78.
102. Leggit JC. Acute and chronic paronychia. Am Fam
Physician 2017; 96:44–51.
103. Kaplan RL. Omphalitis: clinical presentation and
approach to evaluation and management. Pediatr Emerg Care 2023;
39:188–9.
104. Celebi Celik F, Tuzun F, Duman N, Keskinoglu P, Kumral
A, Ozkan H. Current factors affecting the risk of omphalitis in newborns: A
prospective casecontrol study. Int J Clin Pract 2021; 75:e14071.
105. Imdad A, Mullany
LC, Baqui AH, et al. The effect of
umbilical cord cleansing with chlorhexidine on omphalitis and neonatal
mortality in community settings in developing countries: A meta-analysis. BMC
Public Health 2013; 13:S15.
106. Imdad A, Mullany
LC, Baqui AH, et al. The effect of
umbilical cord cleansing with chlorhexidine on omphalitis and neonatal
mortality in community settings in developing countries: A meta-analysis. BMC
Public Health 2013; 13:S15.
107. Garcia BM, Cruz-Diaz C, Adnihothri R, Shinkai K.
Distinguishing cellulitis from its noninfectious mimics: approach to the red
leg. Infect Dis Clin North Am 2021; 35:61–79.
108. Keller EK, Tomecki KJ, Alraies MC. Distinguishing
cellulitis from its mimics. Cleve Clin J Med 2012; 79:547–52.
109. Perl B, Gottehrer NP, Raveh D, Schlesinger Y, Rudensky
B, Yinnon AM. Cost-effectiveness of blood cultures for adult patients with
cellulitis. Clin Infect Dis 1999; 29:14838.
110. Duvanel T, Auckenthaler R, Rohner P, Harms M, Saurat
JH. Quantitative cultures of biopsy specimens from cutaneous cellulitis. Arch Intern Med 1989; 149:293–6.
111. Fica A. Celulitis y erisipela: Manejo en atención
primaria. Rev Chilena Infectol 2003; 20:104–10.
112. Corwin P, Toop L, McGeoch G, , et al. Randomised
controlled trial of intravenous antibiotic treatment for cellulitis at home
compared with hospital. BMJ 2005; 330:129.
113. Gabillot-Carré M, Rojeau JC. Acute bacterial skin
infections and cellulitis. Curr Opin Infect Dis 2007; 20:118–23.
114. Hepburn MJ, Dooley DP, Skidmore PJ, et al.
Comparison of short-course (5 days) and standard (10 days) treatment for
uncomplicated cellulitis. Arch Intern Med 2004; 164:1669–74.
115. Bergkvist P, Sjöbeck K. Antibiotic and prednisolone
therapy of erysipelas: a randomized, double blind, placebo-controlled study. Scand
J Infect Dis 1997; 29:377–82.
116. Crum H, Gagnon B, Thuman A, Sidebotton A, Vacquier M,
Gens K. Impact of a pharmacy-driven penicillin allergy de-labeling pilot
program in preoperative cardiothoracic and spine surgery patients at a
quaternary hospital. Allergies 2023; 4:30–41.
117. Raff AB, Kroshinsky D. Cellulitis a review. JAMA 2016;
316:325–37.
118. Esposito S,
Bassetti M, Concia E, et al. Diagnosis and
management of skin and soft-tissue infections (SSTI). A literature review and
consensus statement: an update. J Chemother 2017; 29:197–4.
119. Dalal A, Eskin-Schwartz M, Mimouni D, et al.
Interventions for the prevention of recurrent erysipelas and cellulitis. Cochrane
Database Syst Rev 2017; 6:CD009758.
120. Ong BS, Dotel R, Ngian VJJ. Recurrent cellulitis: who
is at risk and how effective is antibiotic prophylaxis? Int J Gen Med 2022;
15:6561–72.
121. Cannon J, Dyer J, Carapetis J, Manning L. Epidemiology
and risk factors for recurrent severe lower limb cellulitis: a longitudinal
cohort study. Clin Microbiol Infect 2018; 24:1084–8.
122. Karppelin M, Siljander T, Aittoniemi J, et al.
Predictors of recurrent cellulitis in five years. Clinical risk factors and the
role of PTX3 and CRP. J Infect 2015; 70:467–73.
123. Thomas KS, Crook AM, Nunn AJ, et al. Penicillin to
prevent recurrent leg cellulitis. N Engl J Med 2013; 368:1695–3.
124. Peghin M, Graziano E, Rovelli C, Grossi PA. Prevention and treatment of recurrent cellulitis. Curr
Opin Infect Dis 2023; 36:95–101.
125. Cox NH. Oedema as a risk factor for multiple episodes
of cellulitis/erysipelas of the lower leg: a series with community follow-up. Br J Dermatol 2006; 155:947–50.
126. Mihara M, Hara H, Tsubari H, et al. Combined conservative treatment and lymphatic venous
anastomosis for severe lower limb lymphedema with recurrent cellulitis. Ann
Vasc Surg 2015; 29:1318. e11.5--e115.
127. Fisher JM, Feng JY, Tan SY, Mostaghimi A. Analysis of
readmissions following hospitalization for cellulitis in the United States. JAMA
Dermatol 2019; 155:720–3.
128. Funke S, Kuhlmann C, Taha S, Fuchs B, Wiggenhauser PS,
Giunta RE. Searching for evidence: a systematic review of the pathology of
lipoedema. Handchir Mikrochir Plast Chir 2023; 55:411–26.
129. Pavlotsky F, Amrani S, Trau H. Recurrent erysipelas:
risk factors. J Dtsch Dermatol Ges 2004; 2:89–95.
130. Vignes S, Dupuy A. Recurrence of lymphoedema
associated cellulitis (erysipelas) under prophylactic antibiotherapy: A
retrospective cohort study. J Eur Acad Dermatol Venereol 2006;
20:818–22.
131. Leclerc S, Teixeira A, Mahé E, Descamps V, Crickx B,
Chosidow O. Recurrent erysipelas: 47 Cases. Dermatology 2006; 214:52–7.
132. Burgoon R, Weeda E,
Mediwala KN, Raux BR. Clinical utility of
negative methicillin-resistant Staphylococcus aureus (MRSA) nasal surveillance
swabs in skin and skin structure infections. Am J Infect Control 2022;
50:941–6.
133. Chotiprasitsakul D,
Tamma PD, Gadala A, Cosgrove SE. The role of negative
methicillin-resistant staphylococcus aureus nasal surveillance swabs in
predicting the need for empiric vancomycin therapy in intensive care unit
patients. Infect Control Hosp Epidemiol 2018; 39:290–6.
134. Australasian Lymphology Association. Consensus
guideline: management of cellulitis in lymphedema, 2015. En: https://www.lymphoedema.org.au/ about-lymphoedema/consensus-guideline/; consultado marzo 2025.
135. Sharara SL, Maragakis LL, Cosgrove SE. Decolonization of Staphylococcus aureus. Infect Dis
Clin North Am 2021; 35:107–33.
136. British Lymphology Society and the Lymphoedema Support
Network. Guidelines on the Management of Cellulitis in Lymphoedema, 2022. En: https://www.lymphoedema.org/wp-content/uploads/2022/10/
management_cellulitis.pdf; consultado marzo
2025.
137. Webb E, Bissett B, Neeman T, et al. Compression
therapy is cost-saving in the prevention of lower limb recurrent cellulitis in
patients with chronic edema. Lymphat Res Biol 2023; 21:160–8.
138. Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance
definition of health care-associated infection and criteria for specific types
of infections in the acute care setting. Am J Infect Control 2008;
36:309–32.
139. Akramuzzaman SM, Islam MS, Galib A, Hyder CS, Azam
SMG. Risk factors in post operative wound infections following elective
abdominal operations. Med Today 2023; 35:56–2.
140. Santalla A, López-Criado MS, Ruiz MD,
Fernández-Parra J, Gallo JL, Montoya F. Infección de la herida quirúrgica.
Prevención y tratamiento. Clin Invest Ginecol Obstet 2007; 34:189–96.
141. Coccolini F, Roberts D, Ansaloni L, et al. The open
abdomen in trauma and non-trauma patients: WSES guidelines. World J Emerg Surg 2018; 13:7.
142. Pagano I. Instituto Nacional de Epidemiología Dr.
Juan H. Jara. Reporte anual de vigilancia de infecciones asociadas
al cuidado de
la salud 2021. Administración
Nacional de Laboratorios e Institutos de Salud (ANLIS) Dr. C. Malbrán, 2022.
Libro digital, PDF Archivo Digital. Ciudad Autónoma de Buenos Aires, 2022. En: http://sgc.anlis.gob.ar/
handle/123456789/2436 ISBN
978-987-28708-7-4; consultado marzo 2025.
143. Ling ML, Apisarnthanarak A, Abbas A, et al. APSIC
guidelines for the prevention of surgical site infections. Antimicrob Resist
Infect Control 2019; 8:174.
144. Conen A, Stortecky S, Moreillon P, et al. A review of
recommendations for infective endocarditis prevention in patients undergoing
transcatheter aortic valve implantation. EuroIntervention 2021;
16:1135–40.
145. Sartelli M,
Coccolini F, Kluger Y, et al. WSES/GAIS/
WSIS/SIS-E/AAST global clinical pathways for patients with skin and soft tissue
infections. World J Emerg Surg 2022; 17: 3.
146. Burke JF. The effective period of preventive
antibiotic action in experimental incisions and dermal lesions. Surgery 1961;
50:161–8.
147. Huizinga WK, Kritzinger NA, Bhamjee A. The value of
adjuvant systemic antibiotic therapy in localised wound infections among
hospital patients: a comparative study. J Infect 1986: 13:11–6.
148. Bartlett P, Reingold AL, Graham DR, et al. Toxic shock
syndrome associated with surgical wound infections. JAMA 1988; 247:1448–50.
149. Graham DR, O’ Brien M, Hayes JM, Raab MG. Post-operative toxic shock syndrome. Clin Infect
Dis 1995; 20:895–9.
150. Berriós-Torres SI,
Umscheid CA, Bratzler DW, et al. Centers for disease
control and prevention guideline for the prevention of surgical site infection,
2017. JAMA Surg 2017; 152:784–91.
151. World Health Organization, editor. Global Guidelines
for the Prevention for Surgical Site Infection. World Health Organization,
2018. En: https://www. ncbi.nlm.nih.gov/books/NBK536404/; consultado marzo
2025.
152. Calderwood MS, Anderson DJ, Bratzler DW, et al.
Strategies to prevent surgical site infections in acute-care hospitals: 2022
Update. Infect Control Hosp Epidemiol 2023; 44:695–720.
153. Guía
intersociedades de profilaxis
antibiótica quirúrgica en pacientes adultos. 2024. En https://www.sadi.org.ar/novedades/item/1806-guia-intersociedades-de-profilaxis-antibiotica-quirurgica-en-pacientes-adultos; consultado marzo 2025.
154. Allaw F, Wehbe S, Kanj SS. Necrotizing fasciitis: an
update on epidemiology, diagnostic methods, and treatment. Cur Opin Infect
Dis 2024; 37:105–11.
155. Stevens DL, Bryant AE, Goldstein EJ. Necrotizing soft
tissue infections. Infect Dis Clin North Am 2021; 35:135–55.
156. Stevens DL, Bryant AE. Necrotizing soft-tissue
infections. N Eng J Med 2018; 378:970–1.
157. Guliyeva G, Huayllani MT, Sharma NT, Janis JE.
Practical review of necrotizing fasciitis: principles and evidence-based
management. Plast Reconstr Surg Glob Open 2024; 12:e5533.
158. Stevens DL, Aldape MJ, Bryant AE. Life-threatening
clostridial infections. Anaerobe 2012; 18:254–9.
159. De A, Varaiya A, Mathur M, Bhesania A. Bacteriological
studies of gas gangrene and related infections. Indian J Med Microbiol 2003; 21:202–4.
160. Dirección de Epidemiología. Ministerio de Salud de
la Nación. Boletín Epidemológico Nacional. Nro 679. 2023. SE 46. En:
https://www.argentina.gob.ar/sites/default/files/2024/04/ben_679_se_46.pdf.
2023; consultado marzo 2025.
161. World Health Organization. News Diseases Outbreak,
2022. En: https://www.who.int/es/emergencies/diseaseoutbreak-news/
item/2022DON429#:~:text=A%20lo%20largo%20de%202022,ni%C3%B1os%20menores%20de%2010%20a%C3%B1os; consultado marzo 2025.
162. May AK, Talisa VB, Wilfret DA, et al. Estimating the
impact of necrotizing soft tissue infections in the United States: incidence
and re-admissions. Surg Infect (Larchmt) 2021; 22:509.
163. Tam PCK, Kennedy B, Ashokan A. Necrotizing soft tissue
infections in South Australia: a 15-year review. Open Forum Infect Dis 2023;
10:ofad117.
164. Fadel ZT, Burke E, Joukhadar N, Samargandi OA, Bezuhly
M. Effects of seasonal changes in temperature and humidity on incidence of
necrotizing soft tissue infections in Halifax, Canada, 2001-2015. Saudi Med
J 2019; 40:469–74.
165. Gerding DN, Johnson S. Clostridial infections. In:
Goldman L, Schafer AI (eds.), 24th ed. Philadelphia: Goldman Cecil Medicine
2011, pp e304–17.
166. Hadeed G, Smith J, O’Keeffe T, et al. Early surgical
intervention and its impact on patients presenting with necrotizing soft tissue
infections: A single academic center experience. J Emerg Trauma 2016;
9:22–7.
167. Tantirat P, Rattanathumsakul T, Praekunatham H,
Pachanee K, Suphanchaimat R. Epidemiological situation of necrotizing fasciitis
and factors in Thailand and factors associated with its morbidity and
mortality, 2014–2018. Risk Manag Healthc Policy 2020; 13:1613–24.
168. Horn DL, Shen J, Roberts E, et al. Predictors of
mortality, limb loss, and discharge disposition at admission among patients
with necrotizing skin and soft tissue infections. J Trauma Acute Care Surg 2020;
89:186–91.
169. Nawijn F, Smeeing DPJ, Houwert RM, Leenen LPH,
Hietbrink F. Time is of the essence when treating necrotizing soft tissue
infections: A systematic review and meta-analysis. World J Emerg Surg 2020;
15:1–11.
170. Ecker KW, Baars A, Töpfer J, Frank J. Necrotizing
fasciitis of the perineum and the abdominal wallsurgical approach. Eur J
Trauma Emerg Surg 2008; 34:219–28.
171. Anaya DA, McMahon K, Nathens AB, Sullivan SR, Foy H,
Bulger E. Predictors of mortality and limb loss in necrotizing soft tissue
infections. Arch Surg 2005; 140:151–7.
172. Melville S. Clostridia: diarrheal disease, tissue
infection, botulism, and tetanus. In: Engleberg N, DiRita V, Dermody T (eds.).
Schaechter’s Mechanisms of Microbial Disease, 5th ed, New York: Lippincott
Williams & Wilkins, 2012, pp 235–41.
173. Liu TJ, Tai HC, Chien KL, Cheng NC. Predisposing
factors of necrotizing fasciitis with comparison to cellulitis in Taiwan: A
nationwide population based case–control study. J Formos Med Assoc 2020;
119:18–25.
174. Misiakos EP, Bagias
G, Papadopoulos I, al. Early diagnosis and
surgical treatment for necrotizing fasciitis: a multicenter study. Front
Surg 2017; 4:5.
175. Giuliano A, Lewis F, Hadley K, et al. Bacteriology of
necrotizing fasciitis. Am J Surg 1977; 134: 52-7.
176. Naamany E, Shiber S, Duskin-Bitan H, et al.
Polymicrobial and monomicrobial necrotizing soft tissue infections: Comparison
of clinical, laboratory, radiological, and pathological hallmarks and
prognosis. A retrospective analysis. Trauma Surg Acute Care Open 2021;
6:e000745.
177. Wong CH, Chang HC, Pasupathy S, Khin LW, Tan JL, Low
CO. Necrotizing fasciitis: Clinical presentation, microbiology, and
determinants of mortality. J Bone Joint Sur Am 2003; 85:1454-60.
178. Shrestha A, McClane BA. Human claudin-8 and -14 are
receptors capable of conveying the cytotoxic effects of Clostridium perfringens
enterotoxin. mBio 2013; 4:e00594–612.
179. Aldape MJ, Bryant AE, Stevens DL. Clostridium
sordellii infection: Epidemiology, clinical findings, and current perspectives
on diagnosis and treatment. Clin Infect Dis 2006; 43:1436–46.
180. Srivastava I, Aldape MJ, Bryant AE, Stevens DL.
Spontaneous C. septicum gas gangrene: A literature review. Anaerobe 2017;
48:165–71.
181. Davis JS, Mackrow C, Binks P, et al. A double-blind
randomized controlled trial of ibuprofen compared to placebo for uncomplicated
cellulitis of the upper or lower limb. Clin Microbiol Infect 2017;
23:242.
182. Aronoff DM, Bloch KC. Assessing the relationship
between the use of nonsteroidal antiinflammatory drugs and necrotizing
fasciitis caused by group A streptococcus. Medicine 2003; 82:225–35.
183. Henry SM, Davis KA, Morrison JJ, Scalea TM. Can
necrotizing soft tissue infection be reliably diagnosed in the emergency
department? Trauma Sur Acute 2018; 3:e000157.
184. Hua C, Urbina T, Bosc R, et al. Necrotising
soft-tissue infections. Lancet Infect Dis 2023; 23:e81–94.
185. Singer M, Deutschman CS, Seymour C, et al. The third
international consensus definitions for sepsis and septic shock (sepsis-3). JAMA
2016; 315:801–10.
186. Allaw F, Zakhour J, Kanj SS. Community-acquired skin
and soft-tissue infections in people who inject drugs. Cur Opin Infect Dis 2023;
36:105–11.
187. Wu H, Liu S, Li C, Song Z. Modified laboratory risk
indicator for necrotizing fasciitis (M-lrinec) score system in diagnosing
necrotizing fasciitis: A nested case–control study. Infect Drug Resist 2021;
14:2105– 12.
188. Simonart T, Nakafusa J, Narisawa Y. The importance of
serum creatine phosphokinase level in the early diagnosis and microbiological
evaluation of necrotizing fasciitis. J Eur Acad Dermatol Venereol 2004;
18:687–90.
189. Chang CP, Fann WC, Wu SR, Lin CN, Hsiao CT. Lactate on
emergency department arrival as a predictor of in-hospital mortality in
necrotizing fasciitis: A retrospective study. J Orthop Surg Res 2019;
14:1.
190. Stevens DL, Bisno AL, Chambers HF, et al. Practice
guidelines for the diagnosis and management of skin and soft-tissue infections.
Clin Infect Dis 2005; 41:1373–406.
191. Wei X ke, Huo J yi, Yang Q, Li J. Early diagnosis of
necrotizing fasciitis: Imaging techniques and their combined application. Int
Wound J 2024; 21:e14379.
192. Gan RK, Sanchez Martinez A, Abu Hasan MAS, Castro
Delgado R, Arcos González P. Point-of-care ultrasonography in diagnosing
necrotizing fasciitisa literature review. J Ultrasound 2023; 26:343-53.
193. Montravers P, Norrby-Teglund A, Munoz P. Treating
necrotizing skin and soft-tissue infections. Intensive Care Med 2024;
50:1342–5.
194. McDermott J, Kao LS, Keeley JA, Grigorian A, Neville
A, de Virgilio C. Necrotizing soft tissue infections. JAMA Surg 2024; 159:1308.
195. Yang Z, Hu J, Qu Y, et al. Interventions for treating gas gangrene. Cochrane Database Syst Rev 2015;
2015:CD010577.
196. Boyer A, Vargas F, Coste F, et al. Influence of
surgical treatment timing on mortality from necrotizing soft tissue infections
requiring intensive care management. Intensive Care Med 2009; 35:847–53.
197. Howell EC, Keeley JA, Kaji AH, et al. Chance to cut:
Defining a negative exploration rate in patients with suspected necrotizing
soft tissue infection. Trauma Surg Acute Care Open 2019; 4:e000264.
198. Esposito S, Bassetti M, Bonnet E, et al. Hot topics in
the diagnosis and management of skin and soft-tissue infections. Int J
Antimicrob Agents 2016; 48:19–26.
199. Singh A, Ahmed K, Aydin A, Khan MS, Dasgupta P.
Fournier’s gangrene. A clinical review. Arch Ital Urol Androl 2016;
88:157.
200. Roberts JA, Paul SK, Akova M, et al. DALI: Defining
antibiotic levels in intensive care unit patients: Are current ß-lactam
antibiotic doses sufficient for critically ill patients? Clin Infect Dis 2014;
58:1702–83.
201. Bonne SL, Kadri SS. Evaluation and management of
necrotizing soft tissue infections. Infect Dis Clin North Am 2017;
31:497–511.
202. Andreoni F, Zörcher C, Tarnutzer A, et al. Clindamycin
affects group a streptococcus virulence factors and improves clinical outcome. J
Infect Dis 2017; 215:269–77.
203. Babiker A, Li X, Strich JR, et al. Effectiveness of
adjunctive clindamycin in b-lactam antibiotic-treated patients with invasive b-haemolytic streptococcal infections in US hospitals:
a retrospective multicentre cohort study. Lancet Infect Dis 2021;
21:697–710.
204. Urbina T, Razazi K, Ourghanlian C, et al. Antibiotics
in necrotizing soft tissue infections. Antibiotics 2021; 10:1104.
205. Lyons NB, Cohen BL, O’Neil CF, et al. Short versus
long antibiotic duration for necrotizing soft tissue infection: a systematic
review and meta-analysis. Surg Infect (Larchmt) 2023; 24:425–32.
206. Garau J, Blasi F, Medina J, McBride K, Ostermann H.
Early response to antibiotic treatment in European patients hospitalized with
complicated skin and soft tissue infections: Analysis of the REACH study. BMC
Infect Dis 2015; 15:1–9.
207. Faraklas I, Yang D, Eggerstedt M, et al. A multicenter
review of care patterns and outcomes in necrotizing soft tissue infections. Surg
Infect (Larchmt) 2016; 17:773–8.
208. Zhang R, Zhang Y, Hou L, Yan C. Vacuum-assisted
closure versus conventional dressing in necrotizing fasciitis: a systematic
review and meta-analysis. J Orthopaedic Surg Res 2023; 18:1–9.
209. Kroger AT, Atkinson WL, Marcuse EK, et al. General
recommendations on immunization: recommendations of the Advisory Committee on
Immunization Practices (ACIP). MMWR Recomm Rep 2006; 55:1–48.
210. Willy C, Rieger H, Vogt D. Hyperbaric oxygen therapy
for necrotizing soft tissue infections: contra. Chirurg 2012; 83:
960-72.
211. Sissolak D, Weir WRC. Tropical pyomyositis. J
Infect 1994; 29:121–7.
212. Narayanappa G, Nandeesh BN. Infective myositis. Brain
Pathology 2021; 31:e12950.
213. Spinnato P, Patel DB, Di Carlo M, et al. Imaging of musculoskeletal soft-tissue infections in
clinical practice: a comprehensive updated review. Microorganisms 2022;
10:2329.
214. Ngor C, Hall L, Dean JA, Gilks CF. Factors associated
with pyomyositis: A systematic review and metaanalysis. Trop Med Int Health 2021;
26:1210–9.
215. Pannaraj PS, Hulten KG, Gonzalez BE, Mason EO, Kaplan
SL. Infective pyomyositis and myositis in children in the era of
community-acquired, methicillin-resistant Staphylococcus aureus infection. Clin
Infect Dis 2006; 43:953–60.
216. Gafur OA, Copley LAB, Hollmig ST, Browne RH, Thornton
LA, Crawford SE. The impact of the current epidemiology of pediatric
musculoskeletal infection on evaluation and treatment guidelines. J Pediatr
Orthop 2008; 28:777–85.
217. Crum NF. Bacterial pyomyositis in the United States. Am
J Med 2004; 117:420–8.
218. Vij N, Ranade AS, Kang P, Belthur M V. Primary
bacterial pyomyositis in children: a systematic review. J Pediatr Orthop 2021;
41:e849–54.
219. Garcia-Lechuz JM, Cuevas O, Castellares C,
Perez-Fernandez C, Cercenado E, Bouza E. Streptococcus pneumoniae skin and soft
tissue infections: Characterization of causative strains and clinical illness. Eur
J Clin Microbiol Infect Dis 2007; 26:247–53.
220. Theodorou SJ, Theodorou DJ, Resnick D. MR imaging
findings of pyogenic bacterial myositis (pyomyositis) in patients with local
muscle trauma: Illustrative cases. Emerg Radiol 2007; 14:89–96.
221. Unnikrishnan PN, Perry DC, George H, Bassi R, Bruce
ED. Tropical primary pyomyositis in children of the UK: an emerging medical
challenge. Int Orthop 2010; 34:109–13.
222. Habeych ME, Trinh T, Crum-Cianflone NF. Purulent
infectious myositis (formerly tropical pyomyositis). Neurol Sci 2020;
413:116767.
223. Saeed K, Esposito S, Gould I, et al. Hot topics in
necrotising skin and soft tissue infections. Int J Antimicrob Agents 2018;
52:1–10.
224. Turecki MB, Taljanovic MS, Stubbs AY, et al. Imaging
of musculoskeletal soft tissue infections. Skeletal Radiol 2010;
39:957–71.
225. Browne LP, Mason EO, Kaplan SL, Cassady CI,
Krishnamurthy R, Guillerman RP. Optimal imaging strategy for community-acquired
Staphylococcus aureus musculoskeletal infections in children. Pediatr Radiol
2008; 38:841–7.
226. Lin MY, Rezai K, Schwartz DN. Septic pulmonary emboli
and bacteremia associated with deep tissue infections caused by
community-acquired methicillin-resistant Staphylococcus aureus. J Clin
Microbiol 2008; 46:1553–5.
227. Campbell KM, Vaughn AF, Russell KL, et al. Risk
factors for community-associated methicillin-resistant Staphylococcus aureus
infections in an outbreak of disease among military trainees in San Diego,
California, in 2002. J Clin Microbiol 2004; 42:4050–3.
228. Palacio EP, Rizzi NG, Reinas GS, et al. Open drainage versus percutaneous drainage in the
treatment of tropical pyomyositis. Prospective and randomized study. Rev
Bras Orthop 2015; 45:260–8.
229. Lorenz JM, Al-Refaie WB, Cash BD, et al. ACR
appropriateness criteria radiologic management of infected fluid collections. J
Am Col Radiol 2015; 12:191–9.
230. Harbarth SJ, Lew DP. Pyomyositis as a nontropical
disease. Curr Clin Top Infect Dis 1997; 17: 37–50.
231. Weigelt J, Itani K, Stevens D, Lau W, Dryden M,
Knirsch C. Linezolid versus vancomycin in treatment of complicated skin and
soft tissue infections. Antimicrob Agents Chemother 2005; 49:2260–6.
232. Arbeit RD, Maki D, Tally FP, Campanaro E, Eisenstein
BI. The safety and efficacy of daptomycin for the treatment of complicated skin
and skin-structure infections. Clin Infect Dis 2004; 38:1673–81.
233. File TM, Wilcox MH, Stein GE. Summary of ceftaroline
fosamil clinical trial studies and clinical safety. Clin Infect Dis 2012; 55(Suppl. 3):s173–80.
234. Ojeda María Nieves. Bartonella henselae. Enfermedad
por arañazo de gato. In: Sociedad Argentina de Pediatría, editor. Libro Azul de
Infectología Pediátrica. 5th ed. Buenos Aires,
Argentina, SAP, 2022, pp 494–7.
235. Rothe K, Tsokos M, Handrick W. Animal and human bite
wounds. Dtsch Arztebl Int 2015; 112:433–42.
236. Kaufman SC,
Armitano RI. Bartonella. En: Lopardo HA, Predari SC, Vay C
(eds.). Manual de Microbiología Clínica de la Asociación Argentina de
Microbiología. Buenos Aires, Argentina: Asociación Argentina de Microbiología,
2019, pp 6–38.
237. Armitano R, Lisa A, Martinez C, et al. Enfermedad
por arañazo de gato: utilidad diagnóstica de la determinación de anticuerpos
por serología. XVII Congreso SADI Mar del Plata 2017. En: https://infectologia.info/abstracts/enfermedad-por-aranazo-degato-utilidad-diagnostica-de-la-determinacion-deanticuerpos-por-serologia/; consultado marzo 2025.
238. Deregibus MI, Bagnara EI, Buchovsky A. Cat-scratch
disease: experience in a tertiary care children’s hospital. Arch Argent Pediatr 2023; 121:e202202592.
239. Díaz Hernández LI, Wallis Gómez VG, Díaz de
Bethencourt Pardo R, Hernández Pérez C, Ramos Pérez M. Síndrome oculoglandular
de Parinaud. A propósito de un caso clínico. Canarias Pediátrica 2021;
45:52–5.
240. Martínez Lindado MA, Praino ML, Caratozzolo A, et
al. Cat scratch disease in pediatrics: Who has systemic
involvement? Ped Infect Dis J 2025; 44:18–23.
241. Margileth AM. Recent advances in diagnosis and
treatment of cat scratch disease. Curr Infect Dis Rep 2000; 2:141–6.
242. Florin TA, Zaoutis
TE, Zaoutis LB. Beyond cat scratch
disease: widening spectrum of Bartonella henselae infection. Pediatrics 2008;
121:e1413–25.
243. Prutsky G, Domecq JP, Mori L, et al. Treatment
outcomes of human bartonellosis: a systematic review and meta-analysis. Int
J Infect Dis 2013; 17:e811–9.
244. Bass JW, Freitas BC, Freitas AD, et al. Prospective
randomized double blind placebo-controlled evaluation of azithromycin for
treatment of cat-scratch disease. Pediatr Infect Dis J 1998; 17:447–52.
245. Collio PJ. Cat-scratch disease: therapy with
trimethoprim-sulfamethoxazole. Am J Dis Child 1992; 146:397–9.
246. Arisoy ES, Correa
AG, Wagner ML, Kaplan SL. Hepatosplenic
cat-scratch disease in children: Selected clinical features and treatment. Clin Infect Dis 1999; 28:778–84.
247. Peña Irún A, González Santamaría A, García Espinosa
R, Cavadas López A. Enfermedad por arañazo de gato ¿Es necesario el tratamiento
antibiótico? Semergen 2012; 38:342–3.
248. Rolain JM, Brouqui P, Koehler JE, Maguina C, Dolan MJ,
Raoult D. Recommendations for treatment of human infections caused by
Bartonella species. Antimicrob Agents Chemother 2004; 48:1921–33.
249. López J, Peña A, Pérez R, Abarca K. Pet ownership in
inmunocompromised patients: Update and veterinary and medical considerations. Rev
Chil Infectol 2013; 30:52–62.
250. Grilo N, Modi D, Barrow P. Cutaneous bacillary
angiomatosis: a marker of systemic disease in HIV. S Afr Med J 2009; 99:220–1.
251. Abarca V K, Vial C PA, Rivera M M, et al. Infección
por Bartonella henselae en pacientes inmunocompetentes: Enfermedad por arañazo
de gato. Rev Med Chil 1996; 124:1341–9.
252. Vásquez T P,
Chanqueo Cornejo L, García C P, et al. Bacillary angiomatosis caused by Bartonella quintana in a human
immunodeficiency virus positive patient. Rev Chil Infectol 2007;
24:155–9.
253. Foucault C, Brouqui P, Raoult D. Bartonella quintana
characteristics and clinical management. Emerg Infect Dis 2006;
12:217–23.
254. Gasquet S, Maurin M, Brouqui P, Lepidi H, Raoult D.
Bacillary angiomatosis in immunocompromised patients. AIDS 1998;
12:1793–803.
255. Maurin M, Raoult D. Bartonella infections: Diagnostic
and management issues. Curr Opin Infect
Dis 1998; 11:189.
256. Koehler JE, Sanchez MA, Garrido CS, et al. Molecular Epidemiology of Bartonella infections in
patients with bacillary angiomatosis–peliosis. N Engl J Med 1997; 337:1876–3.
257. Bermejo A, da Bouza J, Corti M. Angiomatosis
bacilar. Arch Argent Dermatol 1992; 42:127–32.
258. Kaiser PO, Riess T, O’Rourke F, Linke D, Kempf VAJ.
Bartonella spp.: Throwing light on uncommon human infections. Int J Med
Microbiol 2011; 301:7–15.
259. Rose SR, Koehler JE. Bartonella, including Cat-Scrach
Disease. In: Bennett J, Dolin R, Blajer MJ (eds.). Mandell, Douglas and
Bennett´s Principles and Practice of Infectious Diseases, 9th ed., Elsevier,
2020.
260. Gazineo JLD, Trope BM, Maceira JP, et al. Bacillary
angiomatosis: Description of 13 cases reported in five reference centers for
aids treatment in Rio de Janeiro, Brazil. Rev Inst Med Trop Sao Paulo 2001;
43:254–0.
261. Koehler JE, Sanchez MA, Tye S, et al. Prevalence of
Bartonella infection among human immunodeficiency virus-infected patients with
fever. Clin Infect Dis 2003; 37:559–66.
262. Raybould JE, Raybould AL, Morales MK, et al.
Bartonella endocarditis and pauci-immune glomerulonephritis: a case report and
review of the literature. Infect Dis Clin
Pract 2016; 24:254–60.
263. Cárdenas GL, Vittar NS, Ricart J, et al.
Angiomatosis bacilar y sarcoma de Kaposi en lesión cutánea de paciente VIH
positivo. Actual SIDA Infectol 2023; 31:104–9.
264. Doern G V. Detection of selected fastidious bacteria. Clin
Infect Dis 2000; 30:166–73.
265. Sander A, Posselt M, Böhm N, Ruess M, Altwegg M.
Detection of Bartonella henselae DNA by two different PCR assays and
determination of the genotypes of strains involved in histologically defined
cat scratch disease. J Clin Microbiol 1997; 37:993–7.
266. Ramírez Ramírez CR,
Saavedra S, Ramírez Ronda CH. Bacillary
angiomatosis: microbiology, histopathology, clinical presentation, diagnosis
and management. Bol
Asoc Med P R 1996;
88:46–51.
267. Sociedad Argentina de Infectología. Recomendaciones
de diagnóstico y tratamiento de infecciones oportunistas en población con VIH.
En: https://www.sadi.org.ar/publicaciones/item/1627-recomendaciones-de-diagnostico-y-tratamiento-de-infecciones-oportunistas-en-poblacion-con-vih. 2023; consultado marzo 2025.
268. Dallapiazza M, Akiyama MJ. The first report of
bartonella quintana immune reconstitution inflammatory syndrome complicated by
Jarisch-Herxheimer reaction. J Int Assoc Provid AIDS Care 2017;
16:321–3.
269. Rotundo S, Tassone
MT, Marascio N, et al. A systematic review
on antibiotic therapy of cutaneous bacillary angiomatosis not related to major
immunocompromising conditions: from pathogenesis to treatment. BMC Infect Dis 2024; 24:380.
270. Piñeiro Pérez R, Carabaño Aguado I. Manejo práctico
de mordeduras en atención primaria y en nuestro medio. Rev Pediatr Aten
Primaria 2015; 17:263–770.
271. Barcelona L, Musante R, Alonso L, Rodríguez Iantorno
P, Guidetto B, Laserre N. Algoritmo de manejo ambulatorio de Infección de piel
y tejidos blandos de la comunidad. 2021. Parte 2: Infecciones en pie diabético
y mordeduras. En: https://bancos.salud.gob.ar/sites/default/files/2023-12/algoritmo-infeccion-piel-tejidos-blandos-comunidad-parte-2-piediabetico-y-mordeduras.pdf;
consultado marzo 2025.
272. Comité Nacional de Prevención de Lesiones Consenso:
niños y mascotas. Arch Argent Pediatr 2020; 118:s69–106.
273. Orduna T, Lloveras S, de Roodt AR, Costa de Oliveira
V, Garcías SI, Haas AI. Guía de Prevención, Diagnóstico, Tratamiento y
Vigilancia Epidemiológica de los Envenenamientos Ofídicos. 1a ed. Buenos Aires:
Ministerio de Salud de la Nación. Programa Nacional de Prevención y Control de
las Intoxicaciones, 2014. En: https://bancos.salud.gob.ar/sites/
default/files/2018-10/0000000529cnt-ofidismo_interior_v8.pdf; consultado marzo 2025.
274. Kimberlin VW, Barnett ED, Lynfield R, Saywer MH. 2021.
Bite Wounds. In: Red Book: 2021–2024 Report of the Committee on Infectious
Diseases, Committee on Infectious Diseases, Illinois: American Academy of
Pediatrics, 2021, pp 169–75.
275. Greene SE, Fritz SA. Infectious complications of bite
injuries. Infect Dis Clin North Am 2021; 35:219–36.
276. Yaqub S, Bjørnholt J V, Hellum KB, Steinbakk M, Enger
AE. Bite wound infections. Tidsskr Nor Laegeforen 2004; 124:3194–6.
277. Jofré Morales L, Perret P C, Abarca V K, Solari G V,
Olivares C R, López Del P J. Guidelines for management of animal bites. Rev Chile Infectol 2006; 23:20–34.
278. Pardal-Peláez B, Sarmiento-García A. Microbiología
de las infecciones causadas por mordeduras de perros y gatos en personas: Una
revisión. Rev Chil Infectol 2021; 38:393–400.
279. Pérez Cánovas C. Mordeduras y picaduras de animales.
Protoc Diagn Ter Pediatr 2020; 1: 307–19.
280. Touzet-Roumazeille S, Jayyosi L, Plenier Y, Guyot E,
Guillard T, François C. Surgical management of animal bites in children. Ann
Chir Plast Esthet 2016; 61:560–7.
281. Cunningham A, Camillon T, Chao S. Surgical management
of pediatric dog bites: a systematic review and treatment guideline. J
Pediatric Surg 2025; 60:161984.
282. Schlein S, Park A, Sethi S. Animal bites and attacks. Emerg
Med Clin North Am 2024; 42:639–52.
283. Yaqub S, Bjørnholt JøV, Hellum KB, Steinbakk M, Enger
AE. Bite wound infections. Tidsskr Nor Laegeforen 2004; 124:3194–6.
284. Fielding P, Messahel S. Guideline review – human and
animal bites: antimicrobial prescribing. Arch Dis Child Educ Pract Ed 2022; 107:442–5.
285. Comité Asesor de Vacunas e Inmunizaciones.
Inmunización profiláctica post-exposición Manual de inmunización en línea de la
Asociación Española de Pediatría (AEP). Comité Asesor de Vacunas e
Inmunizaciones, 2024. En: https://vacunasaep.org/ documentos/manual/cap-9; consultado marzo 2025.
286. Ministerio de Salud Secretaría de Programas
Sanitarios. Subsecretaría de Programas de Prevención y Promoción. Dirección
Nacional de Programas Sanitarios Dirección de Epidemiología. Departamento de
Inmunizaciones. Tétanos. Recomendaciones Nacionales de Vacunación. En: https://bancos.salud.gob.ar/sites/default/files/2018-10/0000000042cnt03-normas-vacunacion-08.pdf; consultado marzo 2025.
287. Ministerio de Salud de la Nación. Guía para la
prevención, vigilancia y control de la rabia en la Argentina. En: https://bancos.salud.gob.ar/recurso/
guia-de-rabia; consultado marzo
2025.
288. Marin Cruz I, Carrasco Colom J. Infecciones de piel
y partes blandas. Protoc Diagn Ter
Pediatr 2023; 2: 271-83.
289. Atchade E, De Tymowski C, Grall N, Tanaka S,
Montravers P. Toxic shock syndrome: a literature review. Antibiotics 2024; 13:96.
290. Hurtado MP, De La Parte MA, Brito Y. Staphylococcus
aureus: Revisión de los mecanismos de patogenicidad y la fisiopatología de la
infección estafilocócica. Rev Soc Ven Microbiol
2002; 22:112–8.
291. Plainvert C, Doloy A, Loubinoux J, et al. Invasive
group A streptococcal infections in adults, France (2006–2010). Clin
Microbiol Infect 2012; 18:702–10.
292. Patel NN, Patel DN. Staphylococcal scalded skin
syndrome. Am J Med 2010; 123:505–7.
293. Neylon O, O’Connell NH, Slevin B, et al. Neonatal
staphylococcal scalded skin syndrome: Clinical and outbreak containment review.
Eur J Pediatr 2010; 169:1503–9.
294. Hoge CW Selina, Schwartz B, Talkington DF, Breiman RF,
Mac Neill EM, Englender SJ. The changing epidemiology of invasive group A
streptococcal infections and the emergence of streptococcal toxic shock-like
syndrome. A retrospective population-based study. JAMA 1993; 19:384–9.
295. Berger S, Kunerl A, Wasmuth S, Tierno P, Wagner K,
Brügger J. Menstrual toxic shock syndrome: case report and systematic review of
the literature. Lancet Infect Dis 2019; 19:e313–21.
296. Wilkins AL, Steer AC, Smeesters PR, et al. Toxic shock
syndrome – the seven Rs of management and treatment. J Infect 2017;
74:S147–52.
297. American Academy of Pediatrics Committee on Infectious
Diseases. Red Book 2018: Report of the Committee on Infectious Diseases [31
ed.]. 31st ed. David W Kimberly, editor. 2018. American Academy of Pediatrics,
Elk Grove Village, p 748–53.
298.
Bhavsar SM. Group A Streptococcus
Infections. Pediatr Rev 2024; 45:143–51.
299.
De Vedia L, Rodríguez C, Torres M, Zujlevic N, Puscama A, Clara L,
Sandor A, Nemirovsky C, Di Líbero E, Mykietiuk A, Leiro V, Kantor B, Fernández Pardal P, Peña ME, Pedraza Salazar I, Zylberman M, Romani A,
Barberis C, Bonesi L, Di Cugno L, Amalfa F, Israel AM, Cunto E, Flores Montes
M, Moyano M, Poggio JM, Margarí A, Rotryng F, Barberis F, Pujato N, Ferrucci G,
Greco MM, Bello N. Guía de manejo de las infecciones de piel y partes
blandas [Skin and soft tissue infections management guideline]. Medicina (B
Aires). 2025 May;85 Suppl 3:14-76. Spanish. PMID: 40434403.